Tumori maligni dell'osso temporale
- Categoria: QUADRI CLINICI OTONEUROLOGICI DELLE LESIONI DELL’ANGOLO PONTO-CEREBELLARE E DELLA FOSSA CRANICA POSTERIORE
- Pubblicato: Giovedì, 15 Dicembre 2016 17:00
- Visite: 71674
TUMORI MALIGNI DELL’OSSO TEMPORALE
 Il Carcinoma dell'osso temporale è raro, che rappresentano meno dello 0,2% di tutti i tumori della testa e del collo. Solo 200 nuovi casi di tumore dell'osso temporale possono essere diagnosticati ogni anno negli Stati Uniti. Questo numero include i tumori derivanti dalla pelle del padiglione auricolare che si diffondono per l'osso temporale; tumori primari del condotto uditivo esterno (EAC), orecchio medio, mastoide, o apice petrosa; e lesioni metastatiche all'osso temporale. Tra i tumori maligni dell’orecchio i più frequenti sono il carcinoma squamoso e l’adenocarcinoma . Raro è il carcinoma adenoido-cistico ed eccezionali risultano i sarcomi: rabdomiosarcoma e fibrosarcoma che compaiono soprattutto nei soggetti di giovane età e presentano un’evoluzione più rapida dei carcinomi e una maggior tendenza a diffondersi. I carcinomi possono localizzarsi a livello dell’osso temporale e della rocca petrosa come avviene per le metastasi di carcinomi del seno, rene, polmone, stomaco, laringe, prostata e della tiroide. Inoltre, l’osso temporale può venire interessato per continuità da neoplasie localizzate in sedi anatomiche limitrofe come la ghiandola parotide e il rinofaringe
Il Carcinoma dell'osso temporale è raro, che rappresentano meno dello 0,2% di tutti i tumori della testa e del collo. Solo 200 nuovi casi di tumore dell'osso temporale possono essere diagnosticati ogni anno negli Stati Uniti. Questo numero include i tumori derivanti dalla pelle del padiglione auricolare che si diffondono per l'osso temporale; tumori primari del condotto uditivo esterno (EAC), orecchio medio, mastoide, o apice petrosa; e lesioni metastatiche all'osso temporale. Tra i tumori maligni dell’orecchio i più frequenti sono il carcinoma squamoso e l’adenocarcinoma . Raro è il carcinoma adenoido-cistico ed eccezionali risultano i sarcomi: rabdomiosarcoma e fibrosarcoma che compaiono soprattutto nei soggetti di giovane età e presentano un’evoluzione più rapida dei carcinomi e una maggior tendenza a diffondersi. I carcinomi possono localizzarsi a livello dell’osso temporale e della rocca petrosa come avviene per le metastasi di carcinomi del seno, rene, polmone, stomaco, laringe, prostata e della tiroide. Inoltre, l’osso temporale può venire interessato per continuità da neoplasie localizzate in sedi anatomiche limitrofe come la ghiandola parotide e il rinofaringe
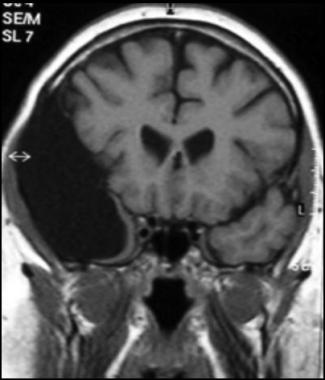
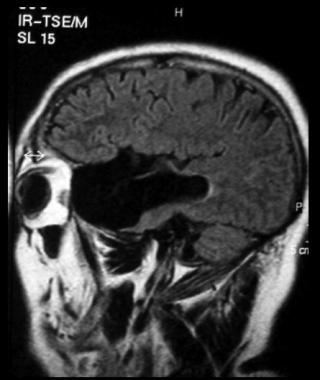
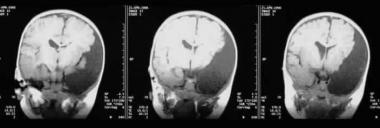
Vedere l'immagine qui sotto.
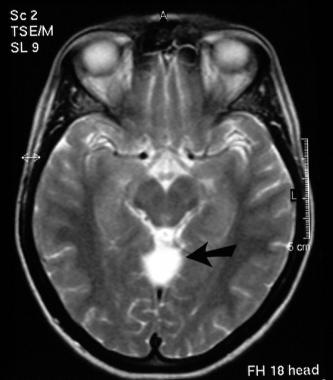
Immagine Assiale che Mostra la Diffusione del Cancro nell'osso Temporale.
Anatomia dell'osso temporale
L'osso temporale è posizionato tra la metà e fossa cranica posteriore ed è costituito da quattro segmenti distinti: petroso, squamose, mastoide, e timpanica, 1 La parte petrosa dell'osso temporale contribuisce alla base del cranio sia della media e fossa posteriore, ed è diretta anteriormente e medialmente, giustapponendo la clivus e sfenoide. La porzione squamoso contribuisce al cranio laterale che racchiude il lobo temporale del cervello. La parte mastoide contribuisce alla base cranica inferiore-laterale, ed entrambi si allarga e pneumatizza nei primi anni di vita da sovrapporsi alla fine forame stylomastoid Il segmento timpanica, anche se poco sviluppata alla nascita, costituisce la maggior parte del externa ossea! condotto uditivo (EAC) e cresce fino a scadenza da età 3. I forame di Huschke delinea la chiusura inadeguata dell'anello timpanica anteriormente.
 La Pneumatizzazione delle porzioni petrose e mastoidee dell'osso temporale variano ampiamente. Il mesotympanum definisce il più grande spazio pneumatizzato e comunica direttamente con le tube di Eustachio anteriormente. Questo spazio comunica con il tratto mastoideo aria cella centrale tramite l'antro aditus , che poi a sua volta può portare alle cellule perilabirintiche, retrofacciali, peri sinusali, apicali, epitimpanici e sinodurali Anche se ci sono molti naturale! ritardanti di tumore diffuso all'interno dell'osso temporale, alcuni specifici rapporti anatomici in questa regione possono contribuire alla estensione di malignità. I piani di sfaldatura naturali all'interno della cartilagine fibro-elastico della EAC, fessure di Santorini, possono consentire la consegna di tumore anteriormente alla parotide e posteriormente al laterale tessuto molle al processo mastoideo. Chiusura incompleta del forame di Huschke consente anche diffusione anteriore nella fossa parotide e glenoidea. Se tumore invade lo spazio dell'orecchio medio, e quindi il mesotympanum, esiste la possibilità di diffondere anteriormente attraverso le tube di Eustachio alla fossa infratemporale e lo spazio parafaringeo. Questa zona offre anche il libero accesso a tutte le zone della rocca petrosa attraverso il tratto centrale aria cella Anche se le partizioni ossee del temporale! ossea può ritardare la diffusione del tumore diretta, come l'erosione ossea si verifica nel corso del tempo, l'accesso è consentito anteriormente verso la fossa infratemporale, inferiormente verso la fossa giugulare, superiormente nel caveau di mezzo cranica, o posteriormente verso la fossa posteriore.8 Anche se ci sono riconosciuti vie di drenaggio linfatico dalla zona intorno temporale! osso, diffusione metastatica dalla zona non è common.36 Quando si verifica linfoadenopatia, è spesso associata ad un processo infiammatorio secondario piuttosto che con coinvolgimento tumorale diretta, ma metastasi sono stati riportati in 10 al 15% del cases78
La Pneumatizzazione delle porzioni petrose e mastoidee dell'osso temporale variano ampiamente. Il mesotympanum definisce il più grande spazio pneumatizzato e comunica direttamente con le tube di Eustachio anteriormente. Questo spazio comunica con il tratto mastoideo aria cella centrale tramite l'antro aditus , che poi a sua volta può portare alle cellule perilabirintiche, retrofacciali, peri sinusali, apicali, epitimpanici e sinodurali Anche se ci sono molti naturale! ritardanti di tumore diffuso all'interno dell'osso temporale, alcuni specifici rapporti anatomici in questa regione possono contribuire alla estensione di malignità. I piani di sfaldatura naturali all'interno della cartilagine fibro-elastico della EAC, fessure di Santorini, possono consentire la consegna di tumore anteriormente alla parotide e posteriormente al laterale tessuto molle al processo mastoideo. Chiusura incompleta del forame di Huschke consente anche diffusione anteriore nella fossa parotide e glenoidea. Se tumore invade lo spazio dell'orecchio medio, e quindi il mesotympanum, esiste la possibilità di diffondere anteriormente attraverso le tube di Eustachio alla fossa infratemporale e lo spazio parafaringeo. Questa zona offre anche il libero accesso a tutte le zone della rocca petrosa attraverso il tratto centrale aria cella Anche se le partizioni ossee del temporale! ossea può ritardare la diffusione del tumore diretta, come l'erosione ossea si verifica nel corso del tempo, l'accesso è consentito anteriormente verso la fossa infratemporale, inferiormente verso la fossa giugulare, superiormente nel caveau di mezzo cranica, o posteriormente verso la fossa posteriore.8 Anche se ci sono riconosciuti vie di drenaggio linfatico dalla zona intorno temporale! osso, diffusione metastatica dalla zona non è common.36 Quando si verifica linfoadenopatia, è spesso associata ad un processo infiammatorio secondario piuttosto che con coinvolgimento tumorale diretta, ma metastasi sono stati riportati in 10 al 15% del cases78
I linfonodi all'interno della parotide e regione preauricolare ricevono drenaggio dalla prua conchae !, canale cartilagineo, trago, e fossa triangularis. Linfonodi Infraauricular ricevono drenaggio dal lobo e antitrago retroauricolare, o linfatici juguiodigastric profonde, insieme a spina linfatici accessori ricevono drenaggio dall’ elice ed antelice. I linfatici dell’ EAC drenano anteriormente nei linfonodi preauricolari e parotidei, inferiormente nei nodi giugulari interne superiori cervicali e profonde, e posteriormente nel retroauricolare nodi L'orecchio medio ha una rete linfatica reticolare che circonda la tuba di Eustachio
Quali sono i tumori maligni dell'osso temporale ?
I Tumori maligni dell'osso temporale derivano più comunemente dal padiglione auricolare e conca laterale perché questi siti hanno probabilmente subito molti anni di esposizione al sole. In queste aree, il carcinoma basocellulare e carcinoma a cellule squamose sono più comuni. Il terzo cancro più comune dell’ osso temporale, che è molto raro, è il carcinoma adenoidocistico. Esso deriva dalle ghiandole che producono cerume. Se trascurata, questi tumori possono diffondersi nel.
· Canale uditivo
· Orecchio medio
· Mastoide o in profondità nell'osso temporale, che ospita il canale uditivo
· Nervo facciale
· Organi per l'udito e l'equilibrio
Il tipo più comune di cancro primario nel Canale uditivo(EAC) è il carcinoma a cellule squamose, carcinoma a cellule squamose e dell'osso temporale può provenire dal EAC o orecchio medio dove otorrea cronica e infiammazione, colesteatoma, o entrambi possono essere associati fattori di rischio. L’Adenocarcinoma, il Melanoma, Rabdomiosarcoma, Osteosarcoma, Linfoma, Carcinoma Adenoidocistico, ed Il Carcinoma A Cellule Acinic sono altri tipi di tumori maligni che possono sorgere nell'osso temporale. Nei bambini, il rabdomiosarcoma è il tumore maligno più comune dell'osso temporale. Circa il 10% di tutte le rabdomiosarcomi verificano nell'orecchio. Tumori, come meningioma, cordoma, malignità parotide, e carcinoma nasofaringeo, possono diffondersi alle ossa temporali da siti contigui. L'osso temporale può anche essere un luogo per le metastasi da linfoma o tumori maligni del seno, polmone, rene, o della prostata. Lesioni dell'osso temporale sono riassunti come segue:
· Benigne
o Osteoma
o Neurofibroma
o Paraganglioma
o Adenoma
o Schwannoma
o Cordoma
o Emangiopericitoma
o Lipoma
· Maligne
o Carcinoma a cellule squamose
o Carcinoma delle cellule basali
o Adenocarcinoma
o Carcinoma a cellule acinic
o Carcinoma adenoidocistico
o Melanoma
o Osteosarcoma
o Condrosarcoma
o Rabdomiosarcoma
o Carcinoma metastatico
o Linfoma
o Neuroma maligno
o Paraganglioma maligno
o CNS malignità

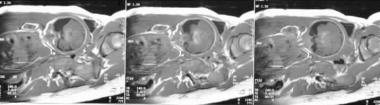
Figura 3: fotografia clinica di adenocarcinoma cistico di dell'osso temporale in una femmina di 27 anni, che mostra la messa in sinistra canale uditivo esterno -
NEOPLASIE MALIGNE DELL’OSSO TEMPORALE
Carcinoma a Cellule Squamose
IL Carcinoma a Cellule Squamose appare più frequentemente all'interno della porzione cartilaginea del EAC, presentando i pazienti sono in quinta-sesta decade e spesso hanno una storia di drenaggio cronico sonora, dolore e perdita di udito, diagnosi errata come otite media suppurativa o conti otite esterna per questi pazienti inizialmente in trattamento con cicli multipli di antibiotici topici e sistemici senza la risoluzione dei sintomi prima di biopsia in corso di esecuzione. Come si verifica l'estensione del tumore, otalgia cronici e danni ai nervi cranici (sordità neurosensoriale, debolezza facciale) diventano evidenti. Masticazione e deglutizione possono essere coinvolti con l'estensione del tumore nella fossa glenoidea e fossa infratemporale. Sebbene significativa crescita locale di questi tumori può essere evidente al momento della diagnosi, metastasi linfatica regionale è infrequente.
Sebbene non siano stati trovati fattori eziologici per spiegare carcinoma a cellule squamose della EAC, condizioni predisponenti che sono stati esaminati comprendono la radioterapia nella zona, l’otite media cronica, l’otite esterna cronica ,il colesteatoma, e le malattie linfoproliferative. Un gruppo selezionato di questi pazienti hanno una storia comune di esposizione a radio. IL Carcinoma a cellule squamose è il secondo tumore più comune del padiglione auricolare ed è spesso correlata all'esposizione al sole e traumi locali.
A un esame, questi tumori spesso appaiono granulari e sono molto friabili con bordi mal definiti, manipolazione può provocare emorragie, aumentando in tal modo sospetto e che porta a biopsia.

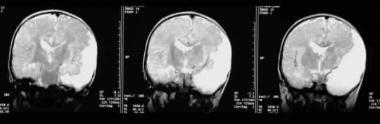
Figura 4 (A, B) invasione Significativa della fossa infratemporale si riflette con perdita dei piani dei tessuti molli con la risonanza magnetica (MRI) in entrambi i piani coronale e assiale.
Carcinoma A CELLULE Basali
 IL BCC si presenta spesso sul bordo dell’elice, e può essere trovato ovunque nella zona periauricolare. Questi tumori sono associati a un'eccessiva esposizione al sole e si trovano con elevata prevalenza di anziani maschi caucasici, questi tumori erodono pericondrio e periostio come ingrandire, e spesso istituito condizioni favorevoli a infezione secondaria presso il sito, i tumori a cellule basali spesso crescono più lentamente rispetto ai carcinomi a cellule squamose, ma sono ancora in grado di infiltrarsi profondamente tessuti circostanti, se lasciati progredire. Poiché queste lesioni, non provocano particolare dolore fino a che non si sono infiltrato profondamente, sono spesso trascurati e ne consegue una diagnosi tardiva.
IL BCC si presenta spesso sul bordo dell’elice, e può essere trovato ovunque nella zona periauricolare. Questi tumori sono associati a un'eccessiva esposizione al sole e si trovano con elevata prevalenza di anziani maschi caucasici, questi tumori erodono pericondrio e periostio come ingrandire, e spesso istituito condizioni favorevoli a infezione secondaria presso il sito, i tumori a cellule basali spesso crescono più lentamente rispetto ai carcinomi a cellule squamose, ma sono ancora in grado di infiltrarsi profondamente tessuti circostanti, se lasciati progredire. Poiché queste lesioni, non provocano particolare dolore fino a che non si sono infiltrato profondamente, sono spesso trascurati e ne consegue una diagnosi tardiva.
La variante più comune di BCC è il tipo nodulare; questa variante, insieme con le varianti superficiali e ulcerative, è meno aggressiva della morfeiforme e delle varianti basaloidi. A causa della loro posizione comune sul padiglione auricolare, questi tumori sono spesso rimossi con l'assistenza di chirurgia micrografica di Mohs 'nel tentativo di minimizzare la rimozione dei tessuti non colpiti. Questo metodo ha dimostrato di essere efficace finché vi è alcun coinvolgimento del EAC,
Tumore Ghiandolare Nonostante il fatto che la pelle del EAC contiene ceruminose, apocrine modificato, e ghiandole sebacee, tumori ghiandolari della EAC sono molto rare. Più frequentemente, regionale invasive tumori delle ghiandole salivari che si estendono dalla ghiandola parotide si incontrano. nella maggior parte dei tumori a basso grado di questa regione, tra cui il carcinoma adenoidcystic nonostante la sua propensione per l'invasione neurale, la chirurgia con la conservazione del nervo facciale è diventato la colonna portante. I tumori, come l'adenocarcinoma di alta qualità, di alta qualità mucoepidermoide, e il carcinoma a cellule acinic continuano ad essere trattate in modo aggressivo con nervo sacrificio quando coinvolti.
Primaria adenocarcinoma basso grado del sacco endolinfatico, o aggressivo cistoadenoma papillare, si trovano ad invadere l'osso temporale. Si tratta di tumori molto rari, ma sono stati diagnosticati in relazione clinica con von Hippel-Lindau (VHL) malattia. Alcune mutazioni nel gene VHL iocus hanno dimostrato di correlare con la perdita di un gene soppressore del tumore, sia in VHL familiare e sporadica. lt Si ritiene che ulteriori ricerche genetica può essere in grado di prevedere unicamente con test genetici che pazienti con VHL svilupperanno tumori del sacco endolinfatico.
a) Il papilloma dei plessi coroidei
Sono rare neoformazioni (circa lo 0,5-0,6%) che compaiono nell’età giovanile senza predilezione di sesso. In alcuni casi la neoplasia, pur presentando i caratteri papilliferi, può assumere l’aspetto istologico di una neoplasia maligna.
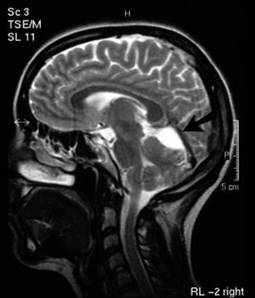
Per l’interessamento del n. VIII compaiono sintomi audio-vestibolari. Alla TAC, la lesione appare come una massa a componente cistica con calcificazioni e talvolta con erosione dell’osso petroso e del canale uditivo interno.

b) Il carcinoma adenoido-cistico
Nel Cap. Il (pag. 169) trattando dei tumori maligni della rocca petrosa, si è accennato alla possibilità che la neoplasia oltre a detenninare otalgia, otorrea, edema mastoideo con ipoacusia, acufeni, vertigini e paralisi del VII determini anche deficit di altri nervi cranici. Infatti, se il tumore si diffonde all’apice della rocca e interessa le strutture nervose adiacenti, può realizzare un quadro otoneurologico sovrapponibile a quello di una lesione dell’angolo ponto-cerebellare o dei distretti anatomici limitrofi.

C)Rabdomiosarcoma
Il Rabdomiosarcoma è il sarcoma dei tessuti molli più comuni dell'infanzia. La variante embrionale è la più suscettibile di incidere sul testa e del collo, e 4-7% di queste lesioni coinvolgere l'osso temporale. Purtroppo, il 20% dei bambini con diagnosi di questa lesione ha diffusione metastatica al momento della presentazione. Questi chiidren presentano spesso con scarico fonetica e con polipi friabili all'interno dell'orecchio. Otalgia e facciale debolezza nervo può anche essere presenti. La malattia presenta all'interno dell'osso temporale presagire cattiva prognosi, in quanto i pazienti hanno spesso incurabile malattia locale.
Trattamento multimodale per rabdomiosarcoma è migliorata in modo significativo risultato. Multidrug chemioterapia con radiazioni o interventi chirurgici è venuto per essere il cardine del trattamento. Opzioni chirurgiche sono spesso utilizzati per la biopsia e debulking della malattia, come l'asportazione chirurgica completa in questo settore è estremamente difficile, deformante, e inutile alla luce delle recenti opzioni di chemioterapici.

13.c) Il condrosarcoma
è un tumore maligno che deriva dal tessuto cartilagineo di cui mantiene, sebbene in forma atipica, le caratteristiche dell’istotipo. Secondo il grado di differenziazione e di atipia, si distinguono tre gradi istologici. Nella Fig. 19, è illustrato un caso di condrosarcoma con una malignità di Il grado localizzato nella fossa cranica posteriore di sinistra con deficit del VI-IX-X-XI-XII.
Tra i tumori maligni dell’orecchio i più frequenti sono il carcinoma squamoso e l’adenocarcinoma ). Raro è il carcinoma adenoido-cistico ed eccezionali risultano i sarcomi: rabdomiosarcoma e fibrosarcoma che compaiono soprattutto nei soggetti di giovane età e presentano un’evoluzione più rapida dei carcinomi e una maggior tendenza a diffondersi. I carcinomi possono localizzarsi a livello dell’osso temporale e della rocca petrosa come avviene per le metastasi di carcinomi del seno, rene, polmone, stomaco, laringe, prostata e della tiroide. Inoltre, l’osso temporale può venire interessato per continuità da neoplasie localizzate in sedi anatomiche limitrofe come la ghiandola parotide e il rinofaringe Un valido aiuto per la diagnosi verrà soprattutto dall’esame radiologico della rocca mediante la TAC o la RNM con mdc. La conferma la darà però l’esame bioptico che permetterà di riconoscere l’istotipo della neoplasia differenziandolo da quello di alcune forme benigne a carattere espansivo della rocca (l’emangioma cavernoso, il neurinoma, il neurofibroma) o di altre lesioni linfoproliferative del labirinto (Hodgking e non Hodgking) la cui incidenza varia tra il 15 e il 30% o del granuloma eosinofilo della rocca..
13.d)Tumore metastatico
Una varietà di tumori metastatici sono stati diagnosticati all'interno dell'osso temporale. Lesioni ematopoietiche compresi linfomi e leucemia possono invadere l'osso temporale. Plasmocitoma si possono trovare anche in questa regione. Le lesioni possono manifestarsi come granulare, di massa friabile nell'orecchio medio o mastoide,

metastasi dell’ Osso temporale da adenocarcinoma prostatico
Tumori intracranici benigni o maligni molto aggressivi possono occasionalmente invadere l'osso temporale, tra cui semina da carcinomatosi meningea in rari casi, il cervello primario
maligno
a cellule squamose
benigno
meningioma,
basso grado
schwannoma Paraganglioma
osteoma
adenoma
cordoma
lipoma
aggressivo benigna
condroblastoma
plasmocitoma
emangiopericitoma
emangioendotelioma
meningioma,
tumori con invasione nell'osso temporale possono includere medulloblastoma, neuroblastoma, meningioma maligno, e tumori del plesso coroide. Diffusione ematogena probabilmente dal seno, rene, della tiroide, del polmone, del fegato, e del sistema gastrointestinale è stato anche documentato.
Eziologia
I tumori che possono invadere l'osso temporale hanno tre possibili origini: dalla pelle dell'orecchio esterno, dalla ghiandola parotide, e dal canale uditivo. Quelli che sorgono dalla pelle dell’orecchio esterno e dalla ghiandola parotide sono i più comuni, mentre quelli derivanti nel canale uditivo sono rari. Tumori della pelle si presentano come una massa od un’ulcera nel padiglione auricolare, mentre i tumori della parotide si presente come una messa nella ghiandola (parotide). I tumori del canale uditivo possono presentarsi con segni che imitano una otite media cronica, come la perdita dell'udito, pus, o una massa nel canale. Altri sintomi che possono segnalare la presenza di un tumore che invade l'osso temporale sono il sanguinamento dall'orecchio e paralisi facciale o debolezza.
Poiché il cancro osso temporale è così raro, che determinare i fattori eziologici specifici per i tumori in questo settore è molto difficile. Tuttavia, i bianchi di carnagione chiara sono più inclini a tumori della pelle di tipo non melanomatoso , in particolare una causa comune significativa è l'esposizione al sole (a radiazioni ultraviolette) per le aree esposte dell'orecchio esterno. Una predisposizione genetica al cancro della pelle può anche esistere, che si manifesta come lo sviluppo di tumori della pelle in siti non esposti alla luce del sole così come le zone esposte al sole. L’Otite media cronica e colesteatoma sono comuni nei pazienti con tumori dell'osso temporale e sono stati implicati come fattori eziologici[ Moffat et al., 2005; Keereweer et al.,2011]. [1, 2] otite media cronica suppurativa e la conseguente infiammazione cronica può portare a metaplasia squamosa. Alcuni tumori, come i tumori glomici, potrebbero verificarsi per anomalie genetiche e può presentarsi in famiglie Il Papilloma virus umano è stato implicato in carcinomi a cellule squamose dell'orecchio medio[Jin et al., 1997]. [3] Lim ed altri (2000) riportarono una serie di tumori dell'osso temporale in 7 pazienti sottoposti a radioterapia per carcinoma rinofaringeo[ Lim et al.,][4] Questi pazienti avevano una particolarmente povero esito.
Fisiopatologia
La complessa anatomia dell'osso temporale rende difficile da prevedere la diffusione del tumore. I tumori della pelle attorno al padiglione auricolare possono estendersi lungo i tessuti molli del collo e dell'orecchio. I tessuti molli sono un barriera poco efficiente contro la diffusione del tumore, e alla fine i tumori possono estendersi lungo il padiglione auricolare la conca e nel Condotto Uditivo Esterno (EAC). La cartilagine del EAC fornisce una resistenza minima alla diffusione del tumore. Le fessure di Santorini, il forame di Huschke, e gli svincoli ossee-cartilaginei sono una fonte di accesso diretto ai tessuti peri parotidei e dell'articolazione temporo-mandibolare.
Cancer nel meato uditivo esterno può invadere posteriormente attraverso il tessuto molle nel solco retroauricolare sulla corteccia mastoide. Il canale osseo è più resistente alla estensione del cancro; tuttavia, l'erosione attraverso il canale osseo posteriore fornisce l'accesso alla cavità mastoidea. La crescita del tumore medialmente lungo la EAC può estendere attraverso la membrana timpanica e l'anello timpanica osseo, permettendo l'invasione nell'orecchio medio. Una volta che un tumore entra l'orecchio medio, l'osso duro della capsula otica fornisce una barriera più efficace contro la diffusione del tumore.
Nell'orecchio medio o mastoide, i tumori si diffondono facilmente attraverso la tuba di Eustachio, la finestra ovale e rotonda, la strutture neurovascolari, e gli ampi spazi aerei della cavità mastoide. Le strutture della tromba i e neurovascolari di Eustachio dell'orecchio medio sono mezzi potenziali di diffusione del tumore oltre l'osso temporale alla fossa infratemporale, rinofaringe, o al collo.
Tumori aggressivi possono erodere attraverso il timpano tegmen o mastoide nella fossa centrale o posteriore. Il seno sigmoideo potrebbe essere coinvolto. La dura, anche se un po resistenti all'invasione, presagire una prognosi grave se coinvolti. Il nervo facciale e forame stylomastoid sono itinerari metastatiche ai tessuti molli del collo e della parotide. Estensione prossimale lungo il nervo facciale conduce verso l'orecchio e fossa posteriore interno. Leonetti et al (1996) offrono una eccellente rassegna dei modelli di invasione del tumore dell'osso temporale[Leonetti et al.,1996].[5]
La Metastasi linfonodali è rara nella malattia precoce, ma può verificarsi nel 10-20% dei casi di malattia avanzata. [6, 1] Il drenaggio linfatico del padiglione auricolare e EAC si estende anteriormente ai linfonodi periparotidei e alla ghiandola parotide. [7]Drenaggio può anche verificarsi alla catena giugulare od ai nodi sovrastanti mastoide. Linfodrenaggio del mediale EAC e mezzo orecchio è ai nodi retrofaringei o nodi giugulari profonde. Il drenaggio linfatico dell'orecchio interno è sconosciuto.
Metastasi a distanza è rara.
Presentazione
I pazienti con tumore dell'osso temporale sono presenti più spesso all’età di 60 anni o più, anche se ogni gruppo di età, compresi i bambini, possono essere colpiti. "Ogni tumore che invade l'osso temporale può produrre secrezione purulenta, perdita dell'udito, o influenzare il nervo facciale", Paul W. Gidley. Il paziente lamenta spesso otalgia ingravescente, ribelle a qualsiasi trattamento analgesico, talvolta otorrea purulenta con tracce ematiche, acufeni, vertigini, ipoacusia, paralisi del faciale. Sintomi più allarmanti per malignità sono neuropatie craniali, tra cui paralisi facciale e deficit cocleovestibolari. Segni di coinvolgimento meningea, tra cui mal di testa, possono essere scoperte in ritardo. Tabella 26-1 elenca i segni ei sintomi presenti nel Registro Università di Cincinnati tumore registrata per i pazienti con tumori ossei maligni temporale 1984-2005. Se il carcinoma infiltra le strutture ossee della mastoide può estrinsecarsi in sede retroauricolare oppure se si diffonde all’interno della capsula labirintica e raggiunge l’apice della rocca, può interessare il VI e il V e provocare la comparsa di diplopia, algie facciali e parestesie. L’infiltrazione neoplastica può diffondersi anche verso la fossa cranica posteriore e determinare in tal caso la paralisi di altri nervi (IX, X, XI, XII) oppure una grave emorragia se verrà interessata la parete della vena giugulare. Altre complicanze sono la meningite, l’encefalite e l’ascesso cerebrale. Reperti fisici includono otorrea, una lesione di massa, gonfiore del viso, paresi facciale, e altri deficit dei nervi cranici (CN). Spesso i tumori maligni sono mal diagnosticati come una infezione e trattati con  gocce antibiotiche. Se un paziente non risponde al trattamento e ha una massa nel condotto uditivo, una biopsia dovrebbe essere ottenuto per la diagnosi, ( Barry Hirsch),I pazienti spesso si presentano dopo molti anni di sintomi. In una serie di istituto degli autori, il tempo medio dalla comparsa dei sintomi al momento del trattamento primario per il cancro è stato di 3,9 anni[Moody et al 2000]. [6] malattia nodale è presente nel 10-20% dei pazienti[Moody et al 2000;Moffat et al., 2005.].[6,1] Dal lato otoneurologico, la sintomatologia è caratterizzata dal deficit dell’udito e dai segni di sofferenza dell’apparato vestibolare. Inizialmente, l’ipoacusia è spesso di tipo misto ma diviene ben presto di tipo percettivo col diffondersi della neoplasia. Allo stesso modo, anche l’asimmetria vestibolare da “irritativa” diventa in breve tempo di tipo deficitario.
gocce antibiotiche. Se un paziente non risponde al trattamento e ha una massa nel condotto uditivo, una biopsia dovrebbe essere ottenuto per la diagnosi, ( Barry Hirsch),I pazienti spesso si presentano dopo molti anni di sintomi. In una serie di istituto degli autori, il tempo medio dalla comparsa dei sintomi al momento del trattamento primario per il cancro è stato di 3,9 anni[Moody et al 2000]. [6] malattia nodale è presente nel 10-20% dei pazienti[Moody et al 2000;Moffat et al., 2005.].[6,1] Dal lato otoneurologico, la sintomatologia è caratterizzata dal deficit dell’udito e dai segni di sofferenza dell’apparato vestibolare. Inizialmente, l’ipoacusia è spesso di tipo misto ma diviene ben presto di tipo percettivo col diffondersi della neoplasia. Allo stesso modo, anche l’asimmetria vestibolare da “irritativa” diventa in breve tempo di tipo deficitario.
Figura. Tipo I: la resezione Laterale dell'osso temporale
“La diagnosi può presentare, all’esordio della malattia, qualche difficoltà. Infatti, non di rado l’obiettività otoscopica risulta negativa e i sintomi riferiti dal malato orientano verso una forma flogistica subacuta. Il sospetto di una forma espansiva della rocca sorge allorché compare qualche episodio vertiginoso con perdita di equilibrio e l’ipoacusia progressivamente peggiora, l’otalgia si fa più intensa, gli acufeni diventano continui e si osserva un parcellare deficit del VII. Dovrà però trascorrere ancora qualche tempo prima che si possa notare la comparsa tra l’essudato di minute vegetazione facilmente sanguinanti che affiorano dai bordi erosi di una fistola ossea epitimpanica o dalla perforazione dell’MT. Un valido aiuto per la diagnosi verrà soprattutto dall’esame radiologico della rocca mediante la TAC o la RNM con mdc. La conferma la darà però l’esame bioptico che permetterà di riconoscere l’istotipo della neoplasia differenziandolo da quello di alcune forme benigne a carattere espansivo della rocca (l’emangioma cavernoso, il neurinoma, il neurofibroma) o di altre lesioni linfoproliferative del labirinto (Hodgking e non Hodgking) la cui incidenza varia tra il 15 e il 30% o del granuloma eosinofilo della rocca deficitario” o è tale fin dall’inizio
Sintomi e segni di lesioni ossee temporali sono riassunti come segue:
· Otalgia (80-85%)
· Otorrea (40-75%)
· Paralisi facciale (25%)
· La perdita dell'udito (45-80%)
· Tinnitus (8-10%)
· Vertigine
· Lesione auricolare
· Massa canale esterno (10%)
· Massa parotide (19%)
· Le lesioni cutanee
· CN V, IX, io, deficit XI (30%)
Una storia completa e un esame neurotologic è essenziale nella valutazione di un tumore dell'osso temporale. Gli esami Audiometrici, elettrofisiologici, e gli studi neuroradiologici possono anche contribuire a definire l'entità della crescita del tumore e il coinvolgimento delle strutture circostanti. Studi di riferimento in grado di elaborare l'eziologia della perdita di udito: l’Audiometria, compresi i punteggi di discriminazione vocale ed i riflessi acustici, insieme alle risposta evocate uditive del tronco encefalico (ABR) possono essere utilizzati per valutare la patologia retrococleare. La Valutazione impedenzometrica e timpanometrica possono aiutare a definire il coinvolgimento dell'orecchio medio. L’Elettronistagmografia, analisi con la sedia rotatoria, l’impulse test , e la piattaforma posturografia hanno un valore limitato, ma sarà anormale se l'integrità dell'apparato vestibolare è stata compromessa. L'esame obiettivo deve comprendere l'ispezione del padiglione auricolare, dell’ EAC, e dell'orecchio medio per le ulcere, lesioni di massa, gonfiore dei tessuti molli o indurimento, vecchie cicatrici (ad esempio, i tumori della pelle precedentemente asportati potrebbero essere stati dimenticati dal paziente), e otorrea. Eseguire un esame approfondito del SNC. E’ fondamentale l'ispezione del facciale. . Come sempre, eseguire un esame testa e del collo completo. Condizione medica generale del paziente deve essere valutata anche perché può essere di grande impatto le opzioni di trattamento e l'esito.
Indicazioni
In generale, tutti i pazienti che sono in grado di vista medico dovrebbero essere sottoposti a trattamento chirurgico. Radiazione primaria è inefficace per il trattamento curativo; tuttavia, nei casi più estremi in cui controindicazioni alla chirurgia sono gravi deterrenti alla chirurgia, la radioterapia e la chemioterapia palliativa possono essere offerti.
Anatomia rilevante
L'osso temporale è una struttura complessa costituita da 3 parti: il squamose, timpanica, e porzioni petrosa. La porzione squamoso dell'osso temporale forma una piccola porzione del ossea EAC processo zigomatico (e fossa mandibolare), ed una porzione del processo mastoide. Esso ha una porzione superiore che protegge il lobo temporale e si articola con il parietale e occipitale. La porzione timpanica costituisce la maggior parte del canale osseo e la parete posteriore della fossa mandibolare. L'orecchio medio è uno spazio tra le porzioni squamose e temporali lateralmente e la parte petrosa mediale. La porzione petrosa dell'osso temporale contiene la capsula otica e del condotto uditivo interno.
L'EAC estende dalla conca alla membrana timpanica. La porzione cartilaginea laterale incontra la porzione ossea ad una giunzione osseo-cartilagineo situata a circa un terzo della sua lunghezza totale dalla parte laterale. La parete anteriore cartilagineo contiene piccole difetti della cartilagine riempiti di tessuto connettivo dette fessure di Santorini, che sono collegamenti diretti di tumore diffuse nei tessuti periparotid. Nell'ambito della componente ossea è un altro potenziale via di estensione del tumore al forame di Huschke, un difetto del ring timpanica situato inferiormente. La parete anteriore del canale è strettamente associata con l'articolazione temporo-mandibolare, e la parete anteriore-inferiore si trova vicino alla ghiandola parotide.
L'osso temporale contiene o confina con molte strutture vitali, tra cui l'arteria carotide interna, bulbo giugulare, seno cavernoso, e sigma seno. Un sottile strato di tessuto osseo separa le medie orecchie e mastoide cavità dalla metà e posteriore fossae dura. Altre importanti strutture che si trovano all'interno dell'osso temporale includono gli ossicini, la coclea, e le tube di Eustachio e cocleare, vestibolare, facciale, trigemino, caroticotympanic, corda del timpano, e nervi petroso.
Controindicazioni
In generale, non esistono controindicazioni specifiche per tumori dell'osso temporale; tutti i pazienti che sono in grado di vista medico dovrebbero essere sottoposti a trattamento chirurgico. Tuttavia, i tumori avanzati con invasione intracranica hanno una prognosi grave, e il trattamento dovrebbero probabilmente essere limitati a palliazione con meno estese (e meno morboso) le procedure chirurgiche.
Studi di laboratorio
Vedere la lista qui sotto:
· Test di routine preoperatoria comprende conta CBC, test di livello di elettroliti, test di funzionalità renale, test di funzionalità epatica, e gli studi di coagulazione (se giustificato sulla base della storia di sanguinamento e farmaci attuali del paziente).
Studi di imaging
Tecniche di imaging come la tomografia computerizzata (TAC) e la risonanza magnetica (RM) sono diventati standard di riferimento per la valutazione dell'osso temporale di 9/11, studi adiuvanti come l'angiografia, la risonanza magnetica angiografica (MRA), e la flebografia a risonanza magnetica (MRV) può aiutare anche in valuazione.12
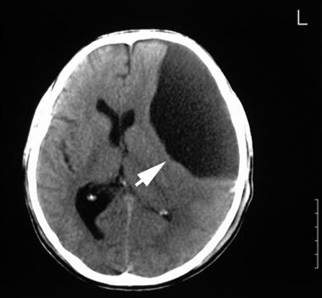
La TAC eseguita a intervalli di 1 mm nella modalità per finestra ossea ad alta densità fornisce informazioni significative sullo stato dell'osso e base cranica dell’osso temporale, ed eventuali erosioni.
La rottura dell’ EAC, tegmen, o forame giugulare / regione canale carotideo può suggerire la presenza di un processo maligno. Gli ossicini, il semicanale del muscolo tensore del timpano e le tube di Eustachio sono ben definite con la TAC, e il coinvolgimento extratemporale, tra cui parotide, fossa infratemporale, e l'estensione intracranica, può essere facilmente apprezzata 11/13 (Fig. 26-1).
Vedere la lista qui sotto:
· TAC dell'osso temporale e collo: Un esame fisico da solo non può adeguatamente valutare il grado di estensione del tumore al di là del padiglione auricolare. Informazioni radiografiche specifiche è cruciale per la accurata stadiazione preoperatoria. Ottenere un fine-cut (1 mm) TC ad alta risoluzione di scansione dell'osso temporale. Il radiologo dovrebbe valutare lo studio specifico per l'erosione EAC, coinvolgimento dell'orecchio medio, dell'orecchio capsula erosione, coinvolgimento mastoide, giugulare fossa erosione, carotide canale erosione, tegmen erosione, e il coinvolgimento della fossa posteriore. Il nervo facciale, forame stylomastoid, articolazione temporo-mandibolare, ghiandola parotide, e fossa infratemporale dovrebbero anche essere esaminate attentamente.
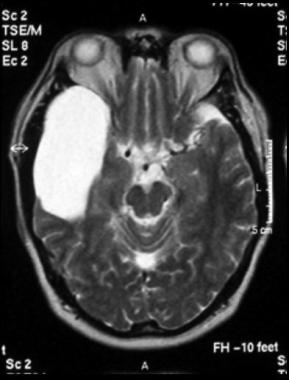
· La risonanza magnetica: TC può essere inaffidabile differenziare mucosa fluido e infiammato da un tumore nell'orecchio medio e mastoide, specie quando nessun erosione ossea è presente per sollevare il sospetto per la presenza di un tumore. Inoltre, si sviluppa lungo i piani fasciali e strutture neurovascolari può essere molto difficile da rilevare. In queste situazioni, la risonanza magnetica con gadolinio può essere utile perché meglio delinea le interfacce dei tessuti molli.
· Radiografia del torace: Se l'istologia indica carcinoma a cellule squamose, ottenere radiografie o TAC del torace per escludere metastasi.
· TC del torace, dell'addome o del bacino: la TAC del torace, addome, o del bacino non è necessaria a meno che il campione bioptico del tumore dell'osso temporale rivela un tumore con una propensione noto per metastasi. Questo tipo di tumore comprende il melanoma, adenocarcinoma, il linfoma e il carcinoma a cellule renali.
· Angiografia carotidea con palloncino di occlusione prova Xenon: Se la carotide è sospettato di essere coinvolto, l'angiografia con omolaterale palloncino di occlusione test Xenon viene eseguita per dimostrare l'adeguatezza del flusso ematico cerebrale dalla carotide controlaterale. Particolare attenzione è data anche alla fase di deflusso venoso per determinare l'adeguatezza del / sistema giugulare sigma controlaterale nel caso in cui la chirurgia richiede sacrificio del seno sigmoideo o vena giugulare interna.
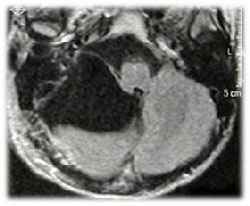
Sebbene la RM non definisce l'erosione ossea cosi ’bene, come fa la TAV, fornisce informazioni sul coinvolgimento dei tessuti molli all'interno dell'orecchio medio o altrI spazi.1112 pneumatized MRI può anche mostrare la valorizzazione dei forami, chiarire la diffusione di tumore lungo questi percorsi come web! diffusione come extratemporale alle strutture circostanti. Dura! violazione come web! il coinvolgimento vascolare può essere facilmente definito alla risonanza magnetica. MRA e MRV mostrano anche tumore vascolarizzazione, e possono assistere in ulteriore caratterizzazione del tumore, come web! come la pervietà del sistema vascolare circostante a causa di analisi dei vuoti di flusso (Fig. 26-2b).

Gli esami vascolari invasivi vengono eseguiti meno frequentemente per semplice caratterizzazione dei tumori in quanto il crescente utilizzo di MRA e MRV. Questi studi possono ancora contribuire a definire le arborizzazioni vascolari del paziente e quindi la capacità di tollerare compromessi arteria interna per mezzo di studi xeno-131 assistite o palloncino di occlusione, .Il sacrificio dell’arteria carotide può essere indicata sulla base del coinvolgimento del tumore primario o dalla necessità per il controllo vascolare se vengono rilevate pesanti sanguinamenti intraoperatorio. L'embolizzazione, anche se usato raramente, forse utile in ambito perioperatorio per ridurre il sanguinamento da tumori altamente vascolari.
Anche se gli studi di radionuclidi sono meno utili nella valutazione iniziale delle neoplasie maligne per la infiammazione presente nella zona, possono essere utilizzati per distinguere tra recidiva e aree di osteoradionecrosi o infezione,
Criteri di gestione temporanea di malignità ossa temporale sono state pubblicate, ma fino ad ora non esiste un sistema universalmente accettato. Sebbene la Joint Committee on Cancer utilizza lo stesso sistema di stadiazione che è stato applicato a tumori cutanei in altri siti, l'anatomia unico dell'osso temporale rende questi criteri inadeguata. Sistemi di stadiazione suggeriti sono concentrati sulla dimensione del tumore e l'aspetto clinico, il web! come CT comparsa di tumori, 121415 tabelle 26-2 e 26-3 elenco dei sistemi di stadiazione proposti da Arriaga et una! e Pensak et al.,. Recentemente, Nakagawa et altri 16 hanno modificato il sistema di stadiazione Pittsburgh a includere i tumori con il coinvolgimento fossa infratemporale nella categoria T3. È interessante notare che la ricerca da questo gruppo ha mostrato che questi tumori beneficiano di un aumento della sopravvivenza! dopo l'intervento chirurgico radicale e radioterapia preoperatoria che non era stata precedentemente dimostrata.
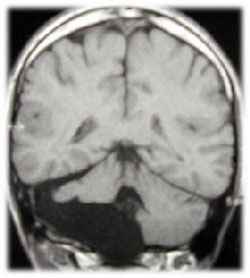
Figura 26-1 Ampia erosione ossea è notato in questa alta risoluzione assiale tomografia computerizzata (CT) dell'osso temporale
Altri test
Vedere la lista qui sotto:
· Audiometria: Un audiogramma si ottiene prima di eseguire qualsiasi procedura importante sulla orecchio o osso temporale. Audiogrammi forniscono soglie uditive di base per futuri confronti.
· Elettrocardiografia
Procedure diagnostiche
Vedere la lista qui sotto:
· Biopsia: Ottenere una biopsia per determinare se la lesione nell'orecchio è benigno o maligno. Una biopsia può essere eseguita se la maggior parte della massa è sottocutanea o nel parenchima della ghiandola parotide. Una messa in scena mastoidectomia non è appropriato.
I risultati istologici
Anche se TC fornisce importanti informazioni stadiazione preoperatoria, la valutazione sistematica patologica del campione è fondamentale per la stadiazione e trattamento. Ad esempio, se le prove patologica di invasione ossea o diffusione dei tessuti molli si trova, ma non era stato previsto dai risultati di studi di imaging preoperatori, la fase può essere regolata e la terapia adiuvante in considerazione.
Il chirurgo deve personalmente orientare il tessuto chirurgica per la squadra patologia. Il patologo dovrebbe quindi esaminare più sezioni di elementi chiave (ad esempio, ossuto EAC, canale facciale, capsula otica, anello timpanica, giunzione osseo-cartilagineo). I margini dei tessuti molli ai forame stylomastoid, fossa infratemporale, e nervo facciale (se asportato) devono essere dettagliate. Inoltre, i campioni della mucosa dell'orecchio medio e della mastoide essere specificamente esaminati.
Stadiazione del Tumore
I Sistemi di Stadiazione hanno lo scopo di aiutare a classificare i pazienti prima dell'intervento in gruppi per cui le decisioni riguardanti il trattamento possono essere effettuate sulla base di confronto a pazienti precedentemente trattati con caratteristiche tumorali simili (ad esempio, il palco). Ad oggi, nessun sistema di stadiazione per tumori dell'osso temporale è universalmente accettata. Diversi fattori ostacolano il processo di sviluppo di un sistema di stadiazione, compresa la rarità dei tumori, l'impossibilità di valutare estensione della malattia mediante esame fisico da solo, e l'inaffidabilità di studi radiografici per determinare l'estensione della malattia in certe situazioni.
Molti autori hanno proposto sistemi di stadiazione in concomitanza con una revisione delle serie di pazienti dalle principali istituzioni; tuttavia, il piccolo numero di pazienti per gruppo, la disparità di criteri di stadiazione, la diversità di protocolli di gestione, e l'uso di non standardizzato nomenclatura chirurgico vieta raffronto significativo dei risultati. Inoltre, alcuni pazienti sono riferito classificati in gruppi con la variabilità nei tipi istologici e siti di origine del tumore, che confonde ulteriormente l'analisi dei risultati da palco.
Numerosi sistemi di stadiazione sono stati proposti; sistema di stadiazione tuttavia, ad oggi, non universalmente accettata per i tumori dell'osso temporale esiste. Un sistema di stadiazione per i tumori a cellule squamose della EAC proposti dall'Università di Pittsburgh è stato dimostrato utile e ha ottenuto il sostegno in letteratura. [8, 9, 10, 5, 1, 11] Questo sistema di stadiazione si basa sulla clinica, radiologica e patologici. In generale, i tumori che sono limitati alle EAC sono definiti come malattia precoce, e quelli che si estendono al di là del canale esterno di invadere i tessuti molli circostanti, dell'orecchio medio, mastoide, o CN sono riconosciute come malattia avanzata.
Nel sistema originale allestimento proposto da Pittsburgh, lesioni sono state definite come segue[ Arriaga et al.,1990]: [8] modificata nel 2000 Moody ET AL., che richiede una diagnostica per immagini di buona qualità. Inizialmente proposta per i CE, essa è stata allargata agli altri carcinomi del MUE:
· T1 - Il tumore limitato alla EAC, senza erosione ossea o prove del coinvolgimento dei tessuti molli
· T2 - Il tumore con limitata erosione ossea EAC (spessore non pieno) con limitati (0,5 centimetri <) coinvolgimento dei tessuti molli
· T3 - Tumore erodendo la ossea EAC (a tutto spessore) con limitati (<0,5 cm) dei tessuti molli o tumore che coinvolgono l'orecchio medio, mastoide, o entrambi
· T4 - tumore erodendo la coclea, apice petroso, parete mediale dell'orecchio medio, carotideo canale, o forame giugulare di dura; o con un ampio coinvolgimento dei tessuti molli (> 0.5 cm), come il coinvolgimento del forame comuni o temporo stilomastoideo; o con evidenza di paresi facciale
○ T4a: lesione dei tessuti laterali cutanei (conca, cute retroauricolare), della parotide, dell'articolazione temporomandibolare o della fossa infratemporale
○ T4b: lesione dell'orecchio interno e dell'apice petroso
○ T4c: lesione durale.
· N lo stato coinvolgimento dei linfonodi è un accertamento prognostico povero e inserisce automaticamente il paziente in fase avanzata [o stadio III (T1N1) o stadio IV (T2-T4N1)]
· Stato M metastasi a distanza indica una prognosi sfavorevole e colloca paziente subito inuno stadio IV
Il sistema di stadiazione di Pittsburgh è diventato ampiamente applicata in segnalazioni di casi di tumore dell'osso temporale [;Moffat et al., 2005.;Gaudet et al.,2010 ]. [1, 12]
Il sistema di stadiazione di Pittsburgh è stato modificato dagli autori dopo un ulteriore riesame dei pazienti da una lunga serie[[Moody et al 2000 6]. [6] Nel sistema di stadiazione modificato, facciale debolezza del nervo è considerato un criterio per una lesione T4. Gli autori hanno osservato che viso paresi del nervo non si è verificato nelle lesioni diversamente classificate come T1 limitato, T2, T3 o lesioni. Il coinvolgimento del nervo facciale sarebbe altrimenti classificato come T4 in base all'area anatomica di coinvolgimento, compresa la parete mediale dell'orecchio medio (segmento orizzontale), ampia erosione ossea all'interno mastoide (segmento verticale), o il coinvolgimento di forame stylomastoid. Nel gruppo T4, la sopravvivenza è risultata simile tra i pazienti con e senza paralisi facciale (inedito).Alcuni rapporti hanno utilizzato il sistema di stadiazione modificato[13.Nyrop M, Grontved A.,2002] [13]
Coinvolgimento linfonodale e stadio possono essere classificati come lo è per gli altri tumori della testa e del collo.
· N1 - linfonodo omolaterale singolo, dimensione inferiore a 3 cm
· N2 - nodo omolaterale singolo, misura 3-6 cm
· N2b - Più nodi omolaterali, tutti a meno di 6 cm
· N2C - nodi bilaterali o controlaterali, tutti a meno di 6 cm
· N3 - I nodi coinvolti maggiore di 6 cm
Il cancro è in scena come segue:
· Fase 0 - Tis N0 M0
· Fase I - T1 N0 M0
· Fase II - T2 N0 M0
· Fase III - T3 N0 M0, T1 N1 M0, T2 N1 M0, T3 N1 M0
· Fase IV - T4 N0 M0, T4 N1 M0, qualsiasi T N2 M0, qualsiasi T N3 M0, qualsiasi T qualsiasi N M1
|
Figura 5. Tipo I: resezione Laterale dell'osso temporale
|
|
|
Figura 6. Tipo II: resezione Laterale dell'osso temporale
|
|
|
Figura 7. Tipo III: resezione laterale dell'osso temporale
|
|
|
Figura 8. Tipo IV: resezione Lateral dell'osso temporale
|
Terapia Medica
Radiazione primaria è inefficace per il trattamento curativo. Nei casi più estremi in cui controindicazioni alla chirurgia sono gravi deterrenti alla chirurgia, la radioterapia e la chemioterapia palliativa possono essere offerti. La letteratura supporta un effetto benefico delle radiazioni aggiuntiva sulla sopravvivenza, ma sono stati effettuati studi ben controllati. Radioterapia postoperatoria può essere indicato nella malattia avanzata. La maggior parte degli autori sostengono radiazione pieno decorso post-operatorio di mettere in scena i tumori T3 o T4, come definite dal sistema di stadiazione Università di Pittsburgh. Alcuni autori raccomandano anche le radiazioni per la malattia T2 [Kunst et al.,2008]. [14]
La letteratura supporta un effetto benefico di radiazioni sulla sopravvivenza postoperatoria [Moody et al 2000 ;Moffat et al., 2005.]. [1, 6] L'osso temporale e collo devono essere trattati con 50-60 Gy per i tumori scena T3 e T4. Radioterapia può anche essere indicato per lesioni più piccole.
Chemioterapia preoperatoria è stata valutata da Nakagawa et al in una serie retrospettiva di pazienti trattati con chemio radioterapia preoperatoria o con la sola chemio radioterapia [Nakagawa et al.,2006]. [15] Quattro delle 8 pazienti trattati con chemioradioterapia (5-Flourouracil o un complesso fluoro pirimidina durante radioterapia esterna con una dose di 40Gy), seguita da chemioterapia, in un caso, erano liberi di malattia a 24-47 mesi. Pemberton et al hanno riportato la sopravvivenza del 53% cancro-specifica di 123 pazienti trattati con la sola radioterapia (55 Gy) [Pemberton et al.,2006] . [16]
Sulla base di una revisione di studio e la letteratura retrospettivo su pazienti con paragangliomi dell'osso temporale, Prasad et al raccomanda che i pazienti anziani con forme avanzate di questi tumori essere gestiti con un approccio di attesa e-scan, con la radioterapia riservato per il trattamento di tumori a crescita rapida .Nello studio, tra i pazienti con tumori D di classe C o che sono stati sottoposti gestione wait-and-scan, i ricercatori hanno riscontrato che il tumore è rimasto stabile in 22 dei 24 pazienti che sono stati seguiti per meno di 3 anni e che il paraganglioma è rimasta stabile o regredito in 10 di 12 pazienti che sono stati seguiti per 3-5 anni. Inoltre, il tumore è rimasto stabile o regredito in cinque dei 11 pazienti che sono stati seguiti per più di 5 anni. [Prasad et al.,2014] [17]
Una revisione della letteratura, Prasad e colleghi ha dichiarato, ha rivelato alcuna prova conclusiva che la radioterapia è una modalità primaria efficace per il trattamento di una classe C o D paragangliomi osso temporale [Prasad et al.,2014][17]
Terapia chirurgica
In generale, tutti i pazienti che sono in grado di vista medico dovrebbero essere sottoposti a trattamento chirurgico. La chirurgia ottimale rimuove tutto il tumore in blocco perché margini positivi sono associati a tassi di sopravvivenza poveri. Le procedure di resezione che possono essere eseguite per dell'osso temporale includono una laterale di resezione modificato temporale osso, laterale la resezione dell'osso temporale, subtotale la resezione dell'osso temporale, e totale la resezione dell'osso temporale. Le procedure e nomenclatura specifici variano tra i chirurghi. Interventi chirurgici adiuvanti, tra cui la dissezione del collo, parotidectomia, e craniotomia, devono essere eseguite quando indicato. Tumori in stadio avanzato con invasione intracranica hanno una prognosi grave, e il trattamento dovrebbero probabilmente essere limitati a palliazione con meno estese (e meno morboso) le procedure chirurgiche.
Dettagli Preoperatori
Determinazione della stadio del tumore e lo stato medico assiste il chirurgo nella pianificazione chirurgica. L'obiettivo dovrebbe essere la rimozione completa del tumore con la conservazione del SNC e altre strutture vitali, quando possibile. La Pianificazione Preoperatoria comprende la mappatura dell’ estensione della malattia sia con la valutazione clinica ,che radiografica. L’invasione del Tumore nella regione della arteria carotide interna, del seno sigmoideo, o della vena giugulare richiede ulteriori indagini come il test di occlusione con il palloncino, con scansione xeno / CT (dimostrando l'integrità della cerebrale controlaterale) o l’angiografia con fase venosa (per determinare il dominio di il deflusso cerebrale). Il consulto con un neurochirurgo può essere necessario se si sospetta il coinvolgimento della dura. Lo stato di salute del paziente svolge un ruolo importante nella sua tolleranza ad un lungo intervento chirurgico, il recupero post-operatorio, la guarigione, e la riabilitazione post-operatoria.
Petrectomia esterna o resezione laterale dell'osso temporale [Portmann M.,1975;, Schmerber S., et al ]
La resezione interessa la totalità del MUE osseo e cartilagineo, allargata, se necessario, alla conca, al timpano e all'osso timpanico in basso e in avanti, eventualmente con una parotidectomia esofacciale associata e con una condilectomia (Figura 13, Figura 14, Figura 15). La resezione è allargata alla mastoide, se possibile in monoblocco, di modo che, al termine dell'intervento, è realizzato un vero svuotamento dell'orecchio con eventuale conservazione del nervo faciale e degli ossicini.
Alcuni autori riempiono parzialmente questa cavità con un lembo muscolare (muscolo temporale) o muscolocutaneo o, anche, con un lembo libero (tipo parascapolare), cosa che facilita la cicatrizzazione ma che rende più difficile l'individuazione di un'eventuale recidiva.
Altri tipi di petrectomia [Portmann M.,1975;, Conley J.J., Novak A.J. 1960]
Essi interessano i tumori propagati all'orecchio medio.
La petrectomia subtotale (Figura 16) reseca le cavità dell'orecchio medio, il seno laterale, la dura madre, il labirinto fino al MUI, l'articolazione temporomandibolare e la parotide, spesso con sacrificio del VII; la carotide intrapetrosa è rispettata. La riparazione richiede una plastica di dura madre o un riempimento della cavità con un ampio lembo muscolocutaneo oppure con un lembo libero.
Nella petrectomia totale, la petrectomia subtotale è allargata alla carotide interna (che richiede una prova di clampaggio carotideo) e alla tuba uditiva.
Questi ultimi due interventi richiedono spesso la collaborazione di un neurochirurgo e sono riservati a pazienti in buone condizioni generali, a causa dei rischi operatori.
È spesso necessario il riempimento della vasta cavità operatoria con dei lembi di vicinanza peduncolati o liberi (Figura 17, Figura 18, Figura 19, Figura 20). Questo riempimento favorisce la cicatrizzazione e permette un'irradiazione a dose tumoricida, spesso necessaria in questo tipo di tumore.
Trattamento delle aree linfonodali [Kollert et al 2004]
Il drenaggio linfatico del MUE avviene nella parotide e verso le stazioni I, IIa, IIb e III.
Il trattamento delle aree linfonodali con svuotamento cervicale e parotidectomia (Figura 18) è relizzato, se possibile, in monoblocco, insieme alla petrectomia.
Dettagli Intraoperatori
Gestione del sito primario
Hirsch e Chang hanno descritto le procedure operative in dettaglio e le indicazioni in base alla posizione e stadio del tumore [Hirsch BE, Chang CYJ, 1997]. [18] Medina (1990) ha descritto diverse modifiche delle dissezione laterali dell'osso temporale (LTBR) in base alla localizzazione della malattia Medina et al 1990., [ 19]
Un LTBR modificato rimuove l'EAC e lascia la membrana timpanica non coinvolta intatta. Questo tipo di resezione è adatto per i tumori originari della conca, senza coinvolgimento della EAC.
Il LTBR include la resezione della EAC, membrana timpanica, martello e incudine. I confini sono la cavità dell'orecchio medio e staffa mediale, la cavità mastoide posteriormente, l’epitimpano e la radice zigomatica superiormente, l'articolazione della capsula temporo-mandibolare (ATM) anteriormente, l'anello timpanico medialmente ,la fossa infratemporale (ITF) inferiormente. Il margine laterale dipende dal grado di diffusione. La capsula otica e nervo facciale sono conservati. Il LTBR è appropriato per tumori T1 e T2.
Il LTBR inizia con una lunga incisione retroauricolare estende dalla fossa temporale nel collo. Se la pinna è da conservare, una seconda incisione viene effettuata entro laterale conca alla lesione. Se la pinna è da resecare, un'incisione preauricolare è incorporato per l'incisione retroauricolare permettendo al padiglione auricolare e la pelle circostante da includere nel campione. Un mastoidectomia corticale viene eseguita e il nervo facciale identificati. Rimozione ossea è estesa nella radice zigomatica e al crinale digastrico. Un incavo facciale esteso è fatta, e l'articolazione incudostapediale è separato. L'incavo facciale continua inferiormente ed anteriormente lateralmente al nervo facciale, ma mediale rispetto all’ anulus, fino a quando il campione viene attaccato soltanto alla parete anteriore canale osseo a livello della capsula temporomandibolare. Un osteotomo viene utilizzato per separare il campione ossee. Il parotidectomia viene eseguita in blocco.
Una resezione subtotale osso temporale (STBR) viene eseguita quando l'invasione mediale alla membrana timpanica o in mastoide (malattia T3) è evidente. In questo caso, il margine mediale può essere ottenuto in modo frammentario, di solito con un trapano. Il campione comprende il LTBR con dissezione ulteriore della capsula otica e la parete ossea mediale dell'orecchio medio e della mastoide. I margini di resezione sono i sigma del seno e della fossa posteriore dura posteriormente, dura mezza fossa superiormente, carotide interna anteriormente, bulbo giugulare inferiormente, e apice petroso mediale. Sulla base del grado di diffusione del tumore, dissezione può includere il condilo della mandibola, del nervo facciale, dura, sigma seno, e il contenuto della fossa infratemporale. L'arteria carotide è scheletrato e diventa il margine mediale.
Coinvolgimento tumorale del bulbo giugulare richiede legatura della vena giugulare inferiore e controllo prossimale del seno sigmoideo. Il nervo facciale è tradizionalmente sacrificato, con il margine prossimale preso nel segmento canale uditivo labirintico o interno. Tuttavia, il chirurgo può decidere di preservare il nervo se esiste alcuna indicazione di coinvolgimento del nervo. L'estensione mediale della dissezione a livello della capsula otica dipende dalla profondità di coinvolgimento ed è fatto frammentario. Estensione del tumore nel protympanum, tuba di Eustachio, o carotide sono affrontati con una fossa dissezione infratemporale. Il muscolo temporale si riflette e zigomatica rimossa. Il condilo mandibolare viene asportato. Il ricavato dissezione basano sulla estensione della malattia, ma possono includere l'identificazione della piastra pterigoideo, il nervo mandibolare (V3), e l'arteria carotide orizzontale e possono includere una craniotomia temporale.
Un TBR totale può essere utilizzato per affrontare la malattia T4. Tuttavia, questa procedura è associata ad una significativa morbidità e non può migliorare significativamente la sopravvivenza in questi casi di malattia avanzata. Il totale TBR include il STBR con resezione aggiuntiva dell'apice petroso. L'arteria carotide interna può essere isolato, mobilitato, e conservata o asportato. Il seno sigmoideo, vena giugulare, carotide, dura e CNs vengono rimossi come indicato dalla estensione del tumore.
Gestione della joint parotide e temporo
I linfonodi intra parotidei sono un primo sito di drenaggio scaglione per i tumori della EAC e dell'orecchio medio. Un margine anteriore adeguata per la resezione dell'osso temporale comporta abitualmente la resezione della ghiandola parotide, articolazione temporo-mandibolare e condilo. La resezione di questi tessuti molli affronterà anche l'estensione dei tessuti molli minimo oltre l'osso temporale. Idealmente, questo viene eseguito in blocco con l'osso temporale. Un parotidectomia superficiale è eseguita con la conservazione del nervo facciale per tumori T1 e T2. Quando il nervo facciale viene resecato per lesioni più avanzate, un parotidectomia totale può essere eseguita.
Gestione del collo
Anche se le metastasi al collo non è comune nei tumori limitate dell'osso temporale, dissezioni del collo sono regolarmente eseguite, la rimozione dei linfonodi nel collo è controversa, perché non è chiaro se una dissezione del collo migliora la sopravvivenza. Con più ampia tumori, dissezione del collo offre messa in scena e fornisce il controllo dei grossi vasi e l'esposizione alla base del cranio. Tuttavia, la presenza di metastasi è associato ad una prognosi infausta, e dissezione non migliora la sopravvivenza[Moody et al 2000 ;Moffat et al., 2005.]. [6, 1]
Gestione della dura e del cervello
Sebbene coinvolgimento della dura e il cervello porta ad una prognosi infausta, un approccio aggressivo include la resezione della dura e un piccola porzione del lobo temporale con un margine sano. I pazienti con dolore severo devono essere trattati con farmaci per il dolore, la chemioterapia e la radioterapia
Ricostruzione
Facial innesto del nervo non è di solito eseguita in presenza di una lesione maligna. Gestione di paralisi del nervo facciale può includere XII CN a VII innesto, croce innesto del viso, e le procedure statiche. Resezioni estese possono provocare grandi difetti del tessuto molle. Un lembo di muscolo temporale può essere usato per riempire le piccole e medie difetti. Il miocutaneo trapezio lembo peduncolato è una scelta eccellente per la ricostruzione del difetto tissutale e pelle morbida. Il lembo pettorale ha limitato portata lontana al margine asportato. Il lembo libero retto addominale e radiale dell'avambraccio falda sono particolarmente adatti per la zona. Difetti durali devono essere riparati in primo luogo o alla ricostruzione del trapianto.
Dettagli Postoperatorie
Cura postoperatoria è costituito da complicanze di monitoraggio della ferita, vitalità falda, complicazioni intracraniche, e le complicazioni di deficit NC. Se la dura è stato asportato e riparato, la ferita deve essere osservato per una perdita di liquido cerebrospinale. La terapia di supporto per vertigini, nausea e vertigini è necessario quando si inserisce la capsula otica durante la resezione. Cura degli occhi dovrebbe essere istituita se postoperatorio paralisi facciale si sviluppa o se il nervo facciale è asportato. La resezione del CN X richiede la deglutizione e piega la riabilitazione vocale e di osservazione per aspirazione o respiratori complicazioni. Se l'articolazione temporo-mandibolare è stato rimosso, la mandibola dovrebbe essere mobilitata precoce per prevenire la disfunzione controlaterale.
Complicazioni
Complicazioni di trattamento dipende dall'estensione della resezione e l'uso di radiazioni aggiuntiva. Perdita postoperatoria dell'udito, paralisi del nervo facciale, vertigini e altri deficit CN (ad esempio, CN V, VII, VIII, IX, X, XI) si può verificare. La resezione della dura può predisporre a perdite cerebrali di liquido spinale, meningite, o complicazioni intracraniche. Complicazioni significativi possono derivare da traumi o resezione della carotide. Radiazioni ha conosciuto complicazioni di fibrosi dei tessuti molli, la distruzione del tessuto delle ghiandole salivari, osteoradionecrosi dell'osso temporale, e gli effetti sul sistema nervoso centrale, eventualmente, se il campo di radiazione si estende ai tessuti intracranici.
References
- Moffat DA, Wagstaff SA, Hardy DG. The outcome of radical surgery and postoperative radiotherapy for squamous carcinoma of the temporal bone. Laryngoscope. 2005 Feb. 115(2):341-7. [Medline].
- Keereweer S, Metselaar RM, Dammers R, Hardillo JA. Chronic serous otitis media as a manifestation of temporal meningioma. ORL J Otorhinolaryngol Relat Spec. 2011. 73(5):287-90. [Medline].
- Jin YT, Tsai ST, Li C, Chang KC, Yan JJ, Chao WY, et al. Prevalence of human papillomavirus in middle ear carcinoma associated with chronic otitis media. Am J Pathol. 1997 Apr. 150(4):1327-33. [Medline].
- Lim LH, Goh YH, Chan YM, Chong VF, Low WK. Malignancy of the temporal bone and external auditory canal. Otolaryngol Head Neck Surg. 2000 Jun. 122(6):882-6. [Medline].
- Leonetti JP, Smith PG, Kletzker GR, Izquierdo R. Invasion patterns of advanced temporal bone malignancies. Am J Otol. 1996 May. 17(3):438-42. [Medline].
- Moody SA, Hirsch BE, Myers EN. Squamous cell carcinoma of the external auditory canal: an evaluation of a staging system. Am J Otol. 2000 Jul. 21(4):582-8. [Medline].
- Choi JY, Choi EC, Lee HK, Yoo JB, Kim SG, Lee WS. Mode of parotid involvement in external auditory canal carcinoma. J Laryngol Otol. 2003 Dec. 117(12):951-4. [Medline].
- Arriaga M, Curtin H, Takahashi H, Hirsch BE, Kamerer DB. Staging proposal for external auditory meatus carcinoma based on preoperative clinical examination and computed tomography findings. Ann Otol Rhinol Laryngol. 1990 Sep. 99(9 Pt 1):714-21. [Medline].
- Austin JR, Stewart KL, Fawzi N. Squamous cell carcinoma of the external auditory canal. Therapeutic prognosis based on a proposed staging system. Arch Otolaryngol Head Neck Surg. 1994 Nov. 120(11):1228-32. [Medline].
- Zhang B, Tu G, Xu G, Tang P, Hu Y. Squamous cell carcinoma of temporal bone: reported on 33 patients.Head Neck. 1999 Aug. 21(5):461-6. [Medline].
- Gillespie MB, Francis HW, Chee N, Eisele DW. Squamous cell carcinoma of the temporal bone: a radiographic-pathologic correlation. Arch Otolaryngol Head Neck Surg. 2001 Jul. 127(7):803-7. [Medline].
- Gaudet JE, Walvekar RR, Arriaga MA, Dileo MD, Nuss DW, Pou AM, et al. Applicability of the pittsburgh staging system for advanced cutaneous malignancy of the temporal bone. Skull Base. 2010 Nov. 20(6):409-14. [Medline]. [Full Text].
- Nyrop M, Grontved A. Cancer of the external auditory canal. Arch Otolaryngol Head Neck Surg. 2002 Jul. 128(7):834-7. [Medline].
- Kunst H, Lavieille JP, Marres H. Squamous cell carcinoma of the temporal bone: results and management.Otol Neurotol. 2008 Jun. 29(4):549-52. [Medline].
- Nakagawa T, Kumamoto Y, Natori Y, et al. Squamous cell carcinoma of the external auditory canal and middle ear: an operation combined with preoperative chemoradiotherapy and a free surgical margin. Otol Neurotol. 2006 Feb. 27(2):242-8; discussion 249. [Medline].
- Pemberton LS, Swindell R, Sykes AJ. Primary radical radiotherapy for squamous cell carcinoma of the middle ear and external auditory cana--an historical series. Clin Oncol (R Coll Radiol). 2006 Jun. 18(5):390-4. [Medline].
- Prasad SC, Mimoune HA, D'Orazio F, et al. The role of wait-and-scan and the efficacy of radiotherapy in the treatment of temporal bone paragangliomas. Otol Neurotol. 2014 Jun. 35(5):922-31. [Medline].
- Hirsch BE, Chang CYJ. Carcinoma of the temporal bone. Myers EN, ed. Operative Otolaryngology Head and Neck Surgery. Philadelphia, Pa: WB Saunders; 1997. 1434-1458.
- Medina JE, Park AO, Neely JG, Britton BH. Lateral temporal bone resections. Am J Surg. 1990 Oct. 160(4):427-33. [Medline].
Radioterapia
La radioterapia è utilizzato in combinazione con la chirurgica escissionale per trattare i tumori dell'osso temporale Il protocollo per le radiazioni è individualizzato per ogni paziente, ma spesso utilizza un campo di radiazione fotonica con dosaggio totale di 7000 rad, mentre l'esposizione del cervello è tenuto a 6000 rad. Preauricolare, retroauricolare, e nodi secondari digastrici di solito sono racchiusi all'interno del campo di radiazione di installazione.
Più recentemente, la radioterapia ad intensità modulata in aggiunta alla radioterapia esterna è stata utilizzata sui tumori selezionati della testa e del collo, compreso il carcinoma dell’osso temporale. Dosimetria corretta e precisa delineazione del volume di destinazione sono! Cato ad eccellente riportato locale-libertà dalla progressione rates.86 chirurgia stereotassica guidata con Gamma Knife fino ad oggi è stato pubblicato solo per il trattamento di patologie benigne dell'osso temporale
La radioterapia primaria è indicata nel trattamento palliativo e l'eradicazione di dolore da metastasi ossee nel cancro della testa e del collo. Il sollievo dal dolore è stato segnalato, nel 70 al 90% dei pazienti trattati per metastasi ossee, con questa modalità. Altri mettono in discussione l'uso della radioterapia per il dolore e sostengono che gli stessi risultati possono essere ottenuti con una corretta terapia antalgica . .
Le complicanze della radioterapia sono ben conosciute e possono variare da lieve a grave. Radiazione del padiglione auricolare può causare desquamazione, irritazione, secchezza, e necrosi della cartilagine rimanente. All'interno della EAC, è stato documentato ispessimento della membrana timpanica e dell’epitelio del canale uditivo, insieme con la perdita delle ghiandole cerume che portano ad una secchezza grave . All'interno dell’ 'orecchio medio la disfunzione della tuba di Eustachio può portare ad effusione. L’Osteoradionecrosi si può verificare nel EAC ossea, mastoide, o base cranica A causa della devascolarizzazione delle ossa, tumori indotti dalle radiazioni, la necrosi parenchimale cerebrale, e pseudo aneurismi della carotide, anche se estremamente rari, possono verificarsi a seguito di radiazioni all’osso temporale .
Chemioterapia
I Regimi chemioterapici sono il cardine del trattamento per rabdomiosarcoma pediatrico con radioterapia adiuvante e chirurgia quando indicato da Yagisawa et al.2007, Il regime chemioterapico singolo o multiplo è in corso di valutazione nell’utilizzo del cancro della testa e del collo con metastasi. Il trattamento sotto controllo include taxani, Cisplatino e 5-fluorouracile 92. Purtroppo, non è stato ancora dimostrato che l'uso di agenti chemioterapici abbia un impatto significativo per i tassi di sopravvivenza Chemioterapia preoperatoria è stata valutata da Nakagawa et al in una serie retrospettiva di pazienti trattati con chemioradio terapia preoperatoria o con la sola chemio radioterapia Nakagawa et al 2006). Quattro delle 8 pazienti trattati con chemio radioterapia (5-Flourouracil o un complesso fluoropirimidina durante radioterapia esterna con una dose di 40Gy), seguita da chemioterapia, in un caso, erano liberi di malattia a 24-47 mesi. Pemberton et al hanno riportato la sopravvivenza del 53% cancro-specifica di 123 pazienti trattati con la sola radioterapia (55 Gy). Pemberton ,et al 2006 .
Gestione del dolore e qualità della vita
I pazienti con diagnosi di tumori maligni dell'osso temporale possono presentare dolore. Il dolore può essere attribuito alla massa tumorale primaria, erosione ossea o compromissione vascolare e di strutture nervose in quanto il tumore infiltra aree intorno all'osso temporale, come l’angolo ponto-cerebellare, la fossa infratemporale, l’articolazione temporo-mandibolare, o la regione cervicale superiore. Purtroppo, il dolore da cancro è spesso sottovalutato e sotto trattato 93 Le opzioni disponibili, di solito sono composte dalla combinazione di un intervento chirurgico con la radioterapia, che si è riscontrato che causano un aumento significativo nel dolore quando viene valutato utilizzando la tecnica di indagine della qualità della vita.94 Lo spasmo mio fasciale può anche contribuire a disagio dopo l'interruzione chirurgica di un normale gruppo muscolare funzionale.
La Gestione farmacologica del dolore nella regione testa-collo include l'identificazione e il controllo sia del dolore somatico che neuropatico. Le Linee guida di controllo del dolore somatico sono stati adottati dalla Organizzazione mondiale della Salute e piani di trattamento che iniziano con analgesici leggeri, più! farmaci anti-infiammatori non steroidei, progressione con oppiacei lievi e, infine, di oppioidi analgesici 95 trattamento efficace per il dolore neuropatico può iniziare con amitriptilina e carbamazepina. Blocchi nervosi, soprattutto per tumori maligni che coinvolgono i nervi cranici e catene simpatico / parasimpatico, può essere indicato per una efficace management.96 dolore
Esito Fattori prognostici e Sopravvivenze
Le statistiche relative alla sopravvivenza non sono significative, a causa del basso numero di pazienti in ogni serie. Le grandi casistiche sono spalmate su diversi decenni, di modo che i trattamenti realizzati non sono omogenei.
Tuttavia, alcuni elementi comuni emergono da queste pubblicazioni: essi sono l'estensione del tumore e lo stadio tumorale.La prognosi è legata al sito principale, il tipo istologico, e il trattamento. [20] Conley e Novak , nel 1961, riferivano una sopravvivenza del 18% a 5anni, Lewis , nel 1975, riferiva una sopravvivenza globale del 25% su una serie di 100 pazienti e Austin et al. 1994 , nel 1994, riferivano un tasso del 30% a 3anni.
Per Nyrop e Grontved [15], la sopravvivenza negli stadi 1 e 2 è elevata, con un tasso di recidive molto basso. Negli stadi III e IV, la percentuale di recidiva è molto elevata e la sopravvivenza a 5anni è dell'ordine del 20%.
Zhang et al. 1999 [, su una serie di 33 pazienti operati, riscontrano una sopravvivenza del 100% per i T1 e T2, del 69% per i T3 e del 20% per i T4.Il risultato del trattamento per i tumori nelle fasi iniziali è favorevole, con la maggior parte della serie che riportano un tasso di sopravvivenza 80-100%. Tumori fase successiva dopo l'intervento adeguato e radioterapia hanno una sopravvivenza tra il 50% e l'80%. Lesioni avanzate hanno una prognosi infausta nonostante il trattamento aggressivo, con sopravvivenza a 2 anni del 0-40%[Moody et al 2000 ;Moffat et al., 2005.]. [6, 1] Gli elementi di prognosi infausta [Chang et al 2009, Lobo et al 2008 sono l'invasione della dura madre, la paralisi facciale, la lesione dei nervi cranici e i dolori intensi. La chirurgia di salvataggio dopo una resezione incompleta è associato ad una prognosi peggiore rispetto ad una procedura definitiva in un campo undisrupted [Moffat et al., 2005]. [1 ] L'interesse delle petrectomie allargate è discusso; in una metanalisi basata su 26 casi, Prasad e Janecka 1994 riferiscono una sopravvivenza nulla a 1 anno quando si è dovuta resecare la carotide interna. Viceversa, Moffat et al.2005 [hanno realizzato per dei CE del temporale una petrectomia totale con conservazione della carotide interna in sette casi su 15, con una sopravvivenza del 47% a 5anniUn mastoidectomia o escissione limitato eseguita da un ente esterno prima del rinvio complica la valutazione preoperatoria e messa in scena, sconvolge i margini, e costringe il chirurgo di operare in un campo infiammato con punti di riferimento interrotte. Margini positivi, malattia linfonodale, coinvolgimento durale e malattia avanzata sono associati con la sopravvivenza più poveri [Moody et al 2000 ;Moffat et al., 2005.] [6, 1]
Conclusioni
la Diagnosi e la gestione dei tumori dell’ osso temporale! continua ad essere una sfida formidabile, nonostante i progressi in microchirurgia. Anche se le tecniche limitate ai tumori del padiglione auricolare o confinate al EAC hanno una prognosi relativamente favorevole, spesso non è possibile apprezzare appieno preoperatoriamente l'estensione del tumore. La Resezione dell’osso temporale è difficile, e non può consentire l’asportazione in blocco delle neoplasie. La istituzione di margini puliti è ulteriormente gravato da insufficiente quantità di tumore nella sezione dei campioni congelati, errore di campionamento e quantità significative di osso neo campione. Vi è una significativa variabilità dei dati in termini di sopravvivenza del cancro dell’osso temporale, In genere i dati !! mostrando un tasso di guarigione a 5 anni che va dal 25 al 50%.
In caso di resezione completa è in discussione, se può essere impiegata la radioterapia aggiuntiva. Sebbene ci sia stato accordo sul fatto che la sola radioterapia si è dimostrata inefficace per il trattamento completo dei tumori maligni dell’osso temporale!; il suo uso nel periodo postoperatorio ha mostrato di aumentare la sopravvivenza in pazienti in cui è stato rimosso il tumore in un solo intervento . La chemioterapia è indicata solo un numero limitato di tipi di tumore.
La Chirurgia e gli interventi coadiuvanti per i tumori maligni dell’osso temporale rappresentano una possibilità per la vita e sostenere trattamento alla luce di un tumore raro e terribile, soprattutto dopo il frequente ritardo nella diagnosi. Elevato sospetto per questi tumori, insieme con la valutazione e il trattamento del dolore che accompagna sia la malattia e il trattamento adeguato, può consentire esiti potenzialmente favorevoli, nonostante la prognosi infausta che spesso accompagnano la diagnosi.
Futuro e polemiche
La gestione ottimale del tumore dell'osso temporale rimane poco chiaro a causa della continua dibattito sulla messa in scena, l'utilità della valutazione radiografica preoperatoria, l'estensione e la nomenclatura delle procedure chirurgiche, e l'uso di radiazioni adiuvante. Il numero limitato di casi di neoplasie maligne dell'osso temporale per ogni singola istituzione preclude conclusioni definitive per quanto riguarda il protocollo ottimale per la gestione. Il futuro delle strategie di miglioramento di trattamento consiste in uno sforzo multi-istituzionale di adottare un sistema di stadiazione e sviluppare studi prospettici.
86. Lee N, Xia P, Fischbein NH, et al. lntensity-modulated radiation therapy for head and neck cancer: the UCSF experience focusing on target volume delineation, . Int J Biol Phys Radiat Oncol 2003 1 settembre; 57 (1): 49-60.
92. de Mulder PH The chemotherapy of head and neck cancer Anticancer Drugs 1999:10(suppl 1):S33-S37
93. Griepp ME Under medication for pain: an ethical model. ANS Adv Nurs Sci 1992:15:44-53
94. Whale Z, Lyne PA, Papanikolaou P Pain experience following radical treatment for head and neck cancer Eur J Oncol Nurs. 2001 Jun;5(2):112-20.
95, World Health Organization. Cancer Pain Relief and Palliative Care:
Report of a WHO Expert Committee Geneva: WHO, 1990
BIBLIOGRAFIA
ANAES. Recommandations pour la pratique clinique. Prise en charge diagnostique et thérapeutique du carcinome basocellulaire de l'adulte, mars 2004. http://www.has-sante.fr/portail/jcms/c_272312/prise-en- charge-diagnostique-et-therapeutique-du-carcinome-basoc ellulaire-de-ladulte.
Anthia N.H., Buch V.I. Chondrocutaneous advancement flap for the marginal defects of the ear Plast Reconstr Surg 1967 ; 39 : 472-477
Arriaga M, Hirsch BE, Kamerer DB, Myers EN. Squamous cell carcinoma of the external auditory meatus (canal). Otolaryngol Head Neck Surg. 1989 Sep. 101(3):330-7. [Medline].
Arriaga M., Curtin H., Takahashi H., Hirsch B.E., Kamerer D.B. Staging proposal for external auditoty meatus carcinoma based on preoperative clinical examination and computed tomography findings Ann Otol Rhinol Laryngol 1990 ; 99 : 714-721[Medline].
Arriaga M., Curtin, Takahashi H., Kamerer D.B. The role of preoperative CT-scan in staging external auditory meatus carcinoma: radiologic-pathologic correlation study Otolaryngol Head Neck Surg 1991 ; 105 : 6-11[Medline].
Aubry K., Lerat J., Herman P., Guichard J.P., Tran Ba Huy P. Eustachian tube melanoma treated by double surgical approach Rev Laryngol Otol Rhinol 2010 ; 131 : 221-224
Austin J.R., Stewart K.L., Fawzi N. Squamous cell carcinoma of the external auditory canal: therapeutic prognosis based on a proposed staging system Arch Otolaryngol Head Neck Surg 1994 ; 120 : 1228-1232 [Medline].
Biel M. Advances in photodynamic therapy for the treatment of head and neck cancers Lasers Surg Med 2006 ; 38 : 349-355 [cross-ref]
Boudard P., Darsonval V., Disant F. Les reconstructions partielles du pavillon auriculaire Chirurgie des tumeurs cutanées de la face. Rapport de la Société française d'ORL et de CCF Paris: Masson (2002). 213-237
Boudard P. Reconstruction partielle du pavillon auriculaire Chirurgie plastique et réparatrice de la face et du cou Paris: Elsevier Masson (2011). 276-289
Butman J.A., Kim H.J., Baggenstos M., Ammerman J.M., Dambrosia J., Patsalides A., e al. Mechanisms of morbid hearing loss associated with tumors of endolymphatique sac in von-Hippel-Lindau disease JAMA 2007 ; 298 : 41-48 [cross-ref]
Carr S., Anderson C. Metastatic rectal adenocarcinoma of the external auditory canal J Laryngol Otol 2009 ; 123 : 363-364 [cross-ref]
Chang C.H., Shu M.T., Lee J.C., Leu Y.S., Chen Y.C., Lee K.S. Treatments and outcomes of malignant tumors of external auditory canal Am J Otolaryngol 2009 ; 30 : 44-48 [cross-ref]
Chen W.Y., Kuo S.H., Chen Y.H., Lu S.H., Tsai C.L., Chia-Hsien Cheng J., e al. Postoperative intensity-modulated radiotherapy for squamous cell carcinome of the external auditory canal and middle ear: treatment, outcomes, marginal misses and perspective on target delineation Int J Radiat Oncol Biol Phys 2012 ; 82 : 1485-1493 [cross-ref]
Choi JY, Choi EC, Lee HK, Yoo JB, Kim SG, Lee WS. Mode of parotid involvement in external auditory canal carcinoma. J Laryngol Otol. 2003 Dec. 117(12):951-4. [Medline].
Conley J.J., Novak A.J. The surgical treatment of tumour of the ear and temporal bone Arch Otolaryngol 1960 ; Apr. 71:635-52. [Medline]
Crabtree JA, Britton BH, Pierce MK. Carcinoma of the external auditory canal. Laryngoscope. 1976 Mar. 86(3):405-15. [Medline].
Demetriades A.K., Saunders N., Rose P., Fisher C., Rowe J., Tranter R., e al. Malignant transformation of acoustic neuroma/vestibular schwannoma 10 year years after gamma knife stereotactic radiosurgery Skull Base 2010 ; 20 : 381-387 [cross-ref]
Fernandez-Latorre F., Menor-Serrano F., Alonso-Charterina S., Arenas-Jimenez J. Langerhans'cell histiocytosis of the temporal bone in pediatric patients: imaging and follow-up AJR Am J Roentgenol 2000 ; 174 : 217-221
Ferlito A., Devaney K.O., Rinaldo A. Primary carcinoid tumor of the middle ear: potentially metastasizing tumorActa Otolaryngol 2006 ; 126 : 228-231 [cross-ref]
Gaudet JE, Walvekar RR, Arriaga MA, Dileo MD, Nuss DW, Pou AM, et al. Applicability of the pittsburgh staging system for advanced cutaneous malignancy of the temporal bone. Skull Base. 2010 Nov. 20(6):409-14. [Medline]. [Full Text].
Gillespie M.B., Francis H.W., Chee N., Eisele D.W. Squamous cell carcinoma of the temporal bone. A radiographic-pathologic correlation Arch Otolaryngol Head Neck Surg 2001 ; Jul. 127 : 803-807[Medline].
Glasscock M.E. Primary adenocarcinoma of the middle ear and temporal bone Arch Otolaryngol Head Neck Surg 1987 ; 113 : 822-824
Gurgel R.K., Karnell L.H., Hansen M.R. Middle ear cancer: a population-based study Laryngoscope 2009 ; 119 : 1913-1917
H Haute Autorité de santé. Label conjoint INCa-HAS - Carcinome épidermoïde cutané : prise en charge diagnostique et thérapeutique, 2009. http://www.has-sante.fr/portail/jcms/c_966362/label-con joint-inca-has-carcinome-epidermoide-cutane-prise-en-ch arge-diagnostique-et-therapeutique?xtmc=&xtcr=1.
Hirsch BE, Chang CYJ. Carcinoma of the temporal bone. Myers EN, ed. Operative Otolaryngology Head and Neck Surgery. Philadelphia, Pa: WB Saunders; 1997. 1434-1458.
Hirsch BE, Myers EN, Moody SA. Malignant tumors of the temporal bone. Laercio O, Selaimen S, eds.Otologia Clinia e Cirurgica. Revinter, Tijuca: 2000. 319-329.
Jin YT, Tsai ST, Li C, Chang KC, Yan JJ, Chao WY, et al. Prevalence of human papillomavirus in middle ear carcinoma associated with chronic otitis media. Am J Pathol. 1997 Apr. 150(4):1327-33. [Medline].
Kelli L., Rudman K.L., King E., Poetker D.M. Extrapulmonary small cell carcinoma metastasis to the external auditory canal with facial nerve paralysis Am J Otolaryngol 2011 ; 32 : 343-345
Keereweer S, Metselaar RM, Dammers R, Hardillo JA. Chronic serous otitis media as a manifestation of temporal meningioma. ORL J Otorhinolaryngol Relat Spec. 2011. 73(5):287-90. [Medline].
Kinney SE, Wood BG. Malignancies of the external ear canal and temporal bone: surgical techniques and results. Laryngoscope. 1987 Feb. 97(2):158-64. [Medline].
Kollert M., Draf W., Minovi A., Hofmann E., Bockmühl U. Carcinoma of the external auditory canal and middle ear: therapeutic strategy and follow up Laryngorhinootologie 2004 ; 83 : 818-823 [cross-ref]
Kunst H, Lavieille JP, Marres H. Squamous cell carcinoma of the temporal bone: results and management.Otol Neurotol. 2008 Jun. 29(4):549-52. [Medline].
Lasfargue JM. Cancer du méat auditif externe survenant après une irradiation. [thèse], Nantes, 1993
Legent F. Le conduit auditif externe (méat auditif externe). Rapport de la société française d'ORL et de CCF Paris: Arnette Blackwell (1995).
Leonetti JP, Smith PG, Kletzker GR, Izquierdo R. Invasion patterns of advanced temporal bone malignancies. Am J Otol. 1996 May. 17(3):438-42. [Medline].
Lewis J.S. Temporal bone resection: review of 100 cases Arch Otolaryngol 1975 ; 101 : 23-25
Lim LH, Goh YH, Chan YM, Chong VF, Low WK. Malignancy of the temporal bone and external auditory canal. Otolaryngol Head Neck Surg. 2000 Jun. 122(6):882-6. [Medline].
Lobo D., Liorente J.L., Suarez C. Squamous cell carcinoma of the external auditory canal Skull Base 2008 ; 18 : 167-172 [cross-ref]
Manolidis S, Pappas D Jr, Von Doersten P, Jackson CG, Glasscock ME 3rd. Temporal bone and lateral skull base malignancy: experience and results with 81 patients. Am J Otol. 1998 Nov. 19(6 Suppl):S1-15.[Medline].
Marandas P., Corré A., Oberlin O. Rhabdomyosarcome de l'oreille moyenne chez l'enfant : à propos de 26 cas traités à l'IGR Les cancers du pavillon de l'oreille. XXVe congrès de la Société française de cancérologie cervico-faciale Paris: Masson (1995). 114-120
Markou K., Elmer S., Perret C., Huchet A., Goudakos J., Liguoro D., e al. Unique case of malignant transformation of a vestibular schwannoma after fractioned radiotherapy Am J Otolaryngol 2012 ; 33 : 168-173
Masson J.K. A simple island flap for reconstruction of conchahelix defects Br J Plast Surg 1972 ; 25 : 399-403 [cross-ref]
Martin D., Mondie J.M. Les tumeurs cutanées et leur stratégie thérapeutique Ann Chir Plast Esthét 1998 ; 43 : 365-372
Mazeron J.J., Baillet F., Le Bourgeois J.P. Curiethérapie du pavillon de l'oreille Les cancers du pavillon de l'oreille. XXVe congrès de la Société française de cancérologie cervico-faciale Paris: Masson (1995). 114-120
Medina JE, Park AO, Neely JG, Britton BH. Lateral temporal bone resections. Am J Surg. 1990 Oct. 160(4):427-33. [Medline].
Moffat D.A., Wagstaff A.W., Hardy D.G. The outcome of radical surgery and post operative radiotherapy for squamous carcinoma of the temporal bone Laryngoscope 2005 ; 115 : 341-347 [cross-ref] [Medline].
Moody S.A., Hirsch B.E., Myers E.N. Squamous cell carcinoma of the external auditory canal: an evaluation of a staging system Am J Otol 2000 ; 21 : 582-588[Medline].
Morris LG, Mehra S, Shah JP, Bilsky MH, Selesnick SH, Kraus DH. Predictors of survival and recurrence after temporal bone resection for cancer. Head Neck. 2011 Sep 23. [Medline].
Nakagawa T, Kumamoto Y, Natori Y, et al. Squamous cell carcinoma of the external auditory canal and middle ear: an operation combined with preoperative chemoradiotherapy and a free surgical margin. Otol Neurotol. 2006 Feb. 27(2):242-8; discussion 249. [Medline].
Narayan D., Ariyan S. Surgical considerations in the management of malignant melanoma of the ear Plast Reconstr Surg 2001 ; 107 : 20-24 [cross-ref]
Negrier S., Saiag P., Guillot B., Verola O., Avril M.F., Bailly C., e al. Recommandations pour la pratique clinique : standards, options et recommandations 2005 pour la prise en charge des patients adultes atteints d'un mélanome cutané MO Ann Dermatol Venereol 2005 ; 132 (12Pt2) : 10S3-85S
Nyrop M., Grontved A. Cancer of the external auditory canal Arch Otolaryngol Head Neck Surg 2002 ; 128 : 834-837[Medline].
Parsons H, Lewis JS. Subtotal resection of the temporal bone for cancer of the ear. Cancer. 1954 Sep. 7(5):995-1001. [Medline].
Pemberton LS, Swindell R, Sykes AJ. Primary radical radiotherapy for squamous cell carcinoma of the middle ear and external auditory cana--an historical series. Clin Oncol (R Coll Radiol). 2006 Jun. 18(5):390-4. [Medline].
Pensak ML, Gleich LL, Gluckman JL, Shumrick KA. Temporal bone carcinoma: contemporary perspectives in the skull base surgical era. Laryngoscope. 1996 Oct. 106(10):1234-7. [Medline].
Prasad S., Janecka I.P. Efficacy of surgical treatments for squamous cell carcinoma of the temporal bone: a literature review Otolaryngol Head Neck Surg 1994 ; Mar.110 : 270-280 [cross-ref] [Medline].
Prasad SC, Mimoune HA, D'Orazio F, et al. The role of wait-and-scan and the efficacy of radiotherapy in the treatment of temporal bone paragangliomas. Otol Neurotol. 2014 Jun. 35(5):922-31. [Medline].
Portmann M. Traité de technique chirurgicale d'ORL et cervico-faciale. Tome 1 : Oreille et os temporal Paris: Masson (1975).
R Ramsey M.J., Nadol J.B., Pilch B.Z., McKenna M.J. Carcinoid tumor of the middle ear: clinical features, recurrences, and metastasis Laryngoscope 2005 ; 115 : 1660-1666 [cross-ref]
Ravin A.G., Pickett N., Johnson J.L., Fisher S.R., Levin L.S., Seigler H.F. Melanoma of the ear: treatment and survival probabilities based on 199 patients Ann Plast Surg 2006 ; 57 : 70-76 [cross-ref]
Rieh E., Stelgerwald c, Göbel H., Maier W., Offengeld C. Carcinoid of the middle ear. A case report HNO 2009 ; 57 : 835-838 [cross-ref]
Robier A., Lescanne E. Tumeur de l'oreille externe et moyenne Traité d'ORL Paris: Médecine-Sciences Flammarion (2008).
REFCOR : Recommandations pour la pratique clinique : tumeurs malignes primitives de l'oreille, 2008.
S Satter E.K., High W.A. Langerhans cell histiocytosis: a review of the current recommendations of the Histiocyte Society Pediatr Dermatol 2008 ; 25 : 291-295 [cross-ref]
Schmerber S., Righini, Soriano E. The outcome of treatments for carcinoma of the auditory canal Rev Laryngol Otol Rhinol 2005 ; 126 : 165-170
Spector JG. Management of temporal bone carcinomas: a therapeutic analysis of two groups of patients and long-term followup. Otolaryngol Head Neck Surg. 1991 Jan. 104(1):58-66. [Medline].
Stell PM, McCormick MS. Carcinoma of the external auditory meatus and middle ear. Prognostic factors and a suggested staging system. J Laryngol Otol. 1985 Sep. 99(9):847-50. [Medline].
Tran Ba Huy P, Duet M. Paragangliomes tympaniques et jugulaires. EMC (Elsevier Masson, Paris), Oto-rhino-laryngologie, 20-248-A-10, 2003.
Thomassin J.M., Roche P.H., Bracchini F., Epron J.P., Pellet W. Tumeur du sac endolymphatique Ann Otolaryngol Chir Cervicofac 2000 ; 117 : 274-280 [inter-ref]
W Willman C., Busque L., Griffith B. Langerhans cell histiocytosis (Histiocytosis X). A clonal proliferation diseaseN Engl J Med 1994 ; 331 : 154-160 [cross-ref]
Y Yagisawa M., Ishitoya J., Tsukuda M., Sakagami M. Chodrosarcoma of the temporal bone Auris Nasus Larynx 2007 ; 34 : 527-531 [cross-ref]
Z Zhang B., Tu G., Tang P., Hu Y. Squamous cell carcinoma of the temporal bone; reported on 33 patients Head Neck 1999 ; Aug. 21 : 461-466 [cross-ref] [Medline].
I tumori maligni del dell'orecchio e Osso temporale: uno studio di 27 pazienti e revisione della loro gestione
Pablo Martinez-Devesa, FRCSEd. (ORL-HNS), 1 Martyn L. Barnes, MRCSEd., 2 e Chris A. Milford, FRCS 1
Informazioni Autore ►copyright e licenza ►
Questo articolo è stato citato da altri articoli in PMC.
ABSTRACT
Tumori maligni dell'orecchio e dell'osso temporale sono tipi rari e aggressive di tumori. L'incidenza è stato segnalato per essere compreso tra uno e sei casi per milione di popolazione anni, che è meno dello 0,2% di tutti i tumori della testa e del collo. 1,2,3
Si stima che 1 caso di carcinoma dell'orecchio medio si verifica ogni 5000 ai 20.000 casi di malattia dell'orecchio. 4,5
Questi tumori si sviluppa principalmente per invasione diretta nelle strutture ossee e vicini temporale 6(parotide, fossa infratemporale, Dura, cervello). Metastasi linfatico sono rari (10%) e diffusione a distanza estremamente raro. 7
La tomografia computerizzata (CT) e la risonanza magnetica (MRI) tecniche 8,9,10 sono complementari e svolgono un ruolo fondamentale nella messa in scena e la prognosi. 10,11,12
Attualmente né l'Unione Internazionale Contro il Cancro (UICC), né il Joint Committee on Cancer (AJCC) ha prodotto un sistema di stadiazione dei tumori dell'orecchio e dell'osso temporale. Il sistema di stadiazione più comune utilizzato in pubblicazioni è presso l'Università di Pittsburgh 11,12,13,14(Tabella 1).
Università di Pittsburgh stadiazione TNM sistema proposto per il canale uditivo esterno
Il trattamento chirurgico dei tumori maligni delle ossa dell'orecchio e temporale non è universalmente concordato. Nelle lesioni generali localizzate nel canale uditivo esterno (EAC) (lesioni T1) sono trattati con una resezione limitata (ad esempio, la resezione locale, mastoidectomia radicale), mentre le lesioni più avanzate (T2 a T4) sono trattati con resezione in blocco (parziale temporale resezione ossea, petrosectomia subtotale, totale petrosectomia 10,12,13,15).
La radioterapia è sostenuto in aggiunta alla chirurgia o per palliativo piuttosto che come trattamento curativo in sé. 16,17
Sopravvivenza globale sono buoni per T1 e T2 lesioni, meno bene per lesioni T3, e povero di tumori T4. 2,3,4,5,10,12,13,15
MATERIALI E METODI
Tra il 1997 e il 2005, 27 pazienti sottoposti a trattamento per i tumori maligni delle ossa dell'orecchio e temporale sono stati identificati dal database Otorinolaringoiatria e attrezzature Skull Base al Radcliffe Infirmary, Oxford, Regno Unito. Le cartelle cliniche di questi pazienti sono stati rivisti per l'età, il sesso, la diagnosi, il trattamento (chirurgia, radioterapia e / o chemioterapia), le complicanze, follow-up, la recidiva, intervallo libero da malattia, e il tasso di sopravvivenza.
I pazienti sono stati classificati in due gruppi:
- Superficiale: quelli derivanti dalla pelle del, parotide, e dell'articolazione temporo-mandibolare (ATM) zona Pinna
- Profondo: quelli derivanti nel condotto uditivo e dell'osso temporale
Esse sono state organizzate secondo l'Università di Pittsburgh sistema TNM (Tabella 1) per il gruppo di tumore profondo (n = 9) e secondo il sistema UICC per il gruppo superficiale (n = 17). Un paziente (con un profondo angiosarcoma) è stato escluso dalla classifica per entrambi i sistemi.
Sono state eseguite cinque tipi di interventi chirurgici, in due grandi categorie:
- Resezione limitata:
- La resezione canale locale (LCR) e
- Mastoidectomia Radical (RM)
- Resezione in blocco:
- Laterale resezione ossea temporale (LTBR, costituito da una rimozione formale del osseo e cartilagineo canale uditivo esterno, membrana timpanica, martello, incudine e con l'identificazione e la conservazione del nervo facciale lungo il suo segmento verticale)
- Petrosectomia subtotale (SP, che comporta la rimozione dell'osso temporale laterale con conservazione del petrous dell'arteria carotidea e apice), e
- Petrosectomia totale (TP, che coinvolge la rimozione dell'intero dell'osso temporale con o senza carotide sacrificio)
Di sopravvivenza di Kaplan-Meier analisi sono stati utilizzati, e le prove sono state condotte sugli effetti di sopravvivenza di origine del tumore, l'inclusione di parotidectomia superficiali nella procedura operativa, e l'uso di radioterapia postoperatoria.
RISULTATI
I dati sono stati ottenuti per 27 pazienti, 18 maschi e 9 femmine, con un rapporto di 2 a 1 (distribuzione sesso non differivano per gruppo; chi quadrato p = 0,696). L'età media era di 66,5 anni (range 34-81). La profonda fascia di età media era di 62,6 (da 34 a 77 anni) e il gruppo superficiali 74,5 (da 64 a 81 anni). Questa differenza di età era statisticamente significativa (t-test campioni indipendenti e Mann-Whitney U test, entrambi p <0.005). Diagnosi, stadiazione e di gestione dei dati sono riportati nella Tabella Table22.
La diagnosi, stadiazione, e Data Management
DATI DELLA DIAGNOSTICA
Diagnosi istologiche erano carcinoma squamoso delle cellule (SCC) (20 casi, 74%), il carcinoma basocellulare (5 casi, 18%), angiosarcoma (1 caso; 4%), e il carcinoma anaplastico (1 caso; 4%).
Diciassette tumori sono stati classificati come superficiale e profondo 10, anche se il caso angiosarcoma (gruppo di profondità) è stato escluso dall'analisi statistica come questo tumore non può essere messo in scena sia con la Pittsburgh (solo per SCC) o l'UICC (per tumori superficiali della pelle) sistemi di stadiazione .
La distribuzione dei tumori (n = 26) era T1, 3 casi; T2, 4 casi; T3, 4 casi; e T4, 15 casi. Clinicamente malattia linfonodo-positivo evidente era presente in 3 di questi casi, e metastasi a distanza nei 1. Classificazione in stadi era Fase I, 3 casi; Fase II, 4 casi; Fase III, 10 casi; e Stage IV, 9 casi.
GESTIONE DATI
Venticinque pazienti sono stati sottoposti trattamento chirurgico, con 17 trattati con radioterapia adiuvante dopo l'intervento. Un paziente ha ricevuto radioterapia (45 Gy in 10 frazioni) come l'unica forma di trattamento e un altro paziente aveva radioterapia e la chemioterapia (cisplatino e 5-fluorouracile) come palliativo.
Gli interventi chirurgici eseguiti sono la resezione locale del canale (2 casi), mastoidectomia radicale (1 caso), laterale la resezione dell'osso temporale (16 casi), petrosectomia subtotale (3 casi), e petrosectomia totale (3 casi).
Inoltre, 15 pazienti sono stati sottoposti parotidectomia superficiali, 3 pazienti avevano una dissezione del collo eseguita (2 modificato radicale e 1 selettiva dissezione), e 9 pazienti avevano trasferimento ricostruzione dei tessuti (2 lembi peduncolo, 5 lembi liberi, 1 lembo locali, e 1 nervo facciale trapianto). Un paziente ha avuto la resezione dell'ATM e un altro aveva la resezione della malattia intracranica.
Sei pazienti hanno sofferto complicazioni: un paziente è deceduto dopo l'intervento a causa di sindrome da distress respiratorio. Un paziente ha sviluppato osteoradionecrosi del condotto uditivo esterno, che è stata gestita in modo tradizionale. Due pazienti hanno sofferto paralisi dei nervi facciali (uno temporaneo che ha recuperato pienamente e uno permanente, di grado IV Casa-Brackmann classificazione 18). Due lembi tenuti revisione dei loro anastomosi vascolari.
Dati di sopravvivenza
Il periodo di follow-up medio complessivo è stato di 25 mesi (da 0 a 60 MOS), e per i casi di sopravvissuti è stato di 37 mesi (da 2 a 60 mos).
Dei pazienti in scena 26 (escluso il angiosarcoma), 9 non sono mai liberi da malattia e 3 che hanno mostrato nuovamente. La quota non indurito da stadio al momento della presentazione era fase I, 0%;Fase II, il 29%; Fase III, 50%, e la fase IV, 60%.
La sopravvivenza globale mediana stimata è stata di 46 mesi (da 0 a 102 mos).
Dei 27 pazienti, 13 sono rimasti in vita senza malattia, 1 vivo con la malattia, e 13 morti (1 nel periodo postoperatorio, 1 di una causa estranea, 10 dagli effetti della malattia locale, e 1 da malattia metastatica).
La sopravvivenza generale a 3 anni è stata del 38% (95% CI, 19-58%), e la sopravvivenza a 5 anni del 19% (95% CI, da 3 a 35%).
Mediano stimato (95% CI) sopravvivenze dal palco dalla Kaplan-Meier analisi sono state Fase I, nessun decesso; Fase II,> 24 mesi; Fase III, 16 mesi (da 10 a 22 MOS), e la fase IV, 9 mesi (da 7 a 11 mos).
Ci sono stati dati sufficienti a dimostrare alcuna differenza nella sopravvivenza o intervallo libero da malattia correlata al sito di origine del tumore (superficiale rispetto a gruppi di profondità). Un Kaplan-Meier di sopravvivenza complotto di sede di origine è data in Fig. Fig.11.
L'analisi di Kaplan-Meier. Effetto del sito di origine del tumore sulla sopravvivenza.
Allo stesso modo, anche se c'era una tendenza verso un miglioramento della sopravvivenza quando è stato eseguito un parotidectomia, lo studio è stato sottodimensionato per dimostrare una significatività statistica. La sopravvivenza mediana globale stimato (95% CI) per entrambi i gruppi con parotidectomia era 46 mesi (da 0 a 102 MOS), e senza parotidectomia 9 mesi (da 0 a 24 mos). Un Kaplan-Meier di sopravvivenza plot confrontando inclusione o omissione parotidectomia nella procedura operativa è data in Fig. Fig.2.2. La trama è riprodotto e stratificata per l'origine del tumore (superficiale o profonda) in Fig. Fig.33.
L'analisi di Kaplan-Meier. Effetto di parotidectomia sulla sopravvivenza (indipendenti dal sito di origine del tumore).
L'analisi di Kaplan-Meier. Effetto della parotidectomia sulla sopravvivenza (stratificato per luogo di origine del tumore). (A) i tumori profondi. (B) i tumori superficiali.
Inoltre, la sopravvivenza globale mediana stimata per il gruppo superficiale, con la somministrazione della radioterapia è stata di 46 mesi versus 12 mesi, quando la radioterapia non è stato somministrato (Fig. 4). La radioterapia dati relativi al gruppo profondo erano insufficienti per l'analisi.
L'analisi di Kaplan-Meier. Effetto della radioterapia sulla sopravvivenza (stratificato per luogo di origine del tumore). (A) i tumori profondi (effetto radioterapia p = 0.63). (B) superficiale ...
Per escludere la possibilità di una relazione di confusione tra il trattamento con radioterapia o stadio della malattia e l'effetto di parotidectomia, un'ulteriore analisi di sopravvivenza (Cox di regressione) è stata condotta utilizzando modelli di sopravvivenza per tutti i fattori. Coerentemente con i risultati, in generale, stadio della malattia è stato l'unico fattore di influenzare la sopravvivenza (p <0,05), ma sia la radioterapia (p = 0,29) e parotidectomia (p = 0,12) ha portato a miglioramenti che non hanno raggiunto la significatività statistica.
DISCUSSIONE
I tumori maligni dell'orecchio e dell'osso temporale sono molto rari, e la mancanza di studi prospettici randomizzati (o meno) pone un problema per stabilire la corretta gestione di questo tipo di tumore. La gestione di questi tumori si basa solo sui dati disponibili di esperienza clinica con piccole serie isolati o raggruppati. SCC è stato il più studiato e riferito tumori maligni dell'orecchio e osso temporale, ma la maggior parte degli altri tumori comportarsi in maniera simile e condividere la generalmente scarsa risultato di questa malattia. 10
Uno dei principali problemi nella gestione di questi tumori è stata la mancanza di consenso nella stadiazione della malattia, un processo reso difficile a causa della stretta relazione anatomica a strutture nella fossa e del cranio di base infratemporale.
Il sistema di stadiazione TNM Università di Pittsburgh 11 è stato ampiamente accettato nella letteratura pubblicata nel campo. L'importanza di questa classificazione è che un T2 o T3 N1 tumore è considerato fase IV, in contrasto con il sistema di stadiazione AJCC (sesta edizione), in cui un T2 o T3 N1 tumore "pelle" sarebbe una fase III.
Riteniamo che parte del problema staging è che alcuni tumori hanno origine nella pelle e poi invadono strutture più profonde, mentre altri hanno origine nel condotto uditivo e osso temporale e diffondono lateralmente alla appendice sovrastante e la pelle adiacente. Tuttavia, siamo stati in grado di dimostrare una differenza statisticamente significativa nella sopravvivenza e ricorrenza modelli dei due gruppi, per cui questa ipotesi rimane solo l'esperienza degli autori.
In termini di opzioni di trattamento, l'evidenza disponibile sostiene un intervento chirurgico per il trattamento primario con intento curativo e radioterapia adiuvante o terapia palliativa. 16,17 La ricerca della letteratura ha trovato nessuno studio sugli effetti della chemioterapia in questi tumori.
Una revisione sistematica effettuata da Prasad e Janecka 2 nel 1994, rivedendo 26 serie di 144 pazienti trattati per temporali SCC osso, ha suggerito che per T3 e tumori T4 (quelli che coinvolgono l'orecchio medio e oltre), petrosectomia subtotale (conservando la petroso carotide apice e arteria) sembra migliorare la sopravvivenza.
Anche in questa recensione, la resezione di dura coinvolti non sembra migliorare la sopravvivenza e c'erano dati sufficienti per commentare la sopravvivenza dopo il trattamento nei pazienti con coinvolgimento dell'apice petroso, carotide interna, o il cervello. 2
Per quanto riguarda il trattamento di tumori stadio I e II (T2, N0 e T1), ci sono tre opzioni di gestione principali disponibili nella letteratura pubblicata:
- Un trattamento chirurgico "aggressivo" più in forma di resezione in blocco 3,11,13,15
- Un altro "conservatore" resezione locale 2,10 e limitando la radioterapia ai casi di resezione incompleta (tranne nel carcinoma adenoidocistico) 10
- E, infine, la posizione "intermedia" di petrosectomia selettiva con la conservazione di strutture neurali e vascolari, così come la capsula otica, perché questo trattamento nell'esperienza alcuni chirurghi 'non modifica il risultato a lungo termine, in particolare di aggressivi carcinomi a cellule basali senza invasione profonda. 19
Nella nostra serie, uno stadio del tumore, e la maggior parte degli stadi II, tumori III, e IV, sono stati trattati per resezione in blocco. Parotidectomia è stato incluso come parte della procedura chirurgica (come riportato in altre serie 3,11,13,15) in caso di accertata o sospetta il coinvolgimento della ghiandola parotide.
Anche se la malattia è rara, e numeri sono stati inadeguati per dimostrare differenze statisticamente significative, abbiamo fatto osservare un miglioramento della sopravvivenza per i tumori sia superficiale e profondo, quando è stato eseguito parotidectomia. Si consiglia pertanto una soglia bassa per includere questo come parte del trattamento chirurgico di tutti i tumori dell'osso temporale.
Linee guida della Società Americana di Chirurgia Cervico Facciale e la Società di testa e del collo chirurghi 20 raccomandano la radioterapia postoperatoria quando: (A) margini di resezione sono vicini (inferiore a 5 mm) o quando la vicinanza di un tumore a strutture importanti come carotide interna o nervo facciale preclude ampi margini; (B) del tumore è dimostrata a margini di resezione; (C) istologia postoperatoria rivela invasione perineurale. Queste condizioni si applicano alla maggior parte delle resezioni per il carcinoma dell'osso temporale, indicando così la radioterapia postoperatoria nella maggior parte dei casi, 21 anche se il suddetto revisione sistematica (Prasad e Janecka 2) non ha mostrato alcuna significativa differenza statistica nella sopravvivenza nei pazienti sottoposti laterale a resezione dell'osso temporale e radioterapia (48% di sopravvivenza globale a 5 anni) rispetto ai pazienti sottoposti a resezione dell'osso temporale laterale da solo (44% di sopravvivenza a 5 anni).
Il nostro studio dimostra che vi è una tendenza verso un aumento della sopravvivenza globale nel gruppo di tumori superficiali se la radioterapia viene utilizzato dopo l'intervento, anche se questo risultato non era statisticamente significativa (p = 0,18). Ci sono stati dati sufficienti per analizzare l'effetto della radioterapia nel gruppo profondo.
Infine, la sopravvivenza di questi tumori è stata variamente riportato in 2-, 3-, o intervalli di 5-annuali.Fase I e II tumori sono stati riportati, a seconda della serie, di avere un 50% 2 al 100% 10,11sopravvivenza. Fase III e la sopravvivenza IV varia dallo 0% 10 al 50%. 13,15 La sopravvivenza globale a 3 anni è stata del 38%, e la sopravvivenza a 5 anni del 19%, forse a causa del maggior numero di grandi dimensioni (T3 a T4) tumori in questo studio.
Ricorrenza è stato segnalato per essere ovunque tra il 25% per le fasi I e II al 100% per le fasi III e IV.10 Il nostro studio conseguito tassi di recidiva inferiori per le fasi III e IV (50-64%).
CONCLUSIONI
I tumori maligni dell'orecchio e dell'osso temporale sono rari e non vi è alcun consenso nella loro messa in scena e management.We sono stati in grado di dimostrare alcuna differenza nella sopravvivenza o ricorrenza per tumori superficiali o profonde della bone.Parotidectomy temporale sembrava migliorare la sopravvivenza sia superficiale e gruppi di tumori profondi, ma la significatività statistica non è stato raggiunto. Radioterapia sembrava anche per migliorare la sopravvivenza per il gruppo superficiale, ma ancora una volta, la significatività statistica non è stata raggiunta.
RIFERIMENTI
1. Kuhel WI, Hume CR, Selesnick SH. Cancer of the external auditory canal and temporal bone. Otolaryngol Clin North Am 1996;29:827–852
2. Prasad S, Janecka IP. Efficacy of surgical treatment for squamous cell carcinoma of the temporal bone: a literature review. Otolaryngol Head Neck Surg 1994;110:270–280
3. Moody SA, Hirsch BE, Myers EN. Squamous cell carcinoma of the external auditory canal: an evaluation of a staging system. Am J Otol 2000;21:582–588
4. Lewis JS. Squamous carcinoma of the ear. Arch Otolaryngol 1973;97:41–42
5. Arena S, Keen M. Carcinoma of the middle ear and temporal bone. Am J Otol 1988;9:351–356
6. Michaels L, Wells M. Squamous carcinoma of the middle ear. Clin Otolaryngol 1980;5:235–248
7. Sasaki CT. Distant metastases from ear and temporal bone cancer. ORL J Otorhinolaryngol Relat Spec 2001;63:250– 251
8. Phelps PD, Lloyd GAS. The radiology of carcinoma of the ear. Br J Radiol 1981;54:103–109
9. Friedman DP, Rao VM. MR and CT of squamous cell carcinoma of the middle ear and mastoid complex. AJNR Am J Neuroradiol 1991;
12:872–874 10. Nyrop M, Grontved A. Cancer of the external auditory canal. Arch Otolaryngol Head Neck Surg 2002;128:834– 837
11. Arriaga M, Curtin H, Takahashi H, Hirsch BE, Kamerer DB. Staging proposal for external auditory meatus carcinoma based on preoperative clinical examination and computed tomography findings. Ann Otol Rhinol Laryngol 1990;99:714–721
12. Gillespie MB, Francis HW, Chee N, Eisele DW. Squamous cell carcinoma of the temporal bone: a radiographic-pathologic correlation. Arch Otolaryngol Head Neck Surg 2001;127:803–807
13. Austin JR, Stewart KL, Fawzi N. Squamous cell carcinoma of the external auditory canal: therapeutic prognosis based on a proposed staging system. Arch Otolaryngol Head Neck Surg 1994;120:1228–1232
14. Zhang B, Tu G, Tang P, Hu Y. Squamous cell carcinoma of the temporal bone: reported on 33 patients. Head Neck 1999;21:461–466
15. Moffat DA, Grey P, Ballagh RH, Hardy DG. Extended temporal bone resection for squamous cell carcinoma. Otolaryngol Head Neck Surg 1997;116:617–623
16. Sinha PP, Aziz HI. Treatment of carcinoma of the middle ear. Radiology 1978;126:485–487
17. Birzgalis AR, Keith AO, Farrington WT. Radiotherapy in the treatment of middle ear and mastoid carcinoma. Clin Otolaryngol 1992;17:113–116
18. House JW, Brackmann DE. Facial nerve grading system. Otolaryngol Head Neck Surg 1985;93:146–147 19. Pensak ML, Gleich LL, Gluckman JL, Shumrick KA. Temporal bone carcinoma: contemporary perspectives in the skull base surgical era. Laryngoscope 1996;106:1234– 1237
20. The American Society for Head and Neck Surgery and The Society of Head and Neck Surgeons. Clinical practice guidelines for the diagnosis and management of cancer of the head and neck. The American Society for Head and Neck Surgery and the Society of Head and Neck Surgeons; 1996
21. British Association of Otolaryngologists Head and Neck Surgeons. Effective Head and Neck Managament. Third Consensus Document. British Association of Otolaryngologists Head and Neck Surgeons; 2002
Carcinoma a cellule squamose della Osso temporale correlazione radiografico A-patologica
M. Boyd Gillespie, MD; Howard W. Francis, MD; Nelson Chee, MD; David W. Eisele, MD
Arch Otolaryngol Testa Collo Surg. 2001; 127 (7): 803-807. doi: 10-1001 / pubs.Arch Otolaryngol. Testa Collo Surg.-ISSN-0886-4470-127-7-ooa00217.
ABSTRACT | POPOLAZIONE, MATERIALI E METODI | RISULTATI | COMMENTO |CONCLUSIONI | INFORMAZIONI ARTICOLO | RIFERIMENTI
Obiettivo Per valutare l'utilità di un sistema di stadiazione proposto in precedenza per i pazienti con carcinoma a cellule squamose primario dell'osso temporale.
Metodi retrospettiva revisione delle cartelle di 15 pazienti trattati per carcinoma a cellule squamose della dell'osso temporale nel corso di un periodo di 13 anni a un accademico centro di riferimento terziario. Una revisione delle cartelle cliniche e chirurgici, esami radiografici, e rapporti di patologia chirurgica consentito per una valutazione del sistema di stadiazione Università di Pittsburgh. Esito analisi è stata effettuata su 13 pazienti con più di 24 mesi di follow-up.
Risultati radiografica e chirurgica staging patologia secondo il sistema University of Pittsburgh staging correlata in 11 (73%) di 15 casi. Il sistema di stadiazione radiografica era più accurata per ingrandire (T3 / T4) tumori che per piccole (T1 / T2) tumori (83% vs. 67%). Quando confrontato con i pazienti con nessuna evidenza di malattia, deceduti erano più propensi a presentare con otalgia (67% vs 43%), paralisi del nervo facciale (33% vs 0%), e tumori T3 / T4 (100% contro 14%).
Conclusioni messa in scena patologica dal sistema di stadiazione dell'Università di Pittsburgh è strettamente correlata con la prognosi del paziente ed è più sensibile rispetto preoperatoria messa in scena radiografica. La prognosi nel carcinoma a cellule squamose dell'osso temporale è in gran parte determinato dalla estensione della malattia locale al momento della presentazione.
PRIMARIA carcinoma a cellule squamose del canale uditivo esterno e osso temporale è un tumore raro con un'incidenza stimata di 5 casi per milione di abitanti. 1 I migliori metodi di stadiazione del tumore e il trattamento sono ancora oggetto di dibattito. Dati di outcome adeguati sono stati difficili da ottenere dalla letteratura medica a causa del piccolo numero di pazienti con la malattia, la varietà delle classificazioni di sosta utilizzato, incoerenza nei metodi di trattamento e la terminologia, l'inclusione di tumori di varie caratteristiche istopatologiche, povero paziente di follow-up , e la mancanza di studi prospettici randomizzati. 1
L'obiettivo di stadiazione tumorale è quello di raggruppare i pazienti con una simile estensione della malattia prima del trattamento. Un sistema di stadiazione preciso facilita il confronto dei risultati di trattamento per i pazienti con simile gravità della malattia trattata con diverse modalità e istituzioni. Le conclusioni possono essere fatti per quanto riguarda l'efficacia del trattamento e la prognosi della malattia.Attualmente, non esiste un sistema di stadiazione universalmente accettato per tumori dell'osso temporale. 2
Il sistema Università di Pittsburgh stadiazione per il carcinoma a cellule squamose primario del condotto uditivo esterno è stato proposto nel 1990 come un sistema semplice, preciso, riproducibile per la classificazione della malattia prima del trattamento. 3 A causa della rarità del tumore, la messa in comune dei dati di più gli enti che utilizzano lo stesso schema di classificazione del tumore è stato sostenuto. 3Diversi studi hanno da allora affermato l'utilità del sistema di stadiazione Università di Pittsburgh. 4 - 6
Il presente studio esamina il trattamento e l'esito di 15 pazienti con carcinoma a cellule squamose primario dell'osso temporale trattati presso la Johns Hopkins Hospital, la Facoltà di Medicina, Baltimore, Md Johns Hopkins University, nel corso di un periodo di 13 anni. L'obiettivo della revisione è quello di valutare l'utilità del sistema di stadiazione Università di Pittsburgh, per identificare i fattori paziente e del tumore che possono avere significato prognostico, e di riferire la nostra esperienza con questo raro tumore maligno aggressivo.
POPOLAZIONE, Materiali E Metodi
ABSTRACT | POPOLAZIONE, MATERIALI E METODI | RISULTATI | COMMENTO |CONCLUSIONI | INFORMAZIONI ARTICOLO | RIFERIMENTI
I record medici e chirurgici di 15 pazienti con carcinoma a cellule squamose primario dell'osso temporale trattati presso il Johns Hopkins Hospital dal 1 ° gennaio 1986 fino al 31 dicembre 1998 sono stati rivisti.L'ospedale patologia chirurgica banca dati è stato cercato di identificare i pazienti con una diagnosi di carcinoma dell'osso temporale. Per essere inclusi nello studio, i pazienti dovevano (1) avere un carcinoma primario a cellule squamose originari ai dell'osso temporale, e (2) sono stati sottoposti a tomografia computerizzata (TC) imaging e la resezione chirurgica primario presso il nostro istituto. Quindici pazienti sono stati identificati che hanno incontrato questi criteri. Informazioni cliniche su questi pazienti è stato ottenuto da una revisione delle classifiche ospedalieri e ambulatoriali e la cartella clinica elettronica, che comprendeva i rapporti di radiologia, note operative, rapporti di patologia, di dimissione e ambulatoriali esami di follow-up clinici. I fattori valutati inclusi dati anagrafici del paziente, sintomi di presentazione, i risultati dell'esame fisico, reperti radiografici, il trattamento chirurgico, metodo di ricostruzione, complicanze chirurgiche, alterazioni anatomopatologiche, e l'uso della radioterapia postoperatoria.
Tre tipi di resezione chirurgica sono state eseguite in questa serie. La resezione locale è definito come qualsiasi resezione meno di un blocco di resezione laterale dell'osso temporale, tra cui la resezione della pelle canale esterno e modificate o mastoidectomia radicale. Laterale resezione ossea temporale consisteva in un formale in blocco rimozione del osseo e cartilagineo canale uditivo esterno, membrana timpanica, martello, incudine e con l'identificazione e la conservazione del nervo facciale lungo il suo segmento verticale. Totale parziale resezione ossea temporale comportato la rimozione dell'osso temporale laterale con resezione aggiuntiva di una porzione della capsula otica con conservazione del petrous dell'arteria carotidea e apice. Nessun totale resezioni ossee temporali sono stati effettuati in questa serie.
I tumori dei 15 pazienti sono stati in scena con il sistema di stadiazione Università di Pittsburgh per il carcinoma a cellule squamose del condotto uditivo esterno, sia sulla base dei risultati preoperatori temporali TC osso e la intraoperatoria e reperti patologici chirurgiche (Tabella 1). Un confronto tra i possibili fattori prognostici è stato eseguito su 13 pazienti con sufficiente follow-up. I pazienti sono stati considerati avere alcuna evidenza di malattia se avessero chiari margini patologiche e nessuna evidenza di recidiva dopo almeno 24 mesi di follow-up.
Tabella 1 Università di Pittsburgh Staging System per carcinoma a cellule squamose dell'osso temporale

Tutti i reparti | Salva tabella | Scarica presentazione (.ppt)
ABSTRACT | POPOLAZIONE, MATERIALI E METODI | RISULTATI | COMMENTO |CONCLUSIONI | INFORMAZIONI ARTICOLO | RIFERIMENTI
Quindici pazienti hanno ricevuto il trattamento per il carcinoma a cellule squamose primario dell'osso temporale al Johns Hopkins Hospital tra il 1986 e il 1998. Il gruppo di studio era costituito da 11 donne e 4 uomini. Età del paziente variava da 48 a 77 anni, con un'età media di 66 anni. I sintomi di presentazione più comuni inclusi otorrea (11 [73%]), otalgia (8 [53%]), e la perdita di udito (5 [33%]). Meno comunemente, il paziente ha presentato con paralisi facciale (2 [13%]) o vertigini (1 [7%]).
Tutti i pazienti sono stati sottoposti ad alta risoluzione (1,5 mm) TAC dell'osso temporale prima del trattamento. Sulla base dell'interpretazione radiografica, nella misura massima della malattia è ritenuto essere il canale esterno uditivo in 8 (53%) dei 15 pazienti, mastoide in 5 (33%), e l'orecchio medio e capsula otica in 1 paziente (7%) ciascuna. Dieci pazienti (66%) hanno dimostrato evidenza di erosione ossea condotto uditivo esterno. Due pazienti (13%) avevano clinicamente sospetti linfoadenopatia cervicale.
Il rapporto CT osso temporale è stato utilizzato per determinare la fase preoperatoria utilizzando il sistema Università di Pittsburgh stadiazione per il carcinoma a cellule squamose del canale uditivo esterno (Tabella2). Messa in scena finale è stata determinata dai risultati intraoperatori e la relazione finale patologia chirurgica. La messa in scena radiografica preoperatoria e la messa in scena patologica finale correlata in 11 (73%) dei 15 casi. Messa in scena radiografico ha provocato sottostima della fase in 2 casi e sovrastima della fase in 2 casi (Tabella 3). Staging radiografica correlata con stadiazione patologica più spesso per i tumori T3 e T4 che per tumori T1 e T2 (86% vs. 63%) (Figura 1). Tre pazienti con malattia T4 come diagnosticato dal CT contrast-enhanced stati sottoposti a risonanza magnetica per immagini (MRI) dell'osso temporale. I risultati della risonanza magnetica non ha alterato la stadiazione preoperatoria;tuttavia, essi si sono offerti ulteriori informazioni sulla portata dei tessuti molli del tumore. La risonanza magnetica ha dimostrato miglioramento durale in 2 pazienti e il coinvolgimento parotide in 1 paziente non visualizzato sul CT.
Tabella 2 Riassunto clinici nei pazienti con carcinoma a cellule squamose della Osso temporale *

Tutti i reparti | Salva tabella | Scarica presentazione (.ppt)
Tabella 3 pazienti rimontato da risultati patologiche chirurgici e finali

Tutti i reparti | Salva tabella | Scarica presentazione (.ppt)
Assiale (A) e coronale (B) calcolata scansioni tomografiche della dell'osso temporale in un paziente con carcinoma a cellule squamose della sinistra canale uditivo esterno. La malattia è stata allestita come T1 mediante radiografia, ma i risultati finali patologici chirurgiche ha dimostrato di essere T2 con l'erosione ossea.

Tutti i reparti | Salva Figura | Scarica presentazione (.ppt)
Tutti i 15 pazienti sono stati sottoposti a resezione chirurgica con intento curativo (Tabella 2). Le procedure chirurgiche incluse resezioni locali a 3 (20%) dei 15 pazienti, laterale resezione ossea temporale in 8 (53%), e subtotale resezione ossea temporale 4 (27%). Il nervo facciale è stato asportato a 6 (40%) di 15 procedure nel tentativo di ottenere margini negativi. Undici pazienti (73%) hanno ricevuto o parotidectomia superficiale o totale. Spread Parotid stato sospettato in 1 paziente sulla base di scansione preoperatoria, ma è stato trovato in 2 (18%) di 11 campioni parotide. Modificato dissezioni del collo radicali sono stati eseguiti in 6 (40%) casi con 2 (13%) esemplari dimostrando diffusione linfatica. Radiografia preoperatoria in entrambi i casi di metastasi cervicali aveva suggerito malattia collo. In 10 pazienti (67%), la ferita chirurgica è stata chiusa in via principale, 2 (13%) sono stati sottoposti innesto cutaneo, e il 3 (20%) richiesto lembi compositi o regionali o distali per ottenere la chiusura della ferita. Due di questi pazienti avevano un lembo muscolo temporale locale, mentre 1 ha ricevuto un gran dorsale lembo libero.
Complicanze chirurgiche si sono verificati in 3 pazienti (20%). Un paziente ha avuto deiscenza di un lembo muscolo regionale, che guarita con la cura delle ferite locali da solo. Un paziente ha sperimentato grave trisma dopo la resezione del condilo mandibolare. Paralisi permanente dei rami frontali e zigomatico del nervo facciale si è verificato inaspettatamente in 1 paziente che aveva subito parotidectomia totale come parte della resezione primaria.
Nove pazienti (60%) hanno ricevuto terapia radiante postoperatoria, che è stato somministrato a pazienti con tumori di grandi dimensioni (T3 / T4), vicino (<1 mm) o margini positivi, un ampio coinvolgimento dei tessuti molli, o coinvolgimento linfonodale regionale. La dose media di radiazioni erano 6000 terapia rad (60 Gy) al sito primario e 4500 rad (45 Gy) al collo omolaterale.
Un confronto multifattoriale di potenziali fattori prognostici è stato eseguito su 13 pazienti che erano entrambi morti di malattie o hanno avuto alcuna evidenza di malattia dopo 24 mesi di follow-up (Tabella 4).Due pazienti sono stati esclusi dall'analisi a causa di un insufficiente follow-up. Esito paziente era largamente dipendente dal grado della malattia locale, che si riflette nella gravità dei sintomi presentati, la fase del tumore primario, e l'estensione della resezione chirurgica.
Tabella 4 Confronto dei fattori prognostici per Outcome Group *

Tutti i reparti | Salva tabella | Scarica presentazione (.ppt)
ABSTRACT | POPOLAZIONE, MATERIALI E METODI | RISULTATI | COMMENTO |CONCLUSIONI | INFORMAZIONI ARTICOLO | RIFERIMENTI
Carcinoma a cellule squamose primario dell'osso temporale è un tumore raro, senza un sistema di stadiazione universalmente accettato. 2 Arriaga e altri 3 ha cercato di affrontare questo problema con l'introduzione del sistema di stadiazione Università di Pittsburgh TNM per il carcinoma a cellule squamose del canale uditivo esterno nel 1990. Il sistema di stadiazione è limitata a un solo tipo di tumore e posizione anatomica per evitare la confusione che si verifica quando i tumori di varie caratteristiche e posizioni anatomopatologiche sono ammassati insieme sotto un regime di messa in scena singola. Quando i risultati clinici sono stati confrontati con i risultati istopatologici nei campioni chirurgici di 39 pazienti, si è constatato che l'estensione della malattia locale strettamente correlato con l'outcome dei pazienti. Il sistema di stadiazione TNM che è emerso da queste osservazioni riflette un 100% di 2 anni di sopravvivenza per i pazienti con tumori T1 e T2, 50% nei pazienti con tumori T3, e il 15% nel gruppo T4.
La correlazione istopatologica-clinica del sistema di stadiazione Università di Pittsburgh è stato sostenuto negli studi recenti. 4 - 6 In uno studio di 33 pazienti con carcinoma a cellule squamose della dell'osso temporale, Zhang ed altri 6 trovato una sopravvivenza a 5 anni del 100% nel gruppo T1 / T2, una sopravvivenza del 69% nei pazienti con tumori T3, e il 20% di sopravvivenza nel gruppo T4. Nel nostro studio, un gruppo di pazienti con tumori T1 e T2 ha sopravvivenza del 100% nel corso del periodo di studio (follow-up medio di 54 mesi), mentre c'era un tasso di sopravvivenza del 25% e lo 0% in pazienti con tumori T3 e T4, rispettivamente, . Il sistema di stadiazione Università di Pittsburgh è quindi coerente nella sua previsione del tasso di sopravvivenza tra i pazienti con una simile estensione della malattia.
Un ulteriore punto di forza del sistema di stadiazione Università di Pittsburgh è la sua capacità di mettere in scena malattia in pazienti prima di un intervento chirurgico utilizzando TC preoperatoria dell'osso temporale. Scansioni ad alta risoluzione CT dell'osso temporale possono facilmente rilevare l'erosione del canale esterno osseo, che è spesso il primo segno di diffusione locale della malattia. 2, 3 In uno studio in cieco di 13 pazienti con carcinoma a cellule squamose del canale uditivo esterno , Arriaga et al 3 trovato che intrepretation di un preoperatoria CT dell'osso temporale correlata istopatologici chirurgiche in 94 dei 96 siti anatomici rispetto, per una precisione complessiva del 98%. In un caso, CT non ha rilevato la diffusione del tumore attraverso la parete del canale anteriore avvenuta senza erosione ossea. Nell'altro caso, infiammazione della mucosa dell'orecchio medio fu falsamente interpretata come tumore. Arriaga e altri 3ha concluso che preoperatori scansioni ad alta risoluzione CT dell'osso temporale riflettono esattamente l'estensione della malattia e possono quindi essere utilizzati per la stadiazione preoperatoria e la pianificazione di un blocco di resezione dell'osso temporale. E 'stato anche suggerito che la risonanza magnetica può essere un complemento utile per determinare l'entità dei tessuti molli della malattia. 3
L'incapacità dei risultati di scansione TC per prevedere l'entità dei tessuti molli anteriore del tumore è stato osservato in altri studi. 7, 8 tumore può diffondersi anteriormente attraverso le fessure cartilaginee su Santorini e forame ossee Huschke senza evidenza di ossea canale erosione. 2 Leonetti et al 5 recensione l'accuratezza di prevedere l'estensione del tumore mediante radiografici in 17 pazienti con T3 / T4 carcinoma a cellule squamose dell'osso temporale che aveva subito sia per la scansione TC e RM. In un comparatore per sito con reperti intraoperatori, CT e MRI avevano una precisione complessiva del 85%. La malattia è stata più frequentemente sottovalutata nella fossa infratemporale, la cavità mastoide, e il canale carotideo. 5 A causa di preoccupazione per la diffusione anteriore del tumore attraverso percorsi preformati, Leonetti et al 5ordinariamente svolgono parotidectomia superficiale al momento della resezione dell'osso temporale e parotidectomia totale nei casi in cui il canale osseo è stata violata.
Nel presente studio, 11 dei 15 pazienti sono stati correttamente in scena da radiografia preoperatoria per una precisione messa in scena complessiva del 73%. Questa percentuale è più bassa rispetto ai precedenti studi, perché solo la fase patologica era considerato, e un comparatore per sito tra interpretazione radiografica e reperti intraoperatori o istopatologici non è stata intrapresa. Utilizzando solo CT dell'osso temporale, abbiamo sottovalutato la portata anteriore della malattia in un caso e aveva difficoltà a distinguere tumore infiammazione in un altro. Il sistema di stadiazione radiografico sembrava essere più precisi per i più grandi (T3 / T4) i tumori che per i più piccoli (T1 / T2) tumori (83% vs 67%), in cui i cambiamenti ossee sottili possono essere male interpretate.
En bloc resezione chirurgica dell'osso temporale è rimasto il trattamento preferito per il carcinoma dell'osso temporale dal totale parziale resezione è stata riportata da Parsons e Lewis 9 e la resezione ossea laterotemporal da Conley e Novack. 10 completa resezione del tumore, l'obiettivo primario di questi en bloctecniche, è un forte fattore determinante per la sopravvivenza, come dimostrato nella nostra serie paziente.In questo studio, il 78% dei pazienti con margini negativi al momento dell'intervento erano sopravvissuti malattia rispetto allo 0% dei pazienti con margini positivi. Tre dei nostri pazienti con margini positivi avevano coinvolgimento durale che non poteva essere completamente asportato da una resezione dell'osso temporale subtotale. Un ulteriore paziente ha subito un debridement limitata quando il carcinoma è stato trovato sulla carotide. Quando seguito da irradiazione postoperatoria, resezione frammentario di tutto tumore visibile oltre i margini di resezione subtotale è una valida alternativa alla totale rimozione di osso temporale e ha mostrato qualche beneficio nella malattia avanzata. 6 Zhang ed altri sei trovato 69% e il 20% 5 sopravvivenza year per T3 e T4 malattie, rispettivamente, in pazienti trattati con la tecnica frammentario.Totale resezione ossea temporale con carotide sacrificio non viene eseguita di routine presso il nostro istituto a causa del maggior rischio di morbilità e nessun beneficio provata sopravvivenza. In una meta-analisi di 26 studi condotti su pazienti con carcinoma a cellule squamose dell'osso temporale, Prasad e Janecka 1 trovati 0% ad 1 anno la sopravvivenza in 4 pazienti che erano stati sottoposti a resezione totale dell'osso temporale.Quando sono stati considerati specifici siti anatomici, pazienti con coinvolgimento durale avevano l'11% di sopravvivenza a 5 anni, mentre quelli con apice petroso, il cervello, e il coinvolgimento carotide era 0% 2 anni di sopravvivenza. 1 E 'stato anche osservato che molti pazienti con squamoso carcinoma a cellule dell'osso temporale sono anziani ea rischio di morire di malattie intercorrenti. 11
Recenti studi, tuttavia, hanno dimostrato un miglioramento della sopravvivenza nei pazienti che sono stati sottoposti a resezione totale dell'osso temporale. 5, 12 Nella serie da Moffat ed altri 12 7 (47%) dei 15 pazienti con T3 / T4 carcinoma a cellule squamose dell'osso temporale sopravvissuto 5 anni dopo in blocco totale resezione dell'osso temporale con la conservazione carotide. Due dei 7 pazienti avevano coinvolgimento cerebrale al momento dell'intervento. Moffat ed altri 12 sostengono che migliorare le metodologie di base del cranio, radiologia interventistica, e la ricostruzione lembo hanno portato ad un miglioramento della sopravvivenza con morbilità ridotta. Inoltre, sottolineano i benefici palliative di resezione totale dell'osso temporale, tra cui una diminuzione del dolore e una migliore igiene.
Le conclusioni di questo studio sono limitati dal piccolo numero di pazienti coinvolti. I risultati dello studio, però, sono d'accordo con diversi studi recenti sulla precisione del sistema dell'Università di Pittsburgh stadiazione per il carcinoma a cellule squamose della dell'osso temporale. 6, 13 Uno studio multi-istituzione è necessaria per chiarire il trattamento ottimale per i pazienti con cellule squamose carcinoma dell'osso temporale.
ABSTRACT | POPOLAZIONE, MATERIALI E METODI | RISULTATI | COMMENTO |CONCLUSIONI | INFORMAZIONI ARTICOLO | RIFERIMENTI
Il sistema di stadiazione Università di Pittsburgh rappresenta un sistema di stadiazione accettabile per il carcinoma a cellule squamose primario dell'osso temporale, con ottima correlazione tra stadio patologico e l'esito del paziente. Anche se preoperatoria messa in scena radiografica è relativamente insensibile, l'estensione del tumore può essere meglio determinato quando sia TC e RM dell'osso temporale vengono eseguiti. Il chirurgo, però, deve avere familiarità con i percorsi comuni di diffusione del tumore, che possono essere perse all'imaging preoperatorio.
ABSTRACT | POPOLAZIONE, MATERIALI E METODI | RISULTATI | COMMENTO |CONCLUSIONI | INFORMAZIONI ARTICOLO | RIFERIMENTI
Accettato per la pubblicazione 17 MARZO 2001.
Presentato in occasione della riunione annuale della testa e del collo americano Society, Quinta conferenza internazionale sulla testa e del collo Cancro, San Francisco, California, 31 luglio 2000.
Autore corrispondente e ristampe: Howard W. Francis, MD, Dipartimento di otorinolaringoiatria-Chirurgia Cervico Facciale, La Scuola di Medicina dell'Università John Hopkins, 6 ° piano JHOC, 601 N Caroline St, Baltimore, MD 21287 (e-mail: Questo indirizzo email è protetto dagli spambots. È necessario abilitare JavaScript per vederlo..edu).
REFERENCES
ABSTRACT | POPULATION, MATERIALS, AND METHODS | RESULTS | COMMENT |CONCLUSIONS | ARTICLE INFORMATION | REFERENCES
Prasad SJanecka IP Efficacy of surgical treatments for squamous cell carcinoma of the temporal bone: a literature review. Otolaryngol Head Neck Surg.1994;110:270-280.
Kuhel WIHume CRSelesnick SH Cancer of the external auditory canal and temporal bone. Otolaryngol Clin North Am.1996;29:827-852.
Arriaga MCurtin HTakahashi HHirsh BEKamerer DB Staging proposal for external auditory meatus carcinoma based on preoperative clinical examination and computed tomography findings. Ann Otol Rhinol Laryngol.1990;99:714-721.
Austin JRStewart KLFawzi N Squamous cell carcinoma of the external auditory canal. Arch Otolaryngol Head Neck Surg.1994;120:1228-1232.
Leonetti JPSmith PGKletzker GRIzquierdo R Invasion patterns of advanced temporal bone malignancies. Am J Otol.1996;17:438-442.
Zhang BTu GXu GTang PHu Y Squamous cell carcinoma of the temporal bone: reported on 33 patients. Head Neck.1999;21:461-466.
Arriaga MCurtin HDTakahashi HKamerer DB The role of preoperative CT scans in staging external auditory meatus carcinoma: radiologic-pathologic correlation study. Otolaryngol Head Neck Surg.1991;105:6-11.
Shih LCrabtree JA Carcinoma of the external auditory canal: an update. Laryngoscope.1990;100:1215-1218.
Parsons HLewis JS Subtotal resection of the temporal bone for cancer of the ear. Cancer.1954;7:995-1001.
Conley JJNovack AJ The surgical treatment of tumors of the ear and temporal bone. Arch Otolaryngol.1960;71:635-652.
Pensak MLGleich LLGluckman JLShumrick KA Temporal bone carcinoma: contemporary perspectives in the skull base surgical era. Laryngoscope.1996;106:1234-1237.
Moffat DAGrey PBallagh RHHardy DG Extended temporal bone resection for squamous cell carcinoma. Otolaryngol Head Neck Surg.1997;116:617-623.
Moody SAHirsch BEMeyers EN Squamous cell carcinoma of the external auditory canal: an evaluation of a staging system. Am J Otol.2000;21:582-588.