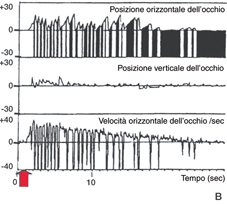
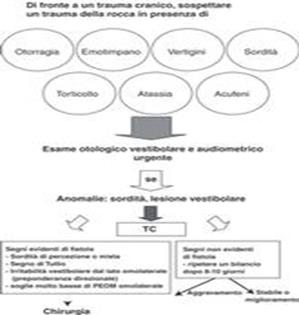
Vertigine nell'infanzia
- Categoria: Vertigine nell'infanzia
- Pubblicato: Lunedì, 27 Febbraio 2017 20:56
- Visite: 71934
Vertigini dell’infanzia -Vertigini del Bambino
Parole chiave : Vertigini, Vertigine benigna parossistica, Disturbo di vergenza, Problemi oculari, Equilibrio, Neurite, Labirintite, Frattura della rocca
Riassunto
Breve rassegna Letteratura
Fasi di Sviluppo del Sistema Vestibolare
Epidemiologia
· Il sintomo: vertigine
Che cos’è che la vertigine?
Donde vengono le sensazioni di movimento e la sensazione
Disfunzione di uno o più recettori sensoriali di movimento
Disfunzione delle strutture centrali che partecipano all'analisi e all'integrazione dei movimenti e delle posizioni del corpo
Segni e Sintomi
Cause di Disfunzione Vestibolare
· Esame clinico oto-neuro-vestibolare del bambino con vertigini 2
Anamnesi
Esame vestibolare clinico di base
Esame neurologico clinico
Esame oftalmologico
· Esami vestibolari
Test della funzione canalare
Test della funzione otolitica
Quali sono le cause di vertigine nel bambino?
Vertigine parossistica benigna del bambino
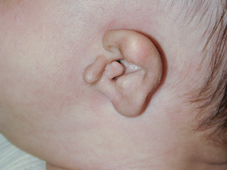
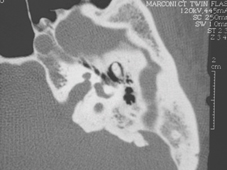
Malformazione dell'orecchio interno
Riassunto
Le vertigini e i disturbi dell'equilibrio del bambino, quando sono riconosciuti, allarmano i medici e le famiglie e conducono con troppa frequenza a indagini inutili e costose ancor prima di un buon esame clinico oto-neuro-vestibolare. Per la redazione di questo capitolo si sono utilizzati i risultati di uno studio condotto per 14 anni su più di 2.000 pazienti inviati per vertigini o disturbi dell'equilibrio all'unità di esplorazioni funzionali vestibolari del reparto di otorinolaringoiatria pediatrica dell'ospedale Robert Debré (Parigi). In questa sede verranno trattati i principali segni che evocano un disturbo dell'apparato dell'equilibrio nonché le principali eziologie riscontrate nel bambino (equivalenti emicranici, disturbi oftalmologici, vertigine parossistica benigna del bambino e trauma). Ciò ha permesso di definire la migliore condotta diagnostica e terapeutica da tenere di fronte a una vertigine del bambino.
La sensazione vertiginosa, ovvero l'informazione erronea di movimento, può essere dovuta, nel bambino come nell'adulto, a un'anomalia del funzionamento dei tre grandi sistemi sensoriali che forniscono questa informazione, vale a dire il sistema visivo, il sistema vestibolare e il sistema propriocettivo-somestesico.
La vertigine rappresenta, in età pediatrica, un sintomo di difficile valutazione in quanto il piccolo bambino non riesce a distinguere la vera vertigine da fenomeni di paura e da stati di tipo confusionale( Ottoboni A. e coll 1982) .
La difficoltà di descrivere il sintomo in maniera particolareggiata rende quasi impossibile una ricostruzione dettagliata di una storia clinica che possa obiettivare la sintomatologia (Choung YH e Coll.,2003; Fried MP.,2003).
La mancata diagnosi e l’assenza di un adeguato trattamento determinano l’insorgenza di problematiche altamente invalidanti per il bambino( Ravid S. e coll.,2003; Medeiros IR.,2003).
Il ripetersi delle crisi vertiginose o il perdurare della sensazione di disequilibrio, se non attentamente valutate, possono provocare nel bambino un grave scadimento delle attività quotidiane: gravi conseguenze psicofisiche (isolamento, disturbi del sonno), compromissione della vita di relazione e dello sviluppo psico-fisico (Medeiros IR.,2003).
La vertigine nel bambino, quando è riconosciuta, è un sintomo che getta nel panico in generale le famiglie e i medici. Le vertigini e i disturbi dell'equilibrio conducono allora spesso a un eccesso di prescrizione di esplorazioni funzionali inutili e costose (risonanza magnetica [RM], TC) senza contribuire a una gestione terapeutica adeguata. Ciò è dovuto in gran parte all'ansietà proveniente dall'equivocare una condotta diagnostica chiara, che ha lo scopo di non mancare la diagnosi di «tumore della fossa posteriore», diagnosi molto temuta e, in realtà, rara (meno dell'1% delle vertigini del bambino). Davanti alle d vertigini el bambino, cosa si deve fare? Questa è una domanda importante.
Le sensazioni vertiginose sono un sintomo che non è facile da riconoscere nel bambino e molti medici ritengono che siano rare. L'incidenza delle vertigini è in effetti sottostimata per diverse ragioni:
• uno scarso riconoscimento del sintomo: la vertigini può passare inosservata nei bambini molto piccoli che non possono descrivere la loro sensazione vertiginosa e in cui sono solamente evidenti i segni associati alle vertigini (atassia, vomito, pallore, dolori addominali), il che orienta il medico verso patologie intestinali (gastroenteriti per esempio) o neurologiche (tumori della fossa posteriore) e non lo porta a effettuare gli esami adeguati;
• un mancato riconoscimento delle diverse cause di vertigine e della loro frequenza è legato a una scarsa conoscenza del sistema vestibolare e della sua importanza nel controllo posturale e motorio del bambino. Questo è anche conseguenza del fatto che per lungo tempo non sono stati disponibili test, adatti ai bambini piccoli, per esplorare la funzione vestibolare nel suo insieme;
• l'assenza di un'attitudine diagnostica coerente che tenga conto della frequenza di ogni patologia pediatrica che si esprime attraverso le vertigini in funzione dell'età, e la scarsa conoscenza di esami clinici semplici che permettono di orientare la diagnosi e dei rischi e costi dei differenti esami richiesti. Ciò ha lasciato e lascia ancora una gran numero di vertigini del bambino senza alcuna diagnosi eziologica precisa e senza trattamento adatto.
Questo testo tenterà quindi di dare una risposta quanto più precisa e concreta possibile a queste domande.
Rassegna della letteratura
Gli effetti della maturazione delle risposte per-rotatoria nei bambini sono stati particolarmente studiati nel 1970 (Eviatar, Eviatar, e Naray, 1974; Eviatar, Miranda, Eviatar, Freeman, e Borkowski, 1978). Sebbene i neonati a termine dimostrano una forte risposta nistagmica , le risposte sembrano essere comparabili di nove mesi di età. Gli effetti dell'età sul riflesso vestibolo-oculare (VOR) a seguito di irrigazione calorica è stata studiata anche da numerosi ricercatori con risultati variabili. Van der Laan e Oosterveld (1974) hanno trovato nei bambini rispetto agli adulti: una frequenza della risposta nistagmica meno intensa, ma con ampiezze superiori con,. Krejčová e colleghi (1975), tuttavia, al contrario hanno riferito che i bambini mostrano una frequenza di battiti maggiore rispetto agli adulti. Andrieu-Guitrancourt et al. (1981) hanno scoperto che la frequenza dei battiti aumenta man mano che il bambino matura, mentre la velocità massima dell'occhio diminuisce. In alcuni studi si è trovato che le misure di velocità ed ampiezza degli occhi sono più intense nei bambini rispetto a adolescenti (Ornitz, et al., 1979) mentre altri ricercatori hanno osservato la risposta più intensa in età adulta (Pacciame e Peterman, 1979). Il VOR passa attraverso diverse fasi di sviluppo nella prima infanzia (Donat, Donat, e Swe Lay, 1980) e dovrebbe essere considerato anormale se il VOR è assente dall'età di dieci mesi di età (Fife, et al., 2000). Gli esaminatori di riferimento hanno sottolineato l'importanza di considerare queste differenze di età quando si interpretano i risultati dei test pediatrici (Kenyon, 1988; Levens, 1988).
Occasionalmente, i sintomi vestibolari pediatrici sono legati ad altre patologie, come :autismo, ritardo motorio, difficoltà di apprendimento, e dislessia (Valente ML.2007); Nandi e Luxon,2008 riportano che, le più comuni cause di disfunzione vestibolare nei bambini sono: emicrania, otite media, e traumi, e hanno notato circa il 30% e il 40% delle persone sorde hanno sistemi vestibolari inusuali. Szirmai,2010, ha valutato 145 pazienti vertiginosi fino a 18 anni e ha concluso che quasi due terzi di loro hanno dimostrato anomalie vestibolari. Le cause più comuni di vertigini riportate da Szirmai inclusi disturbi "extra-vestibolare" come la malattia di panico e disturbo d'ansia. Tuttavia, per i pazienti più giovani, i sintomi vestibolari sono stati più spesso causati dall’ emicrania.
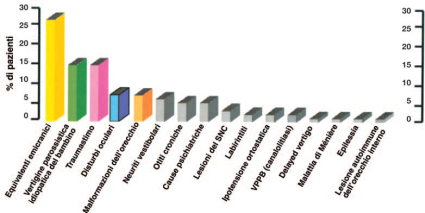
Wiener-Vacher,2008, riferisce che circa 2.000 bambini di età superiore ai 14 anni, sono stati esaminati per problemi di equilibrio e vertigini. Nel suo studio, il 20% dei bambini profondamente sordi ha avuto una perdita vestibolare bilaterale completa, il 40% ha avuto una perdita vestibolare bilaterale parziale o asimmetrica, e il 40% aveva una normale funzione vestibolare bilaterale. Wiener-Vacher nei bambini valutati per i disturbi vertiginosi ha effettuato le seguente diagnosi (elencati in ordine di prevalenza):
1) equivalenti emicranici: il 25% dei bambini ha avuto mal di testa che hanno preceduto, accompagnato, o alternati con le vertigini.
2) Vertigine parossistica benigna dell'infanzia: il 20% dei bambini (con l'accento sulla i 2 ei 3 anni) ha riferito breve vertigini (meno di 10 minuti), senza mal di testa.
3) trauma cranico: il 10% dei bambini valutati segnalato vertigini post-trauma cranico. Questi disturbi possono essere indicativi di frattura dell'osso temporale o una fistola perilinfa.
4) Mondini (e altre) malformazioni dell'orecchio interno: Circa il 10% dei bambini della serie avevano malformazioni. È interessante notare che, nella sindrome CHARGE, Wiener-Vacher riporta quasi il 100% dei bambini ha avuto canali semicircolari assenti.
5) Disturbi oftalmici: Circa il 10% di tutti i bambini di cui ha avuto problemi visivi.
6) neurite vestibolare: Si è verificato in circa il 5% dei bambini.
7) tumori della fossa posteriore: si è verificato in meno dell'1% di tutti i bambini di cui.
8) Varie: Rarissimo erano casi che coinvolgevano l'origine psichiatrica, ipotensione ortostatica, epilettico, auto-immune, Vertigine parossistica posizionale benigna (VPPB), la malattia di Meniere, idrope endolinfatica ritardato, ecc. (Wiener-Vacher SR.2008).
Pertanto, l'analisi delle questioni vestibolari e dell’equilibrio nei bambini è molto importante per i genitori, il bambino, l'audiologo, e il medico.
Fasi di Sviluppo del Sistema Vestibolare
LO SVILUPPO DELLA FUNZIONE VESTIBOLARE
Nel genere umano il vestibolo si forma tra la ottava e la sedicesima settimana
di gestazione (Caston J. e coll .,1986), mentre i nuclei vestibolari
sono completi attorno alla ventesima
La capacità di movimento e di capovolgimento del feto parrebbero essere un segno di funzionalità del sistema otolitico già nella vita intrauterina. Alcuni Autori ( Woollacott M.H ,1988) ritengono invece che essa sia il risultato di riflessi propriocettivi e che la reattività vestibolare stessa sia bloccata per impedire adeguamenti riflessi ad ogni movimento della madre.
Alla nascita le strutture anatomiche labirintiche ed il numero di cellule sensoriali e di fibre del nervo vestibolare sono praticamente già identici a quelli dell’adulto; solo il diametro dei canali semicircolari aumenta durante l’infanzia con conseguente variazione del loro raggio di curvatura.
La
funzione visuo-oculomotoria ha uno sviluppo parzialmente diverso da quella
vestibolo-oculomotoria.
La fovea del neonato è ancora immatura ed i movimenti di inseguimento e di
orientamento dello sguardo sono dismetrici sino ad un anno d’età; il riflesso
otticocinetico rimane asimmetrico sino al quinto mese (Hainline L. e
coll.,1984).
La precocità di sviluppo della funzione vestibolare ha fatto supporre che essa sia fondamentale per la maturazione di altri sistemi sensitivo-motori ( Bolasco P.,1983; Bnl B.e coll.1988; Watson P. Steele GR.,1988) e che condizioni l’acquisizione delle capacità di tenere la testa eretta, mettersi seduti e fare i primi passi.
Queste
attività, a loro volta, paiono facilitare la maturazione del sistema
vestibolare.
I bambini assumono comunque rapidamente un rapporto molto particolare con il
loro apparato vestibolare: si abituano infatti a giocare provocandosi delle
allucinazioni sensoriali mediante stimolazioni labirintiche, spesso anche
prolungate e intense.
Il limite del loro divertimento consiste nella possibilità di conoscere e di controllare ciò che sta avvenendo.
La patologie che provocano disturbi dell’equilibrio e, in particolare, le vertigini rotatorie, riproducono dunque condizioni che il bambino conosce bene ma non riesce più a controllare.
Il superamento di questo limite implica lo stato di sgomento che tipicamente accompagna le vertigini infantili.
Gli organi vestibolari forniscono informazioni sensoriali sulla moto, e l'orientamento spaziale. Gli organi in ciascun orecchio includono l’ utricolo, sacculo, ed i tre canali semicircolari. l’utricolo ed il sacculo rilevano i movimenti(accelerazioni) lineare e di gravità (orientamento verticale) . I canali semicircolari di destra e di sinistra che si trovano ad angolo retto tra loro rilevano i movimenti di rotazione della testa. Quando questi organi su entrambi i lati della testa funzionano correttamente, inviano segnali simmetrici al cervello che sono integrati con altri sistemi sensoriali e motori da sei anni.
Se disfunzione vestibolare si verifica nelle prime fasi di sviluppo, rallenta lo sviluppo di equilibrio e di riflessi protettivi e attività del motore di controllo come seduto supportato, in piedi e camminare. Inoltre, un riflesso vestibolo-oculare ridotta (VOR) da disfunzione vestibolare può avere effetti di vasta portata sulla capacità del bambino di tenere il passo con i compiti scolastici. Il VOR è responsabile del mantenimento chiara visione durante i movimenti della testa rapidi. Visione stabile è importante per imparare a leggere e scrivere e per lo sviluppo di controllo motorio fine e grossolano. Se non trattata, un disturbo vestibolare può avere conseguenze negative per una serie di funzioni come il bambino cresce fino all'età adulta.
In letteratura scientifica esiste grande variabilità dei dati di incidenza, prevalenza, presentazione clinica, eziologia, approccio diagnostico e terapeutico delle vertigini in età pediatrica. Questo è dovuto all'eterogeneità dei campioni presi in esame per numero, caratteristiche dei sintomi e segni clinici, metodiche di valutazione. Nel complesso tuttavia, emerge come il 5-10% dei bimbi presenta almeno un episodio di vertigine prima dei 10 anni, il 10% di questi presenta almeno 1 episodio/anno, nel 51.5% l'intensità della vertigine è tale da bloccare le attività in corso e nel 25/50% dei casi si associa una forma di emicrania 5. Balzanellí et al 2014; Humphriss RL, Hall AJ.2011; Jahn et al.2015; Riina et al.2005. Da una revisione della letteratura recente, si evincono le forme più frequenti di vertigine classificate in base all'eziologia (Tabella I). Si può notare una grande variabilità di prevalenza delle varie forme di vertigine e nella tabella si sono voluti evidenziare i valori riportati in uno studio.,1' condotto su un campione di oltre 2000 pazienti con un follow-up di oltre 14 anni, che sembra pertanto particolarmente rappresentativo Wiener-Vacher SR.2008
|
Emicrania |
11-35.5% (25) |
|
VPI |
3.6-12% (20) |
|
VPP |
12-14.7% |
|
Epilessia |
1.9-6% |
|
Neurite vestibolare |
0,7-14.5 (5) |
|
Disordini metabolici |
2-16.7% |
|
Tumori |
1.9-33% |
|
Fistola perilinfatica |
0.7-16% |
|
Traumi |
3.2-30.1% (10) |
|
Vertigine psicogena |
9.7-12.9% |
|
Miscellanea (Meniere, OME, disturbi visivi..) |
55-38.2% (10) |
|
Cause sconosciute |
10-19.4% - |
Tabella I. Classificazione eziologica delle vertigini in età pediatrica da una revisione degli studi recenti.15,17,22 In parentesi sono indicati valori percentuali di confronto ottenuti da uno studio condotto in 14 anni su oltre 2000 bambini.52
L'emicrania vestibolare è certamente una delle cause più frequenti di vertigine in ambito pediatrico in tutte le fasce d'età, seguita dalla vertigine parossistica infantile, dalla vertigine parossistica posizionale e dal deficit vestibolare acuto (neurite vestibolare) (Tabella I). Una prevalenza importante è costituita dalla vertigine psicogena (circa il 10%, valore che peraltro è probabilmente sottostimato) come anche le vertigini da causa non identificata (10-19.5%) (Tabella I). Non sono trascurabili inoltre i valori riportati in letteratura riguardanti le manifestazioni epilettiche (dal 1.9 al 6%) (Tabella I).
Dalla nostra esperienza su un campione di 163 pazienti osservati dal 1 gennaio 2010 al 31 dicembre 2013 le cause più frequenti di vertigine pediatrica sono state l'emicrania vestibolare (23.3%), il deficit vestibolare acuto (22.7%), la vertigine parossistica da posizionamento (11%), la vertigine psicogena (10.4% casi) e la vertigine parossistica infantile (9.2 %). Abbiamo riscontrato una miscellanea di cause nel rimanente 19.6% dei casi (epilessia, disturbi visivi, disturbi stomatognatici, ipotensione ortostatica, traumi, virosi, Malattia di Meniere), mentre nel 3.7% dei casi tutti gli accertamenti effettuati. sono risultati negativi e la causa della vertigine è rimasta indefinita. La causa più frequente al di sotto dei 7 anni è stata la vertigine parossistica infantile (73.3%), le cause più frequenti nella fascia d'età compresa tra i 7 e i 13 anni sono state il deficit vestibolare acuto e l'emicrania vestibolare (rispettivamente 56.8% e 50% dei casi). La distribuzione nelle varie fasce di età delle altre cause è stata sovrapponibile tranne per quando riguarda la vertigine da ipotensione ortostatica presente quasi esclusivamente nel sesso femminile tra i 14 e i 18 anni (83.3%). A differenza da quanto emerge in letteratura non abbiamo rilevato patologie neurologiche maggiori (ad eccezione di 5 casi dí epilessia). Un altro dato discrepante rispetto alla letteratura è il riscontro di un'elevata percentuale di deficit vestibolare acuto, cosa spiegabile dal fatto che nelle casistiche del passato non sono stati utilizzati strumenti diagnostici combinati quali il vHIT e i VEMPs, con conseguente minore accuratezza diagnostica. Il loro sistematico utilizzo ha consentito di abbattere a meno del 4% la percentuale di vertigine idiopatica nel nostro campione, rispetto a valori spesso superiori al 10% riportati in precedenza,'
Il sintomo: vertigine
La sensazione di vertigine ha origine da una distorsione della sensazione di movimento del corpo nello spazio. Questa distorsione può essere una rotazione (come una giostra) oppure una traslazione (sensazione di caduta di spinta, di basculamento) o semplicemente una sensazione d'instabilità.
Il bambino molto piccolo che non può esprimere ciò che sente si aggrappa ai genitori, chiede di essere portato, rifiuta di mettersi in piedi e si addormenta. Quando il bambino si può esprimere può dire: «la casa gira». Il bambino un poco più grande non ha sempre spontaneamente un vocabolario sufficiente per definire la sua sensazione e si soddisfa molto rapidamente della parola vertigine immediatamente proposta da coloro che lo circondano. Durante l'anamnesi è importante proporre diverse definizioni a un bambino che ha dei disturbi dell'equilibrio, mimarle affinché egli scelga quella che corrisponde maggiormente a ciò che avverte e avvicinarsi così alla diagnosi.
I disturbi dell'equilibrio nel bambino possono tradursi con delle cadute frequenti, un'impossibilità a tenersi in piedi (atassia) o disturbi della deambulazione.
La sensazione di vertigine può essere molto ben sopportata o al contrario associata a nausea, inappetenza, vomito, dolori addominali («mal di pancia»), cefalee e disturbi neurovegetativi (pallore, tachicardia che può arrivare fino al malessere vagale).
Da dove provengono le sensazioni di movimento e la sensazione vertiginosa?
Noi percepiamo il movimento della nostra testa grazie a tre tipi di recettori di movimento: i recettori vestibolari, visivi e somestesici (superficiali e profondi o propriocettivi). I recettori vestibolari sono situati nell'orecchio interno, cavità ossea scavata nella rocca, che ospita anche l'apparato dell'udito. Essi percepiscono i movimenti di rotazione e di traslazione nonché la posizione della testa rispetto alla gravità. I recettori visivi percepiscono i movimenti del nostro corpo nello spazio rispetto a punti di riferimento vicini o lontani. I recettori propriocettivi situati a livello dei tendini, delle articolazioni, della cute percepiscono i movimenti e la posizione delle differenti parti del nostro corpo nonché il loro contatto al suolo (per esempio pianta dei piedi durante la marcia, natiche in posizione seduta)
(Figura 1). 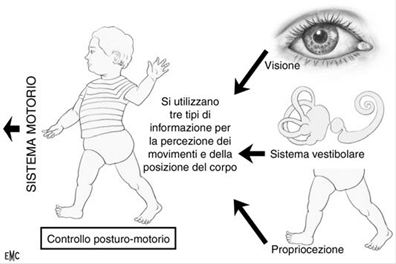
La distorsione percettiva responsabile delle vertigini può avere origine dal cattivo funzionamento di uno o più di questi recettori sensoriali di movimento, ma anche di tutte le strutture centrali partecipano all'analisi e all'integrazione delle informazioni di movimento e di posizione del capo e del corpo.
Disfunzione di uno o più recettori sensoriali di movimento
La sensazione di vertigine può avere origine in primo luogo dal vestibolo e/o dagli occhi e più accessoriamente dai recettori propriocettivi. La disfunzione vestibolare può provocare una sensazione vertiginosa (grande vertigine rotatoria, lateropulsione, caduta, beccheggio) che può essere breve o di diverse ore, legata ai movimenti o aggravata dai movimenti della testa. Vi si associano spesso in fase acuta dei movimenti caratteristici degli occhi: il nistagmo. Il nistagmo è composto da movimenti coniugati dei due occhi che associano una fase lenta seguita da una fase rapida. La fase rapida è importante da riconoscere in clinica perché indica il lato dei recettori vestibolari più attivi (una lesione destra si accompagna per esempio a un nistagmo sinistro di direzione costante). Anche un disturbo visivo può essere responsabile di vertigini , specialmente quando giunge ad alterare la visione binoculare dinamica (visione asimmetrica, disturbi di vergenza). Le vertigini sono allora spesso legate all'eccessivo lavoro visivo (lunghe sedute di videogiochi, al computer, alla televisione, di lettura), comparendo ai movimenti della testa o del solo sguardo, ma una causa visiva non provocherà mai da sola una grande vertigine rotatoria di varie ore, a differenza di un disturbo vestibolare. I disturbi della propriocezione non causano grandi vertigini ,ma sensazioni di instabilità o cadute frequenti.
Disfunzione delle strutture centrali che partecipano all'analisi e all'integrazione dei movimenti e delle posizioni del corpo
Dopo i recettori sensoriali, l'informazione di movimento è integrata a livello del tronco cerebrale e quindi «interpretata» da un numero molto elevato di strutture cerebrali, coinvolte in funzioni cognitive e affettive. Una disfunzione a uno dei livelli di integrazione può provocare una distorsione percettiva. In questo caso la risposta dei recettori può essere normale, legata a una stimolazione periferica reale, ma la sua interpretazione centrale è errata o eccessiva (per esempio cinetosi), oppure la risposta dei recettori è indipendente da ogni stimolazione periferica e generata dai centri stessi (l'esempio tipo di una sensazione vertiginosa puramente centrale è la vertigine da altezza).
Segni e Sintomi
Disturbi vestibolari non sono così facilmente riconoscibili nei bambini in quanto negli adulti, in parte perché i bambini spesso non possono descrivere i loro sintomi bene e possono essere in grado di comprendere i concetti di vertigine e di squilibrio. Identificazione della disfunzione vestibolare pediatrica richiede descrizioni di coordinamento offerti dal bambino, i rapporti dei sintomi da parte dei genitori, e le osservazioni cliniche da parte di professionisti.
I Sintomi e Segni che Possono Indicare una Disfunzione Vestibolare Comprendono:
· Vertigini e acutezza visiva problemi, in particolare con i movimenti della testa come quando si gira a guardare qualcosa
· Scarso relazioni spaziali, a volte rivelate saltando parole o lettere durante la lettura o per avere uno stile di scrittura disorganizzata Wiener-Vacher 2001.
· Nistagmo (involontario, alternato, rapido e movimenti oculari lenti) Wiener-Vacher 2001; Wiener-Vacher et al 1994 .
· Difficoltà a navigare nel buio
· La perdita dell'udito o tinnito (ronzio nelle orecchie)
· Cinetosi o la sensibilità (evita o brama movimento) Wiener-Vacher et al.1996.
· Nausea
· Modelli di circolazione anormale, andatura instabile, goffaggine (compresi diminuzione occhio-mano e la coordinazione occhio-piede), o cattiva postura, compresa una tendenza a cadere, pressione nell’orecchio
· Mal di testa con nausea e / o vertigini e associati
· Sviluppo e riflessi ritardi (Wiener-Vacher S.R.2001) che a volte rivela più lento raggiungimento di pietre miliari come andare in bicicletta, nuotare, saltellando, e salire le scale che coinvolgono movimenti alternati gamba sinistra-destra
Per ogni bambino, la specifica serie di segni e sintomi siano diversi a seconda se il danno è periferico (che coinvolgono gli organi dell'orecchio interno), centrale (che coinvolge il cervello e tronco encefalico), o entrambi. I segni ed i sintomi dipenderanno anche se il danno è unilaterale (su un lato) o bilaterale (che interessano entrambe le orecchie), e se la malattia o infortunio ha causato una perdita completa della funzione, la funzione ridotta (ipofunzione), o aumento della sensibilità ( iperfunzione) Anoh-Tanon et al 2000.
Cause di Disfunzione Vestibolare
L'interconnessione del sistema vestibolare con molti altri sistemi del corpo può provocare disfunzione vestibolare secondaria ad una gamma di condizioni mediche e storie. Storie a volte associata a disfunzione del sistema periferico o centrale comprendono:
Otiti croniche o otite media(Waldron et al.,2004; Casselbrant et al.,2008).
- Sordità Neurosensoriale Congenita (Rine et al.2000;Angeli S.,2003;Braswell et al.,2006;Suarez et al.,2007)
- Citomegalovirus e altre infezioni virali come nella sindrome di Ramsay Hunt (un'infezione dei nervi facciali e cocleovestibolari causata dal virus herpes zoster, lo stesso virus che è associato con la varicella)
- Malformazioni da condizioni acquisite o genetiche come la Sindrome Brachio-Oto-Renale, Displasia di Mondini Tanzariello, la Sindrome di Waardenburg, Anomalie Congenite Base Cranio Tanzariello, disfunzioni uditive e vestibolari non sindromiche
- Altre malattie genetiche come la Sindrome Di Usher di tipo I (con gravi profondi problemi di perdita dell'udito neurosensoriale ,dell'equilibrio e deterioramento della visione dopo i 10 anni) o di tipo III (con equilibrio e la visione dei problemi che appaiono più avanti nella vita), Sindrome di Pendered, Sindrome dell’ Acquedotto Allargato , Sindrome Congenita dell QT Lungo, Sindrome di Charg
- Anossia (ossigeno ridotto alla nascita) o ictus
- Meningite (infiammazione delle membrane che ricoprono il cervello e il midollo spinale, a volte anche le membrane che interessano nell'orecchio interno)
- Disturbi o malattie neurologiche come la paralisi cerebrale, idrocefalo, un tumore al cervello posteriore, o Sindrome di Wallenberg (s. di Wallenberg) (causato da un blocco arteria vertebrale o posteriore, arteria cerebellare inferiore del tronco encefalico), Polisclerosi Tanzariello, epilessia, Vertigine Emicranica Atassia Episodica Tanzariello .
- Varianti o complicazione dell’emicrania: torcicollo spasmodico Tanzariello, vomito ciclico Tanzariello, emicrania dell’arteria basilare, emicrania emiplegica familiare, emicrania addominale, VPPB
- Droga o alcol materno durante la gravidanza (Church et al 1988; Jinkowic et al.,2010)
- Farmaci Ototossici
- Disordini Visivi
- Disordini Sistemici
- Vertigini Psicologiche
- Disturbi da immunodeficienza (Agrup C.,2008; Yukawa et al.2010).
- Malattie metaboliche come il diabete
- Insufficienze vascolari
- Traumi della testa e del collo da incidenti stradali o infortuni sportivi (Gagnon et a.,2004)
- Fistola perilinfatica ,chirurgia da impianti cocleari ,VPPB
|
CAUSE CONGENITE SINDROMICHE |
CAUSE CONGENITE NON SINDROMICHE |
|
— Sindrome di Usher (I tipo, III tipo) — deficit uditivo alla nascita o progressivo di vario grado, deficit visivo progressivo (retinite pigmentosa), possibili disturbi vestibolari più o meno gravi — Sindrome di Pendred — sordità bilaterale, gozzo tiroideo, malformazione coclea-vestibolare — Sindrome di Mondini — possibili anomalie anatomiche delle strutture cocleo-vestibolari — Sindrome di Cogan — sindrome autoimmune, cheratite interstiziale, ipoacusia improvvisa/ progressiva, possibile vestibolopatia improvvisa/ progressiva — CHARGE (Coloboma, Heart defects, choanal Atresia, Retaration of growth and development, Genital abnormalities, Ear abnormalitíes - ipoplasia CS) |
— Enlarged Vestibular Aqueduct Syndrome (EVAS) — Ipoacusia progressiva con "Sindrome della 3a finestra" — CMV — Asintomatico alla nascita. Ipoacusia progressiva fino al 65% dei casi. Alterazioni vestibolari nei casi severi |
Tabella II. Cause congenite di vertigine."-
|
- Antibiotici: chinolonici,aminoglicosidi,macrolidi - Fans: ibuprofene - Mucolitici: carbocicisteina - CHT: cisplatino |
![]() Tabella III. Vertigine da ototossicità farmacologica.
Tabella III. Vertigine da ototossicità farmacologica.
|
Tabella IV. Vertigine da causa internistica.
|
— Sindrome di A-Chiari — Atrofia spino-cerebellare — Cisti aracnoidee fossa post. Tumori APC (NF Il) MAV — MAV — Malattie demielinizzanti — Meningo-encefalopatie — Esiti di trauma cranico — Malattie neuro-degenerative (atassia familiare) — Tumori fossa post. (astrocitoma, medulloblastoma, ependimoma, glioma) — Epilessia |
Tabella V. Vertigine da causa neurologica
Esame Clinico Oto-Neuro-Vestibolare del Bambino con Vertigini
Valutazione del bambino con disturbi dell’equilibrio
Storia / Sintomi Principali
La storia è in genere la chiave per diagnosticare un bambino con un disturbo dell'equilibrio; una storia accurata da sola spesso determina l'eziologia di squilibrio del paziente. Non è insolito per l'esame fisico e test per fornire visione poco supplementare nella diagnosi. lt è meglio alliow prima il paziente e / o il loro tutore per descrivere i loro sintomi in modo aperto con la direzione minimo dal medico. La storia può essere notevolmente facilitata da un questionario approfondito previsita compilato dal paziente e / o dal tutore (vedi Appendice). Il questionario non solo migliora l'efficienza della raccolta dei dati, al momento della visita, ma aiuta anche i genitori ad affinare le loro osservazioni. In genere è meglio che i pazienti e / o i loro tutori abbiano e compilino il questionario nella comodità della propria casa, ben prima della visita clinica. Il questionario può quindi aiutare a guidare l'intervista durante la visita clinica. La storia, una volta completato sia attraverso il questionario e la visita, dovrebbe consentire al medico di avere un la sensazione se i sintomi siano dovuti ad un'eziologia periferica
Considerazione Speciale: La storia è in genere la chiave per diagnosticare un bambino con un disturbo dell'equilibrio.
Una volta che il paziente ha descritto i sui sintomi, la prima distinzione è la differenza tra vertigini e capogiri . il termine Capogiri è spesso ed erroneamente usato per indicare vertigini. Vertigo è la sensazione anormale di movimento interno ,il paziente si sente girare (vertigini soggettive) o movimenti anomali dell’ ambiente esterno, il paziente ha l’impressione che la stanza giri (vertigini oggettive) . La radice della parola è basata sul latino vertere, che significa girare. Non sorprende che, la vertigini è classicamente associata ad una sensazione illusoria di rotazione, ma può anche presente come anomala e oscillazione antero-posteriore o anche un cambiamento di orientamento rispetto alla verticale(Hullar et al.2005) . Vertigini è un termine molto più ampio, non specifico che descrive l’interruzione del proprio orientamento con l'ambiente e include ma non si limita a vertigini, disequilibrio e debolezza.
La pietra angolare della anamnesi è quella di determinare se il bambino sta vivendo vere vertigini e, in caso affermativo, quanto tempo è effettivamente durato l’ultimo episodio vertiginoso, E 'importante ricordare che, dopo un attacco di vertigini, il paziente può avvertire squilibrio intercritico, cui si intende equiparare come "vertigini", , ma non veramente vertiginosa, I pazienti più anziani si descrivono un senso di distacco o di dissociazione come se fossero in una "nebbia" o come se essi sono in piedi o camminare "sul ponte di una nave di rolla su dei cuscini. "Con i pazienti più giovani, spesso è utile per verificare se le sensazioni che provano sono simili a quelli che si provano dopo aver girato e rigirato in un parco giochi. Una anamnesi ben fatta farà la differenza tra uno squilibrio sfumato ed una vera vertigine. Una disturbo otologico unilaterale, quando si verifica, è un molto utile sintomo localizzante in un paziente vertiginoso: un orecchio pieno, l’acufene , una ipoacusia o una distorsione dei suoni . Per esplorare questi sintomi, il medico può spesso localizzare il sito della lesione prima dell'esame o testing.5 Sia la presenza che la durata delle vertigini sono fondamentali per poter formulare una diagnosi accurata.
Considerazione Speciale: Una disturbo otologico unilaterale quando si verifica è un sintomo molto utile localizzante in un paziente vertiginoso.
In primo luogo, chiedere al paziente e / o al tutore di descrivere il primo episodio con le loro parole così come un episodio successivo tipico senza usare la parola vertigini, Sono gli episodi sostenuti o ricorrente? Una volta che un episodio tipico è stato completamente concretizzato con le parole proprie del paziente, il medico deve chiedere la frequenza, la lunghezza, la prevedibilità, esordio, modificando i fattori, fattori provocanti, e sintomi associati. Ogni episodio è stato associata con nausea, vomito, o, disequilibrio?
I pazienti con disturbi labirintici periferici descrivono facilmente le loro sensazioni vertiginose. La disfunzione acuta del sistema nervoso centrale (CNS)nei pazienti con può o non può determinare vertigini, considerando le disfunzioni croniche del SNC e cerebrovascolari, cardiovascolari, e le cause metaboliche delle vertigini raramente producono sensazioni di moto relativo. La Vertigine periferica è può durare da pochi secondi a qualche minuto (vertigine parossistica posizionale benigna), da pochi minuti a ore (malattia di Ménière) o da ore a giorni (vestibolare neurite). La perdita dell'udito, gli acufeni e la pienezza auricolare sono sintomi frequenti di malattia periferica. è importante stabilire se la perdita di udito era improvvisa o progressiva e se oscillava o meno. I cambiamenti di posizione spesso aggravano lo squilibrio, e viceversa la posizione supina riduce i sintomi. Si sospetta , per esempio, una vertigine parossistica posizionale benigna, nei pazienti con brevi vertigini che vengono innescate dai cambiamenti nella posizione della testa. Nella maggior parte degli episodi, l'esordio è improvviso, anche se la fine è spesso meno definita. I pazienti spesso si sentono bene tra un episodio e l’altro (Goebel A.,2001)
Diversamente dalle vertigini periferiche, l'espressione sintomatica delle vertigini di origine centrale è più variabile. Le sensazioni descritte sono spesso girano, inclinando, la sensazione di essere spinto da un lato, vertigini, confusione, o anche la sincope. Se vi è documentata la perdita di coscienza, una eziologia periferica NON è quasi mai responsabile. Utile per la localizzazione centrale è la presenza di segni di accompagnamento di disfunzione neuronale: disartria, disfagia, diplopia, parestesie, emiparesi, grave cefalea localizzata, convulsioni, e perdita della memoria, la durata dei sintomi è più varia e dura da minuti a ore. L'effetto del cambiamento di posizione è meno prevedibile. Questi costellazioni di sintomi suggeriscono che l’origine sia dal tronco cerebrale o dalla corteccia, piuttosto che una origine labirintica.
Molti fattori medici ed emotivi possono promuovere senso di vertigini e squilibrio. Ipertensione, ipotensione, patologie endocrine, e l'ansia può aggravare e/o causare vertigini, sincope e/o instabilità, ma raramente producono vere vertigini. Questi problemi generali di salute ed emotivo dovrebbero essere esplorati nel corso dell’anamnesi.
Preparati medici / Farmaci
è importante rivedere tutti i farmaci, compresi i farmaci over-the-counter, e per informazioni sulla possibile di droga e alcool uso illecito. Il paziente ha mai ricevuto il farmaco ototossica? L'elenco dei farmaci possibili ototossici recensiti, dovrebbe includere, ma non limitarsi a gentamicina per via endovenosa, la tobramicina, vancomicina, furosemide, aspirina, e cisplatino. Il questionario previsit è particolarmente utile in questo senso, perché genitori e pazienti spesso non possono Recai! farmaci esatte, in particolare con il passare del tempo.
Anamnesi Passata Medica e Chirurgica
Era il paziente nato a termine? Parto normale ? E’ stato esposto ad eventuali agenti infettivi:parotite, morbillo, rosolia, citomegalovirus, herpes, l'HIV, sifilide o la malattia di Lyme? Il paziente ha una storia attuale o passata di malattia dell'orecchio? Vi è mai stata una storia di meningite o accidente cerebrovascolare? Il paziente e mai stato sottoposto a chemioterapia e/o radioterapia? Ci sono delle condizioni cliniche di base quali malattie della tiroide, diabete mellito, malattie cardiache, malattie renali, malattie oftalmologico, malattie autoimmuni, o coagulopatia? Il paziente è mai stato sottoposto ad anestesia generale ed in caso affermativo, quali operazioni ha subito il paziente?
Anamnesi Familiare
C'è una storia familiare di vertigine/disequilibrio? Sia l’ emicrania, che la malattia di Ménière possono presentare una tendenza ad essere familiari.
Esame Fisico
Una volta che l’anamnesi è stata completa, il clinico tipicamente ha ridotto la diagnosi differenziale a poche se non una singolo tentativo di diagnosi. Come tale, l'esame fisico può essere indirizzato verso i tests per la diagnosi delle ipotesi diagnostiche. Il paziente deve sottoporsi ad un attento e standardizzato
Esame otoneurologico, che comprende un’ esame approfondito della testa e del collo sia con pneumo-otoscopia o pneumo-micro-otoscopia e un esame dei nervi cranici. L'esame della testa e dell collo deve cercare cause comuni che possono esacerbare il senso di disequilibrio come un tappo di cerume occludente, un’otite media acuta e l'otite media con effusione, l’otite media suppurativa cronica, così come una sinusite acuta e cronica, le anomalie congenite del padiglione auricolare, condotto uditivo esterno e del viso possono essere associati con anomalie del labirinto(Goebel A.,2001).
Considerazione Speciale
Le Lenti di Frenzel sono di grande aiuto nella valutazione dei movimenti oculari.
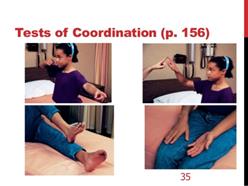
Dopo che l'esame di routine della testa e del collo è stato completato, il clinico valuta attentamente i movimenti oculari ed esegue una breve, esame neurologico diretto. Per la valutazione dei movimenti oculari, le lenti di Frenzel sono di grande aiuto. Le lenti di Frenzel sono occhiali con lenti di ingrandimento, illuminate internamente, che confondono la visione del paziente ed impediscono al paziente di minimizzare un nistagmo spontaneo attraverso la fissazione visiva ed ingrandendo gli occhi del paziente rendendo più facile di evidenziare i piccoli movimenti degli occhi. I pazienti devono essere testati con i loro occhiali o con le lenti a contatto in modo che la loro visione sia ottimizzata. Nella popolazione pediatrica, è richiesto il giudizio di tale esame, poiché non tutti i bambini tollerano il suo utilizzo, è una delle ragioni per riservare tale parte dell'esame per ultimo. L'esame neurologico è costituito da una serie di test di funzionalità cerebellare, come il test indice-naso , test tallone-tibia, movimenti alternati rapidi, il test di Romberg, e della marcia .
Nel test indice-naso, al paziente viene chiesto di toccare alternativamente il dito dell'esaminatore con braccia estese ed il proprio naso il più velocemente e accuratamente possibile. Questo viene fatto prima con occhi aperti e poi con gli occhi chiusi. Se il paziente va al di là del dito dell’esaminatore “overshoot” in modo coerente, la malattia cerebellare è sospetto. Questi pazienti possono a volte anche presentare un tremito, quando il dito si avvicina al bersaglio.
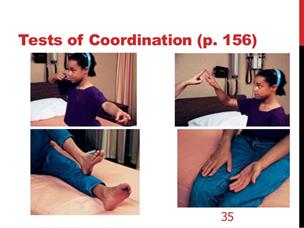
A prima vista;
Esame neurologico
• Valutazione dei movimenti muscolari oculari
• Prova dito-naso
• Prova tallone-tibia
• movimenti alternati rapidi
• test di Romberg
• Valutazione della deambulazione
Durante il test del tallone-tibia , si dovrebbero osservare movimenti fluidi Con la malattia cerebellare, diventa evidente una oscillazione, nel movimento tallone-tibia .
I Movimenti alternati rapidi sono testati in due modi. Al paziente viene chiesto di toccare alternativamente la coscia con il palmo ed il dorso della loro mano in rapida successione, o il paziente è invitato a toccare il pollice e ciascuna delle dita in mano rapidamente avanti e indietro. La possibilità di eseguire un rapido movimento alternato è l’adiadococinesia; l'incapacità di farlo è chiamato dis adiadococinesia ed è indicativo della patologia cerebellare.
Con la locuzione Test di Romberg si intende un particolare esame diagnostico comunemente adoperato in Neurologia e Otorinolaringoiatria su pazienti che lamentano disordini dell'equilibrio o instabilità (atassia). La prova fu ideata dal neurologo Moritz Heinrich Romberg (1795-1873).
 La
procedura è semplice: il medico chiede al paziente di stare in piedi a talloni
uniti e braccia distese in avanti per un tempo di alcuni secondi ad occhi
aperti. Si fa ripetere l'esame al paziente chiedendogli di chiudere gli occhi.
Se tendesse a barcollare fortemente o cadere nei primi 30 secondi, il test si
intende positivo in caso di ATASSIA DI INFORMAZIONE (presenza di deficit di
informazione sensitiva propriocettiva e labirintica), mentre è negativo in caso
di ATASSIA CEREBELLARE. Una lieve oscillazione non è da considerarsi
patologica. Non è infrequente il cosiddetto falso positivo, ossia la perdita di
equilibrio in pazienti sani ma affetti da disturbi psicologici (ansia, stress).
In tali casi il medico, che riconosce facilmente un soggetto ansioso, propone,
durante il test, piccoli diversivi o distrazioni, come tracciare dei segni col
dito sulla fronte del paziente, oppure fargli tastare coi pollici le altre 4
dita.
La
procedura è semplice: il medico chiede al paziente di stare in piedi a talloni
uniti e braccia distese in avanti per un tempo di alcuni secondi ad occhi
aperti. Si fa ripetere l'esame al paziente chiedendogli di chiudere gli occhi.
Se tendesse a barcollare fortemente o cadere nei primi 30 secondi, il test si
intende positivo in caso di ATASSIA DI INFORMAZIONE (presenza di deficit di
informazione sensitiva propriocettiva e labirintica), mentre è negativo in caso
di ATASSIA CEREBELLARE. Una lieve oscillazione non è da considerarsi
patologica. Non è infrequente il cosiddetto falso positivo, ossia la perdita di
equilibrio in pazienti sani ma affetti da disturbi psicologici (ansia, stress).
In tali casi il medico, che riconosce facilmente un soggetto ansioso, propone,
durante il test, piccoli diversivi o distrazioni, come tracciare dei segni col
dito sulla fronte del paziente, oppure fargli tastare coi pollici le altre 4
dita.
il primo e più importante passo nella valutazione è ottenere una storia completa. Bisogna prima stabilire la presenza di vertigine contro qualche altra forma di vertigini da luogo ad una storia della sensazione di rotazione o movimento. Questo può risultare difficile nei bambini più piccoli, dove può essere utile per evocare i sinonimi parco giochi come la filatura, oscillare, come un-giostra ecc
Al letto del malato è già possibile realizzare un rapido esame clinico otologico vestibolare e neurologico.
La sindrome vestibolare si può riconoscere da una perdita di equilibrio lateralizzata: tendenza alla caduta sempre dallo stesso lato a occhi chiusi e in piedi su un terreno duro o sul materasso, il che altera le informazioni propriocettive e sensibilizza il test.
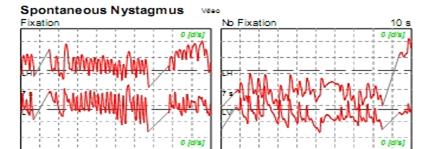
L'osservazione degli occhi può rivelare un battito regolare (alternante fasi rapide e fasi lente) che corrisponde a un nistagmo. Questo nistagmo è rapidamente inibito dalla fissazione oculare e quindi evidente solo grazie a degli occhiali che rendono sfocata la visione (occhiali di Frenzel). La fase rapida del nistagmo indica il vestibolo più eccitabile (e sarà di direzione opposta a una lesione). Si ricerca un nistagmo provocato dalle posizioni coricate sui lati (centrale o periferico).
Bisogna verificare se il bambino sente bene dalle due orecchie: scuotendo presso l'orecchio un oggetto sonoro (per esempio delle chiavi) senza che il bambino lo veda, sussurrando a un orecchio delle parole che deve ripetere mentre si tappa il padiglione dell'altro orecchio muovendo il trago per realizzare un mascheramento e impedire a questo orecchio di rispondere al posto dell'altro. Questa acumetria clinica si può realizzare chiedendo al bambino di indicare immagini o disegni che gli si mostra su carta e che corrispondono alle parole sussurrate a 30 cm dal suo orecchio.
Bisogna praticare un'otoscopia e un esame neurologico veloce ma completo.
I primi esami diagnostici da richiedere al minimo dubbio sono l'esame audiovestibolare e il controllo oftalmologico.
Valutazione vestibolare
Gli accertamenti vestibolari vanno selezionati ed effettuati in base all'età del paziente e del grado di collaborazione." Possiamo identificare 3 fasce d'età che condizionano la selezione dei test vestibolari:
1. Età inferiore a un anno
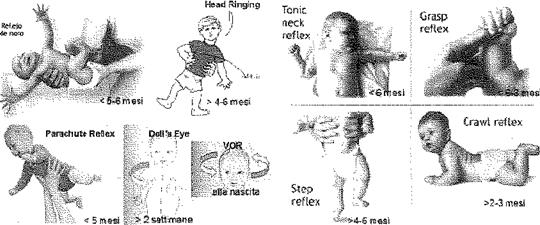
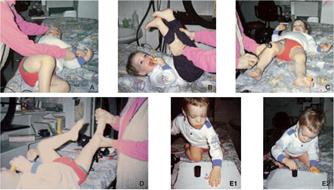
In questa fascia d'età è possibile unicamente analizzare la presenza o assenza di alcuni riflessi primitivi, al fine di valutare il giusto grado di sviluppo psico-motorio. Verificarne la presenza o assenza, asimmetria, persistenza oltre l'atteso per età può indicare un disordine del SNC/SNP o un ritardo della sua maturazione. La Figura 2 esemplifica i principali riflessi primitivi, di seguito elencati:"."
· Riflesso vestibolo-oculomotore(VOR): presente alla nascita;
· "Occhi di bambola": si osserva dalle 2 settimane di vita in poi;
· "Crawl Test" compare dai 2-3 mesi di vita.
· "Head Ringing": compare dai 4-6 mesi di vita;
· "Step Reflex": compare dai 4-6 mesi di vita;
· Riflesso del "Paracadute": scompare entro i 5 mesi di vita; Riflesso di Moro: scompare entro i 5-6 mesi di vita;
· Riflesso di Moro: scompare entro i 5-6 mesi di vita;
· Riflesso dello "Schermitone": si osserva entro i 6 mesi di vita;
· Riflesso della "Prensione' scompare entro 6-8 mesi.
1. Età compresa tra 1 e 3 anni
È la fascia di età di più difficile valutazione e interpretazione, in quanto tutti i riflessi presenti alla nascita si sono negativizzati e lo sviluppo fisico del bimbo non consente
|
|
|
Fig. 2. Semeiotica dei riflessi primitivi per la valutazione del grado di maturazione dell'apparato vestibolare e pasturale entro i anno di età. |
|
|
|
Fig. 3. Valutazione vestibolare e posturale nella fascia di età 1-3 anni nei movimenti spontanei e mediante stimolo ludico
|
l'applicazione dei test diagnostici utilizzati in età più matura. A causa della facilità di distrazione e della scarsa collaborazione attiva del bimbo, occorre analizzare i movimenti del capo, del tronco e degli arti, l'atteggiamento posturale, la forza e la coordinazione durante movimenti spontanei e il gioco, la deambulazione spontanea, la corsa, interazione con il genitore. I movimenti oculari vanno ricercati con manovre distrattive, fissazione di oggetti ludici o caramelle, stimolando continuamente l'interesse del piccolo paziente (Figura 3).
2. Età superiore ai 3 anni
Da questa età è possibile utilizzare quasi ogni test diagnostico utilizzato in età adulta, confermando che la collaborazione del piccolo paziente è sempre sufficiente e in qualche caso persino migliore di quella ottenuta dai pazienti adulti. Quasi sempre il bambino è interessato a partecipare ai test strumentali con apparecchiature tecnologiche mostrando piena collaborazione (TABELLA 5). Ogni test viene selezionato e individualizzato in base ai dati anamnestici e clinici del piccolo paziente. Si illustrano di seguito schematicamente i vari test clinici e strumentali vestibolari che possono essere effettuati dai 3-4 anni, rimandando gli approfondimenti a trattazioni più specifiche in merito.
|
STUDIO DEI MOVIMENTI OCULARI E DEL VOR Ricerca VNS Infrarosso di: Ny spontaneo, Ny di posizione e posizbnarnento, Ny provocato (HST, V-HIT sui 3 canali, VIN 30-60-100 Hz, Iperventilazione) Studio ENG-VNG di VOR, V-VOR, VOR-FIX, COR (stimolazione rotatoria, timolazione calorica) Studio ENG-VNG di Smooth Pursuit, Saccadici, NOC Studio Air/Bone O-0 Vemps Iperventilazione |
STUDIO DEI RIFLESSI POSTURALI (VSR) Atteggiamento posturale Prova delle Braccia tese Test di Romberg (sensibilizzato) Test di Unterberger/Fukuda (sensibilizzati) Stabilometria |
Tabella 6. Valutazione vestibolare clinica e strumentale in età superiore ai 3-4 anni
Esame vestibolare clinico di base
L'esame audiovestibolare viene realizzato da un otorinolaringoiatra e comprende un'anamnesi «poliziesca»dei familiari e del bambino se questo è abbastanza grande da raccontare ciò che gli è accaduto, e una serie di test clinici.
Questi test clinici sono accessibili senza alcun materiale sofisticato, cioè a disposizione di ogni medico. Li tratteremo con in modo discretamente dettagliato.
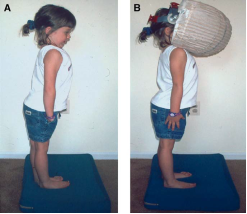
• Osservazione del comportamento posturale e motorio spontaneo durante i giochi, studio del controllo posturale durante la deambulazione, il salto su terreno duro e su terreno molle, se possibile con gli occhi chiusi (Figura 4, Figura 5 ). Un deficit vestibolare bilaterale si accompagna a cadute frequenti e a squilibrio in occasione di rotazioni rapide della testa e, nel bambino molto piccolo, a un'ipotonia assiale. [1, 2, 3]
|
|
|
|
|
Figura 4. A,B,C,D Ricerca di una deviazione posturale statica 4. A/C e dinamica 4B/D,. Su terreno duro o terreno molle 2B-D, occhi aperti o chiusi (A,B,C). |
Figura 4.C Romberg occhi chiusi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Figura 5 : Esame dell'attività spontanea (da A a D). Wiener-Vacher S.R.,ET AL.,1997/8/2001.
|
|
|
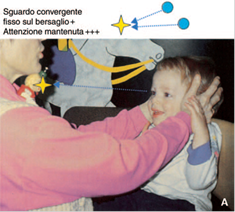
• Studio dell'oculomotricità (Figura 6 ): esso comporta lo studio dei movimenti coniugati degli occhi durante l'inseguimento di un piccolo bersaglio sul piano frontale e sul piano sagittale mediano (per la convergenza oculare). Esso comporta anche lo studio della precisione dei movimenti saccadici oculari quando si chiede al bambino per esempio di guardare un piccolo giocattolo che compare dietro un cartone perforato.
|
Fig. 6A gaze nystagmus (20°,20cm). |
6B inseguimento mobilità e convergenza oculare |
6C otticocinetico |
6.D1 saccadi |
6.D2 saccadi |
• Ricerca, con degli occhiali da videoscopia (o di occhiali di Frenzel), di un nistagmo spontaneo o rivelato dai movimenti della testa o di un'instabilità dello sguardo negli sguardi leggermente decentrati (che in assenza di nistagmo spontaneo corrisponde al gaze nystagmus di origine centrale)
|
Figura 7. Ricerca di un nistagmo spontaneo o rivelato da scuotimento della testa. Esame sotto occhiali di Frenzel o videoscopia per evitare l'inibizione di un eventuale nistagmo dovuta alla fissazione. Manovra di scuotimento rapido della testa per rivelare una preponderanza direzionale (che può essere periferica o centrale). |

Figura 7b Nistagmo registrato con ENG con gli occhi ruotati a sinistra . Questo paziente aveva la testa girata spontaneamente verso destra . ( Da Noorden GK von , Munoz M , Wong SY : . Meccanismi di compensazione a nistagmo congenito Am J Ophthalmol 104 : 387 , 1987 )
Le seguenti tre tracce sono dI un paziente con CN(Nistagmo Congenito) a causa di un disturbo visivo presente sin dai primi anni di vita.
|
|
|
Figura 7c CN: è tipico un nistagmo molto più intenso con la luce (fissazione) rispetto al buio. Questo è il modo più semplice per diagnosticare un NC rispetto ad ogni altro tipo di nistagmo. |
Figura 7d CN: l’inseguimento orizzontale è interrotta da una forte nistagmo
Interpretazione. Se si osserva nistagmo, particolare attenzione è rivolta alla ampiezza, la direzione, ed all'effetto della fissazione dell'oggetto in movimento. Le lesioni del labirinto e del nervo VIII° producono un nistagmo orizzontale intenso, rotatorio a direzione fissa che aumenta sotto lenti di Frenzel. Il nistagmo si intensifica anche, quando si guarda, nella direzione della fase rapida (legge di Alexander). Questo tipo di nistagmo può essere di tipo irritativo (se batte verso l'orecchio interessato) e deficitario (se battendo verso l'orecchio sano)nelle lesioni del labirinto, del nervo VIII, o (raramente) dei nuclei vestibolari. Al contrario, le lesioni del tronco cerebrale, cervelletto, e cerebrum causano un nistagmo meno intenso orizzontale, verticale, torsionale, o pendolare, che cambia direzione e che si riduce sotto lenti di Frenzel. Esempi sono rappresentati dal nistagmo periodico alternante (PAN), nistagmo congenito, e le lesioni sulla linea mediana del cervelletto. (Figura 7 ).
• Ricerca di saccadi di richiamo durante impulsi rotatori rapidi della testa (nel piano orizzontale e nel piano sagittale) mentre il soggetto fissa lo sguardo su un bersaglio (head impulse test di Halmagyi) (Figura 8 A-B-C). La presenza di una saccade di richiamo indica un deficit completo del canale semicircolare situato nel piano di rotazione e sul lato della rotazione. Questa manovra può essere eseguita nel piano dei 6 canali semicircolari. Tuttavia si può ottenere una saccade di richiamo quando esiste un difetto di convergenza oculare o una ambliopia, in questo caso la saccade ottenuta è meno riproducibile e in caso di disturbi di convergenza oculare scompare quando il bersaglio è posto a distanza (più di 1,50 m).
|
Figura 8.A-B . Test da impulso rotatorio della testa HEAD THRUST TEST O TEST DI HAMALGYI Si invita il bambino a fissare un bersaglio posto al centro del campo visivo (ad esempio, il naso dell’esaminatore), quindi si ruota bruscamente il capo in una direzione con un movimento veloce di circa 30°. Nel bambino normale l’occhio rimarrà sul bersaglio. Nella rotazione verso destra, infatti, il canale semicircolare laterale di destra comanderà una controrotazione dei bulbi verso sinistra che permetterà al paziente di non perdere la mira; se al contrario il riflesso vestibolo-oculomotore risulta deficitario, il movimento verso sinistra sarà insufficiente e gli occhi, per riprendere il bersaglio, dovranno compiere un movimento rapido verso sinistra .Il test di Halmagyi: può valutare i sei canali (A, B). Rotazione della testa passiva, rapida, breve, imprevedibile nel piano del canale studiato. Saccade di recupero: deficit vestibolare completo dal lato della rotazione della testa con saccade. Se disturbo di convergenza oculare: normale quando il bersaglio è allontanato.
|
|
|
|
|
|
|
|
|
Figura 8.C Video-Impulse Test o Test Impulsivo Rotatorio della Testa (test di Halmagyi): può valutare i sei canali (A, B). Rotazione della testa passiva, rapida, breve, imprevedibile nel piano del canale studiato. Saccade di recupero: deficit vestibolare completo dal lato della rotazione della testa con saccade. Se disturbo di convergenza oculare: normale quando il bersaglio è allontanato.
|
|
HEAD SHAKING TEST L’esaminatore ruota il capo del paziente sul piano orizzontale per circa per 20 volte ad una frequenza di circa 2 Hz. Osserva quindi attraverso gli occhiali di Frenzel la comparsa di un eventuale nistagmo. Nei deficit vestibolari periferici compare un nistagmo diretto verso il lato sano. L’head shaking test non è un test molto sensibile, specìalmente se eseguito a distanza dalla lesione, ma è accettato come test di screening per evidenziare asìmmetrie vestibolari a livello periferico o centrale senza possibilità di precisazioni topodiagnostiche. Non deve essere l’unico test con cuì fare diagnosi di deficit periferico (Figura 9 A-B-C). |
|
Fig.
|
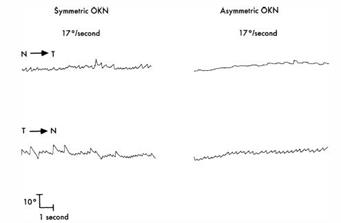
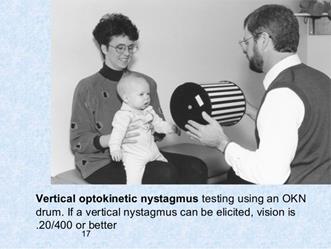
• Inibizione mediante la fissazione delle risposte vestibolo-oculari (VOR) e otticocinetiche (OKN) (Figura 9 D): il bambino seduto sulle ginocchia di un genitore o su una poltrona girevole deve mantenere l'attenzione e lo sguardo su un piccolo giocattolo o una caramella tenuti davanti a lui e che girano insieme a lui. Un bambino fin dall'età di 1 anno può mantenere fisso lo sguardo su un bersaglio e inibire al 100% i movimenti OKN e VOR che il movimento della poltrona provoca se è completamente attento durante la rotazione.
|
Figura 9D. Risposte vestibolo-oculari, ottico cinetiche e la loro inibizione mediante la fissazione. Inibizione al 100% nei bambini molto piccoli se l'attenzione è sostenuta. Se non esiste inibizione al 100%, in età superiore ai 2 anni: lesione cerebellare.
|
|
|
|
Stimoli otticcoinetici pediatrici disponibili in Interacoustics VO425 FireWire® VN |
|
|
Fig. 10.a : Risposte ottico-cinetiche e vestibolo-oculari e loro inibizione mediante la fissazione. Inibizione al 100% nei bambini molto piccoli se l'attenzione è sostenuta. Se non esiste inibizione al 100%, età superiore ai 2 anni: lesione cerebellare.
|
|
|
Fig. 10.b Nistagmogramma binoculare durante la stimolazione ottico-cinetica nasotemporale ( tracciati superiori) e temporonasale ( tracciati inferiori) in un soggetto normale ( a sinistra) e un paziente con esotropia essenziale infantile essenziale ( a destra ) . Si nota scarsa risposta ottico-cinetica quando il tamburo è mosso in una direzione nasotemporale nel paziente esotropico . ( Da Noorden GK von : concetti attuali di esotropia infantile essenziale ( Bowman Lecture ) Eye 2 : . 343 , 1988 )
|
• Ricerca di un nistagmo provocato dalla posizione di decubito laterale destro e sinistro (Figura 11 ). Si può porre il bambino in posizione distesa sul lato, su un lettino di visita o in braccio a un genitore. Lo sguardo del bambino è mantenuto indirizzato verso un giocattolo oppure un punto nella stanza. Si può mettere così in evidenza un nistagmo che evoca una canalolitiasi (vertigine posizionale parossistica benigna rara nel bambino) o un nistagmo di origine centrale.
|
Fig. 11. Ricerca di un nistagmo rivelato da cambiamenti di posizione. Vertigine posizionale parossistica benigna (cupulocanalolitiasi): latenza, geotropica, esauribile, adattabile, orizzonto-rotatorio, rara nel bambino. Lesione centrale: non latenza, non adattabile né esauribile, direzione variabile, multidirezionale, raramente isolato.
|
Nel test indice - naso , il paziente viene chiesto di toccare alternativamente il dito dell'esaminatore estesa ed il suo proprio naso alternativamente il più velocemente e accuratamente possibile . Questo viene fatto prima con occhi aperti e poi con occhi causati se il paziente sbaglia il bersaglio in modo coerente , la malattia cerebellare è sospetto. Questi pazienti possono anche a volte presentare un tremito ,quando il dito si avvicina al bersaglio .Il Test di Romberg Figura 12.B può essere meglio studiato con la Pedana Stabilometrica Statica e Computerizzata Figura 12.C.D
|
|
|
|
Fig. 12.A di test di coordinazione |
Fig. 12.B il test Romberg |
|
|
|
|
Fig. 12.C Pedana Stabilometrica Statica |
Fig. 12.D Pedana Stabilometrica Computerizzata |
Esame neurologico somatico clinico (Figura 13.A.-E.)
Figura 13 :
Esame neurologico: paia di nervi cranici, tono, forza muscolare, sensibilità, riflessi osteotendinei, ricerca del segno di Babinski, di segni di lesione cerebellare.
A. Segno del fazzoletto.
B. Tono degli arti inferiori.
C. Riflesso osteotendineo.
Si verifica la somestesia (caldo-freddo, puntura-tocco), la motricità, il tono muscolare (ricercando una spasticità o un'ipotonia confrontando i lati destro e sinistro); si ricerca la presenza dei riflessi osteotendinei ai quattro arti, il segno di Babinski (anormale estensione delle dita in occasione della stimolazione del bordo laterale della pianta dei piedi) e segni di lesione cerebellare (riflessi osteotendinei [ROT] vivaci diffusi policinetici, ruota dentata, dismetria nella prova dito-naso o tallone-ginocchio o grande imprecisione dei gesti in occasione di compiti di prensione di piccoli giocattoli per porli in una piccola ciotola, adiadococinesia durante i movimenti di marionette con le mani), nonché dei segni che possono venire ad aggiungersi a un'ipermetria dei movimenti saccadici oculari (l'occhio supera il bersaglio), un inseguimento oculare saccadico o un difetto di inibizione mediante la fissazione oculare dei riflessi optocinetico e vestibolo-oculare già riscontrato durante lo studio dell'oculomotricità, e che completeranno la sindrome cerebellare
Figura 13 . Esame neurologico: paia di nervi cranici, tono, forza muscolare, sensibilità, riflessi osteotendinei, ricerca del segno di Babinski, di segni di lesione cerebellare.
A. Segno del fazzoletto.
B. Tono degli arti inferiori.
C. Riflesso osteotendineo.
D. Fascicolazione alla flessione del piede.
E. Precisione dei gesti fini.
Lo studio della sensibilità profonda può essere eseguito agli arti superiori: si chiede al bambino, mentre tiene gli occhi chiusi, di afferrare con una delle mani il pollice dell'altra mano che è portata in una posizione qualsiasi dall'esaminatore (se non esiste un deficit motorio, un interessamento della sensibilità profonda si tradurrà in un atto mancato, con la mano che non potrà essere trovata a occhi chiusi dal lato del deficit). Lo stesso esame può essere eseguito agli arti inferiori con il movimento talloni-ginocchia a occhi chiusi o la determinazione a occhi chiusi della posizione impressa alle dita dei piedi (in alto o in basso) dall'esaminatore.
Nel bambino piccolo (fino a 4-5 anni), l'esame confronta i due emisomi: durante la motricità spontanea, durante i giochi di prensione di oggetti o dell'aggrapparsi a un appoggio con le mani al momento del passaggio dalla posizione supina a quella in piedi, durante la deambulazione o la corsa. La tonicità muscolare è confrontata durante flessioni ed estensioni agli arti superiori (segno del fazzoletto), agli arti inferiori (in flessione ed estensione a gambe flesse e gambe tese) e a livello del dorso (flessione ed estensione della schiena). I ROT sono valutati ai quattro arti. La ricerca del riflesso cutaneo-plantare permette di individuare un segno di Babinski (alla stimolazione della pianta del piede, si ottiene in teoria una flessione delle dita appena la deambulazione autonoma è stata acquisita; il segno di Babinski è un'estensione delle dita: è fisiologico prima che sia acquisita la deambulazione autonoma).
• Clinica delle deviazioni segmentario-toniche
Per
deviazioni segmentario-toniche s’intendono delle modificazioni posturali,
statiche e dinamiche, dovute a un’attivazione patologica del controllo
muscolare scheletrico in vari distretti corporei innescata da patologie a
carico dei sistemi sensoriali labirintico, visivo e propriocettivo o a carico
dei centri integratori del sistema nervoso centrale.
I test clinici di valutazione della postura godono in generale di una mediocre sensibilità e di una scarsa specificità; per aumentarne il significato, di volta in volta sono state proposte modificazioni consistenti nella soppressione o nella riduzione dell’interferenza di uno dei sotto- sistemi sensoriali, di solito la vista e la propriocezione, o di entrambi.
Attualmente la valutazione del sistema vestibolospinale si basa su:
— Test di Romberg;
— Test di Romberg sensibilizzato (tandem Romberg);
— Test di Unterberger;
— Test di Fukuda;
— Test di Unterberger con svincolo occlusale (Nahmani test);
— Prova indice-naso;
— Prova delle braccia tese;
— Test di De Cyon.
Praticamente ritenuta obsoleta la prova della marcia a stella di Babinsky-Weil che, insieme ad altri test di valutazione dinamica della marcia, è riservata ad un ambito puramente neurologico
Test di Romberg: Figura.14 A-B ;
Il bambino viene posto in posizione eretta con la base d’appoggio a piedi lievemente divaricati (30°) e talloni uniti, con le braccia lungo il corpo. Si esegue una valutazione ad occhi aperti e, successivamente, ad occhi chiusi (per almeno un minuto), annotando:
— direzione e grandezza di eventuali oscillazioni;
— direzione di franche lateropulsioni o retropulsioni;
— mantenimento della posizione senza necessità di allargare la base d’appoggio;
— variazioni indotte dalla visione.

![]()

Fig.14 A-B
Interpretazione. In un soggetto normale, il mantenimento della posizione di Romberg a occhi chiusi è agevole e si possono riscontrare semplici e piccole oscillazioni polidirezionali di significato aspecifico.
Un soggetto vestibolopatico a livello del recettore o del nervo vestibolare, acuto o subacuto, presenta una lenta ma inesorabile deviazione lenta verso il lato leso (congrua con la fase lenta del Ny spontaneo), sia ad occhi aperti che ad occhi chiusi, condizione in cui la lateropulsione si accentua.
Nel soggetto con lesioni centrali, specie vermiane o cerebellari sulla linea mediana, si assiste alla comparsa di evidenti oscillazioni anteroposteriori, alla necessità di allargare la base d’appoggio e, talvolta, all’esecuzione di un passo per mantenere la stazione.
Prova delle braccia tese (Figura.15):
A paziente seduto, senza appoggio dorsale e con gli occhi chiusi, viene chiesto di tendere le braccia in avanti con gli indici estesi. Un esaminatore, postosi dinnanzi al paziente, utilizza i propri indici posizionati a qualche centimetro da quelli del paziente, in modo tale da costituire un riferimento in caso di eventuali deviazioni. Nei pazienti vestibolopatici, la deviazione delle braccia tese avviene sul piano orizzontale , è simmetrica in entrambe le braccia ed è diretta verso il lato patologico (consensuale alla fase lenta del Ny), Nei pazienti con patologie neurologiche, la deviazione può avvenire anche sul piano verticale e spesso
asimmetrica nelle braccia, Se sono lesionare direttamente le vie vestibolo cerebellari, la deviazione può essere nella direzione della fase rapida del Ny, mentre se sono in gioco lesioni extravestibolari possono essere monolaterali, associate a tremore, ipostenia o rigidità.
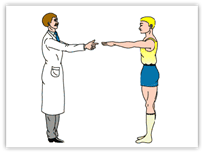
Fig.15
Prova indice-naso(Figura.16):
Analoga alla prova ginocchio-calcagno (poco impiegata in ambito vestibologico), valuta due aspetti neurologici contigui per importanza allo studio delle deviazioni segmentario-toniche e cioè la coordinazione del movimento e la precisione (metria). Consiste nel valutare il paziente cui è stato chiesto, da seduto, di toccarsi la punta del naso con la punta degli indici in maniera alternata, partendo a braccia allargate a croce, dapprima ad occhi aperti e poi ad occhi chiusi. Le alterazioni pìù frequenti sono date dall’incapacità di alternare il movimento delle braccia in maniera coordinata (atassia), dalla mancanza di continuità e di precisione con necessità di rallentare verso la fine la velocità del movimento (dismetria, bradirelecinesia), che in genere esprimono problemi di natura centrale (gangli della base, , etc.).
 Fig.16
Fig.16
È indispensabile davanti a un paziente portatore di vertigini o di disturbi dell'equilibrio. Può essere effettuato molto rapidamente (meno di 10 min) e se si prende l'abitudine di eseguire questo esame, sarà tanto più facile riconoscere un'anomalia quando sarà presente.
• L'olfatto (I): il compito sarà di determinare qual è tra le nostre due mani quella che è stata profumata con una goccia di vaniglia.
• La vista (II): sarà valutata con l'inseguimento binoculare quindi monoculare (l'altro occhio resta coperto), il compito sarà seguire un piccolo giocattolo, e il campo visivo (il bambino fissa il nostro naso e deve afferrare le dita delle nostre mani che si muovono e non quelle che restano immobili nelle zone molto laterali del campo visivo).
• L'oculomotricità (III, IV, VI), testata fin dall'inizio dell'esame vestibolare, valuta lo spostamento coniugato dei due occhi durante il compito di inseguimento di un piccolo giocattolo che si sposta nel piano frontale quindi che si avvicina verso la radice del naso, per giudicare la qualità e la simmetria della convergenza oculare; il III paio cranico viene anche valutato per la sua parte intrinseca con la contrazione pupillare ottenuta attraverso l'illuminazione della pupilla con la luce dell'otoscopio (dallo stesso lato o consensualmente).
• La sensibilità del volto (V) sarà valutata mediante palpazione ma anche con la sensazione fredda percepita al contatto con la superficie metallica dell'abbassalingua sulla faccia iugale delle guance e la cute del volto.
• La motricità del volto durante la realizzazione di smorfie (fischiare, soffiare, muovere il naso, sbarrare gli occhi) e soprattutto la simmetria delle contrazioni dei muscoli del viso attestano il buon funzionamento del nervo faciale (VII).
• La contrazione simmetrica del velo e della faringe con l'abbassalingua nonché l'assenza di false strade durante l'ingestione di bevande testimoniano l'integrità dei nervi misti (IX, X, XI) e la simmetria di forza di sollevamento delle spalle quella del XI spinale.
• La simmetria della lingua quando il bambino la espone e la sposta a destra e a sinistra esclude una lesione del XII.
Esame neurologico somatico clinico (Figura 17)
Si verifica la somestesia (caldo-freddo, puntura-tocco), la motricità, il tono muscolare (ricercando una spasticità o un'ipotonia confrontando i lati destro e sinistro); si ricerca la presenza dei riflessi osteotendinei ai quattro arti, il segno di Babinski (anormale estensione delle dita in occasione della stimolazione del bordo laterale della pianta dei piedi) e segni di lesione cerebellare (riflessi osteotendinei [ROT] vivaci diffusi policinetici, ruota dentata, dismetria nella prova dito-naso o tallone-ginocchio o grande imprecisione dei gesti in occasione di compiti di prensione di piccoli giocattoli per porli in una piccola ciotola, adiadococinesia durante i movimenti di marionette con le mani), nonché dei segni che possono venire ad aggiungersi a un'ipermetria dei movimenti saccadici oculari (l'occhio supera il bersaglio), un inseguimento oculare saccadico o un difetto di inibizione mediante la fissazione oculare dei riflessi optocinetico e vestibolo-oculare già riscontrato durante lo studio dell'oculomotricità, e che completeranno la sindrome cerebellare.
|
Fig. 17.A A. Esame neurologico: paia di nervi cranici, tono, forza muscolare, sensibilità, riflessi osteotendinei, ricerca del segno di Babinski, di segni di lesione cerebellare.
|
|
|
B. Tono degli arti inferiori.
|
|
|
C. Riflesso osteotendineo.
|
|
|
D. Fascicolazione alla flessione del piede.
|
|
|
E1-2. Precisione dei gesti fini.
|
Lo studio della sensibilità profonda può essere eseguito agli arti superiori: si chiede al bambino, mentre tiene gli occhi chiusi, di afferrare con una delle mani il pollice dell'altra mano che è portata in una posizione qualsiasi dall'esaminatore (se non esiste un deficit motorio, un interessamento della sensibilità profonda si tradurrà in un atto mancato, con la mano che non potrà essere trovata a occhi chiusi dal lato del deficit). Lo stesso esame può essere eseguito agli arti inferiori con il movimento talloni-ginocchia a occhi chiusi o la determinazione a occhi chiusi della posizione impressa alle dita dei piedi (in alto o in basso) dall'esaminatore.
Nel bambino piccolo (fino a 4-5 anni), l'esame confronta i due emisomi: durante la motricità spontanea, durante i giochi di prensione di oggetti o dell'aggrapparsi a un appoggio con le mani al momento del passaggio dalla posizione supina a quella in piedi, durante la deambulazione o la corsa. La tonicità muscolare è confrontata durante flessioni ed estensioni agli arti superiori (segno del fazzoletto), agli arti inferiori (in flessione ed estensione a gambe flesse e gambe tese) e a livello del dorso (flessione ed estensione della schiena). I ROT sono valutati ai quattro arti. La ricerca del riflesso cutaneo-plantare permette di individuare un segno di Babinski (alla stimolazione della pianta del piede, si ottiene in teoria una flessione delle dita appena la deambulazione autonoma è stata acquisita; il segno di Babinski è un'estensione delle dita: è fisiologico prima che sia acquisita la deambulazione autonoma).
Il test dell'udito è complementare in caso di vertigini .
Una vertigine o un disturbo dell'equilibrio possono essere il segno di una lesione dell'orecchio interno, dove si trovano gli apparati dell'udito e dell'equilibrio. I test dell'udito sono indispensabili davanti ad ogni bambino affetto da vertigini (o instabile) a complemento dell'esame vestibolare e neurologico per valutare la funzione delle due modalità funzionali dell'orecchio interno.
L'udito sarà valutato con un audiogramma tonale e vocale. Possono essere effettuati test più completi in centri specializzati di esplorazione funzionale audio-vestibolo-oculare (otoemissioni, riflessi di orientamento condizionati [ROC], potenziali evocati uditivi [PEA]), che però possono essere realizzati in un secondo tempo.
Esso deve comprendere una misurazione dell'acuità visiva, ma anche una misurazione della rifrazione oculare sotto dilatatori del sistema di accomodazione (tipo Ciclolux® o Tropimil®) senza dimenticare una valutazione ortottica. Orbene, pochi oftalmologi effettuano essi stessi una valutazione ortottica, compito che in Francia è generalmente svolto da ortottisti. Questo esame statico valuta i limiti di fusione della visione binoculare con l'aiuto di prismi che obbligano l'occhio a divergere o convergere per fondere le immagini delle due retine.
Ciò è realizzato per la visione da vicino e quella da lontano. Questo esame permette di diagnosticare esoforie (differenza di altezza degli occhi), strabismi o difetti di convergenza oculare. Non esiste ancora un test riassuntivo valido che permetta una valutazione obiettiva delle capacità di vergenza oculare dinamica (studio in corso).
Esami vestibolari
I metodi di valutazione della funzione vestibolare hanno fatto grandi progressi da una decina d'anni e abbiamo ora la possibilità di realizzare una valutazione molto completa della funzione vestibolare canalare e otolitica. Il test di base è tuttavia più accessibile per ogni otorinolaringoiatra è il test calorico che, benché molto incompleto (e bisogna conoscerne i limiti), permette di distinguere nella grande maggioranza dei casi le malattie vestibolari da quelle che non lo sono e di individuare i disturbi periferici anche antichi e ben compensati. Questo test calorico è quindi in primo piano nell'esame vestibolare di base.
La valutazione della funzione vestibolare si realizza registrando le risposte vestibolo-oculari e vestibolo-spinali ottenute in risposta a stimolazioni vestibolari. Le stimolazioni vestibolari possono interessare il sistema dei canali semi-circolari (è il caso del test calorico o delle rotazioni secondo un asse verticale) o gli organi otolitici (è il test OVAR oppure RAIG, i potenziali miogeni sacculo-collici, la misurazione della verticale soggettiva).
Test con Video-Nistagmo-Grafia(VNG)
La Videonistagmografia (VNG) è utilizzato per valutare l'orecchio interno e funzioni centrali del sistema motorio. E 'l'unico test che può distinguere tra un unilaterale (un orecchio) e bilaterali (entrambe le orecchie) deficit orecchio interno. il test VNG è costituito da una serie di test serve a registrare la capacità del paziente di seguire stimolazione visiva e movimenti oculari corrispondenti seguenti informazioni il sistema vestibolare.
La VNG è composto da tre componenti principali. Il primo è l'esame oculomotore , che permette l'audiologo di osservare i movimenti degli occhi del paziente mentre seguono un bersaglio mobile. Il secondo componente è effettuata con diverse posizioni di testa del paziente mentre si trova su un lettino. Terzo è il test calorico, che valuta in modo indipendente i canali semicircolari orizzontali e parte superiore del nervo vestibolare da ciascun orecchio.
|
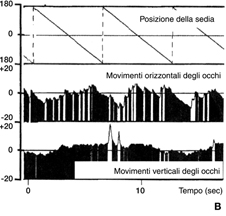
Fig. 18. A. Risposte vestibolo-oculari. Registrazione: elettrooculografia, video-oculografia; le due tecniche hanno i loro vantaggi e inconvenienti, ma nel bambino molto piccolo l'elettro-oculografica è meglio accettata. Gli elettrodi di superficie sono utilizzati per registrare i movimenti orizzontali e verticali degli occhi durante le stimolazioni vestibolari.
|
• Il test calorico (Figura 19 ) è un complemento indispensabile dell'esame clinico vestibolare (vedi sotto).
Test della funzione canalare
Test calorico (Figura 19-20) Tanzariello esami Sezione Di Vestibologia Con Sistema Integrato Per Indagini Vestibolari Obiettive Computerizzate Esame vestibolare (prove termiche)
Il test calorico (Figura 19-20 ) è un complemento indispensabile dell'esame clinico vestibolare (vedi sotto).
|
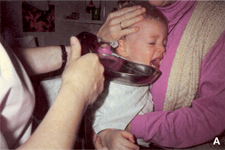
Fig. 19. A.-B. Test calorico: indispensabile. A. Irrigazione con acqua a 30° C e 44° c/30 sec ad ogni orecchio. Esame della risposta vestibolo-oculare (Frenzel o video) con una misurazione della frequenza delle fasi rapide o delle velocità delle fasi lente.
|
|
|
B. Diagramma di G. Freyss che mostra qui una ipovalenza destra senza preponderanza direzionale.
|
Si utilizza l'irrigazione di ogni condotto uditivo esterno successivamente con acqua a 30° C e 44° C per 30 secondi, per provocare un movimento dell'endolinfa dei canali semicircolari esterni posti in posizione verticale, movimento che indurrà delle scosse coniugate degli occhi (chiamate nistagmo) che corrispondono alla risposta vestibolo-oculare. I canali orizzontali sono portati in posizione verticale installando il bambino su un piano inclinato di 30° rispetto alla linea orizzontale. Il numero di nistagmo è misurato durante 30 secondi a partire dal 30o secondo dopo l'inizio dell'irrigazione, eseguendo un confronto tra i differenti stimoli. Questi risultati sono rappresentati su un diagramma messo a punto da G. Freyss e che visualizza la simmetria delle risposte dei due orecchi destro e sinistro (o valenza) e l'equilibrio dei sistemi nistagmici destro e sinistro (detto preponderanza direzionale normalmente < 15%). Appena dopo l'irrigazione e la misurazione della risposta si può posizionare il bambino in piedi, se possibile con gli occhi chiusi, per vedere se la stimolazione del vestibolo è responsabile di una deviazione posturale (a 30 ° C, caduta verso il lato stimolato, a 44° C, caduta verso il lato opposto). Una tale deviazione, quando la si osserva, è indice del buon funzionamento della via vestibolospinale dal lato stimolato.
Per ridurre il tempo associato con il test calorico (cioè, per renderlo più "amico dei bambini"), si consiglia di utilizzare un test di screening caldo monotermico (MWST). MWST offre una buona sensibilità e specificità (83% e 90%) rispetto al test calorico bitermico a bambini dai 6 ai 14 anni. Noi non utilizziamo più la stimolazione con acqua ,ma ad aria vedi immagine figura 20. C
|
|
|
|
|
|
|
Fig. 19-20. Test calorico: indispensabile Fig. 19. A :Irrigazione con acqua a 30° C e 44° c/30 sec ad ogni orecchio. Esame della risposta vestibolo-oculare (Frenzel o video) con una misurazione della frequenza delle fasi rapide o delle velocità delle fasi lente. Fig. 19. B :Diagramma di G. Freyss che mostra qui una ipovalenza sinitra senza preponderanza direzionale. Fig. 20. A :Posizionamento del paziente. Fig. 20. B: Grafici delle stimolazioni calde e fredde Fig. 20. C: Stimolatore ad Aria Otometrics da noi utilizzata Fig. 20. D: Chartr 200 VNG/ENG ICS |
Tests con la sedia rotatoria tanzariello

I Tests con la sedia rotatoria Figura 21 A-B-C sono il "gold standard" per quantificare la debolezza del sistema vestibolare bilaterale e la funzione utricolo indipendente. Permette l'audiologo di valutare a fondo di compensazione vestibolare. La sedia rotazionale gli consente anche / lei a identificare disturbi del sistema vestibolare centrale in presenza di un normale test calorico, e, quando utilizzato in combinazione con il VEMP, permette un'intera valutazione del sistema otolitico. Questo è anche l'esame vestibolare di scelta per i bambini, poiché lo trovano più tollerabile test calorico.
La sedia rotatoria , inoltre, esamina ogni utricolo indipendente attraverso sub test otoliti. Il sistema otolitico è costituito dall’ utricolo e sacculo, che sono gli organi sensoriali nell'orecchio interno che convertono accelerazione lineare in un codice elettrico il cervello può utilizzare. I’ utricolo è responsabile per il rilevamento dell'accelerazione orizzontale. Dopo la stimolazione di una delle otricoli, il paziente percepisce che l'ambiente si inclina. Questo è valutato utilizzando la centrifugazione unilaterale (UC) e (OVAR) test.di rotazione verticale al di fuori dell’asse

Esame pendolare (Figura 22.A, Figura. 31)
 Il
soggetto è seduto su una sedia girevole e sottoposto a rotazioni sinusoidali
(di frequenza 0,05 Hz e di velocità di 25° /s). Il riflesso vestibolo-oculare
registrato corrisponde alla stimolazione dei canali semicircolari esterni e la
frequenza e la velocità delle fasi lente del nistagmo devono essere normalmente
simmetriche. Le asimmetrie sono presenti in fase acuta dopo una lesione
periferica del vestibolo e sono molto rapidamente cancellate dai processi di
compensazione centrale. Un'areflessia bilaterale si presenta come un'assenza di
risposta.
Il
soggetto è seduto su una sedia girevole e sottoposto a rotazioni sinusoidali
(di frequenza 0,05 Hz e di velocità di 25° /s). Il riflesso vestibolo-oculare
registrato corrisponde alla stimolazione dei canali semicircolari esterni e la
frequenza e la velocità delle fasi lente del nistagmo devono essere normalmente
simmetriche. Le asimmetrie sono presenti in fase acuta dopo una lesione
periferica del vestibolo e sono molto rapidamente cancellate dai processi di
compensazione centrale. Un'areflessia bilaterale si presenta come un'assenza di
risposta.
PRINCIPALI PROVE PENDOLARI
1e)Prova pendolare
La prova pendolare utilizza uno stimolo acceleratorio di tipo sinusoidale, di cui sono noti l’ampiezza ed il periodo dell’oscillazione. Tale prova si differenzia dalle precedenti in quanto lo stimolo acceleratorio viene applicato alternativamente ai due labirinti: tale variazione continua (oraria ed antioraria) di stimolazione crea una situazione che si avvicina alla riproduzione dei naturali movimenti del capo durante la vita di relazione.
Lo stimolo rotatorio sinusoidale è definito da due variabili semplici:
a) il periodo d’oscillazione,
b) l’ampiezza d’oscillazione.
Con la prova pendolare la sedia deviata dalla sua posizione d’equilibrio ritorna a questa posizione con un’oscillazione sinusoidale smorzata; lo stimolo fa deviare la cupola alternativamente in direzione ampullipeta e ampullifuga, producendo un nistagmo che cambia direzione in ogni emiciclo rotatorio (periodo 20 sec., ampiezza massima di partenza 180°, smorzamento in 15 periodi) la velocità angolare della fase lenta (VAL) massima o media e la frequenza massima sono usate per quantificare la risposta in ogni emiciclo.
Rotazioni orizzontali sinusoidali
1e)Test pendolare rotatorio sinusoidale smorzato (Grenier)
Esso presenta le seguenti caratteristiche: un periodo di 20 secondi (frequenza 0,05 Hz), un'ampiezza massima di 180°, uno smorzamento esponenziale in 15 periodi, un'accelerazione in partenza di 18°/s2. Il movimento oculare è registrato contemporaneamente al movimento della poltrona. Il parametro studiato è il più delle volte la velocità media della fase lenta del nistagmo, calcolata mediante computer, o l'ampiezza cumulativa del movimento dell'occhio. Quest'ultima è ottenuta addizionando le fasi lente e sopprimendo le fasi rapide. Il tracciato cumulativo ha allora la forma di un sinusoide smorzato sovrapponibile al movimento della poltrona. Sono allora misurati il guadagno e la fase del RVOH. Nel soggetto normale, essi sono rispettivamente vicini a 0,6 per il guadagno e a 10° per la fase. Questo test ha il vantaggio di essere rapido, ma esamina il sistema vestibolare soltanto nel campo delle risposte a basse frequenze, mentre può rispondere a un'ampia gamma di frequenze che vanno da 0,01 Hz a 20 Hz.
Si studia anche nel corso di questo test l'indice di inibizione del nistagmo con fissazione oculare (IFO). In questo caso, si chiede al soggetto di fissare un bersaglio luminoso posto nella maschera di videonistagmografia mentre è sottoposto a questa rotazione. La fissazione oculare induce un'inibizione di oltre il 50% del guadagno del RVOH. Un IFO superiore al 50% è sempre segno di una patologia vestibolare centrale, ma non ha un valore localizzatorio preciso.
In caso di distruzione acuta e unilaterale di un labirinto, si osserva una diminuzione bilaterale del guadagno del RVOH a questo test a basse frequenze, più marcata per le rotazioni verso il lato leso che per quelle verso il lato sano. A distanza, queste alterazioni a basse frequenze (0,05 Hz) scompaiono il più delle volte grazie al compenso vestibolare centrale il che, al contrario delle prove caloriche, limita l'interesse di questo esame quando è eseguito a distanza dalla lesione.

Fig.23
a velocità angolare
progressivamente
smorzata
2e)Test pendolare sinusoidale a scansione di frequenza. Ulmer E. 2002, Jenkins H.A., 1982 ;
Permette di analizzare la risposta del vestibolo su una più ampia gamma di frequenze. Nel corso di questo test, il paziente è collocato su di una sedia animata da un movimento sinusoidale il cui periodo passa progressivamente in 2 minuti da 20 a 2 secondi, il che corrisponde a uno spostamento della frequenza da 0,05 Hz a 0,5 Hz. L'ampiezza dell'oscillazione diminuisce progressivamente, in modo da mantenere un'accelerazione sensibilmente costante. Si può quindi valutare il guadagno di RVOH su una gamma di frequenze di stimolazione che vanno da 1 a 10. Un'areflessia alle prove caloriche e rotatorie sinusoidali può non verificarsi a questo test di scansione di frequenza. Ciò potrebbe corrispondere a una funzione canalare orizzontale residua e in particolare a una persistenza delle cellule fasiche dell'epitelio neurosensoriale, di cui si sa che sono stimolate a frequenze superiori a 0,1 Hz.,ha avuto una diffusione limitatissima in campo otoneurologico, anche se resta una tecnica interessante .
3e)Test ad accelerazione sinusoidale
Rappresenta un’evoluzione dal punto di vista tecnico in quanto eseguita mediante specifiche sedie guidate da un software in grado di avvicinare il più possibile le stimolazioni al range di normale attività del VOR. Esistono stimolazioni mono e multifrequenziali. I test rotatori ad accelerazione sinusoidale utilizzano in genere accelerazioni armoniche (SHA): Sinusoidal Harmonic Acceleration (Mathog, 1972), che è la prova roto-acceleratoria più utilizzata negli USA, in particolare le frequenze di oscillazione 0.01, 0.02, 0.04, 0.08, 0.16, 0.32 e 0.64 Hz, con velocità angolare massima di 50° / secondo per ciascuna frequenza.
Anche in questo caso la rotazione oraria induce l'eccitazione del labirinto destro e la contemporanea inibizione del sinistro e viceversa.
La risposta del VOR ai test rotatori viene descritta da tre parametri delle risposte a 5 stimoli (0,01, 0,02, 0,04, 0,08 e 0,16 Hz) ad una velocità massima di 50°/s (nel caso di sospetta areflessia labirintica bilaterale può essere portata fino a 100°/s:
a) Guadagno: rapporto fra la velocità massima degli occhi e la velocità massima della testa;
b) Ritardo (fase) in risposta allo stimolo: costante di tempo nell'accelerazione impulsiva (tempo, espresso in secondi, perché la velocità massima della fase lenta del ny declini al 37% del suo valore massimo) e angolo di fase nell'accelerazione sinusoidale (misura della relazione temporale fra la massima velocità degli occhi e quella della testa).
c) Simmetria: rapporto della velocità massima degli occhi nella rotazione vero destra e verso sinistra: (VAFLdx-VAFLsn) / (VAFLdx+VAFLsn) x100. Questo tipo di prova riveste un ruolo importante nel tentativo di ottenere una diagnosi topografica della lesione: infatti uno sfasamento tra la curva relativa all’andamento della VAFL e quella della velocità angolare della sedia interesserebbe tutte le frequenze nel caso di patologia centrale, mentre sarebbe limitato alle basse frequenze di stimolo nelle vestibolopatie periferiche; inoltre, nel tempo, a differenza della patologia centrale, in caso di lesione periferica le risposte tenderebbero a divenire più simmetriche (Probst e al., 1983).
I moderni test rotatori consentono di valutare, oltre allo studio del VOR, anche l'interazione fisiologica tra il riflesso vestibolo-oculare e il riflesso visuo-oculare. Questo è possibile facendo ruotare il paziente ad occhi aperti in un ambiente illuminato, mantenuto stazionario, costituito in genere dalle strisce verticali del tamburo otticocinetico (interazione sinergica fra i riflessi vestibolo e visuo-oculare: Vis-VOR) e, ancora, facendolo ruotare in maniera solidale con le strisce del tamburo otticocinetico oppure mentre fissa una mira luminosa attaccata alla sedia e posta di fronte a lui (interazione antagonista fra i riflessi vestibolo e visuo-oculare: VOR-Fix).
IL Test con sedia Rotatoria è sensibile alle basse di frequenze medie (0,01-1,28 al Hz).
 IL Test con
sedia Rotatoria (RCT) Fig.24
IL Test con
sedia Rotatoria (RCT) Fig.24
è una comune alternativa per il monitoraggio disturbi vestibolari progressivi nei bambini. RCT viene utilizzato per monitorare disfunzione del sistema vestibolare e compensazione nel tempo. Inoltre, RCT viene utilizzato per valutare e monitorare la debolezza bilaterale vestibolare. In generale, i protocolli RCT sono più comodo e più facilmente tollerato dai bambini, rispetto ai test calorico tradizionali. In particolare, i bambini piccoli di solito può sedersi in braccio a un genitore durante i test di rotazione, e il nistagmo risultante è di solito meno intenso di quello che potrebbe essere stato provocato tramite test calorico.
Quando viene utilizzato insieme con VNG, RCT completa la batteria di test per le valutazioni diagnostiche vestibolari. I vantaggi del RCT includono l'assenza di trasferimento di energia termica (che è di grande importanza per quanto riguarda la o test calorico bitermico), e valuta i RCT precisamente frequenze multiple basate su stimoli di rotazione (prove caloriche valutano solo le frequenze molto lente di circa 0,003 Hz). Fife et al 11 ha osservato in caso di sospetto e diagnosticato iporeflettività vestibolare bilaterale, RCT è preferita per i bambini di età compresa tra 3 e 10 anni.
|
|
|
|
|
|
|
Fig.25.B1-2-3. Valutazione della funzione vestibolare. Oscurità completa, sedia girevole pilotata da computer. Esame EVAR-OVAR: Impulsi rotatori secondo un asse verticale o EVAR (Earth Vertical Axis Rotation): accelerazione a 40°/s 2. Rotazione secondo un asse inclinato rispetto alla gravità od OVAR (Off Vertical Axis Rotation):rotazione a 60°/s, e 13° di inclinazione//gravità. |
|
Impulsi rotatori secondo un asse verticale (Figura 26 A,) [4] Tanzariello
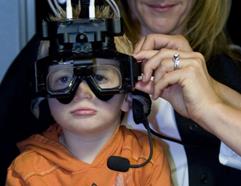 Il soggetto è seduto su una sedia girevole nell'oscurità. Questa sedia permette
di applicare brevi accelerazioni e decelerazioni angolari secondo un asse
verticale (40°/s2, per 1,5 s) le quali sono seguite da una velocità
di rotazione costante. Questi impulsi rotatori producono rispettivamente un
eccitamento e un'inibizione dei canali semicircolari esterni e una risposta
vestibolo-oculare che verrà registrata e misurata (velocità delle fasi lente e
durata della risposta). Questa risposta raggiunge molto rapidamente un massimo,
quindi decresce progressivamente in 20-60 secondi in funzione dell'età del soggetto
(meno di 18-20 sec nel bambino molto piccolo, più spesso 20 sec nell'adulto
giovane). Un interessamento del vestibolo si manifesta con un'assenza di
risposta dal lato colpito o con una diminuzione della risposta in ampiezza e in
durata. Un'asimmetria delle risposte è segno di una lesione monolaterale. I
processi di compensazione centrale cancelleranno progressivamente questa
asimmetria, a spese tuttavia della durata delle risposte che sono allora molto
brevi dai due lati (il che indica una grande probabilità di inibizione centrale).
Il soggetto è seduto su una sedia girevole nell'oscurità. Questa sedia permette
di applicare brevi accelerazioni e decelerazioni angolari secondo un asse
verticale (40°/s2, per 1,5 s) le quali sono seguite da una velocità
di rotazione costante. Questi impulsi rotatori producono rispettivamente un
eccitamento e un'inibizione dei canali semicircolari esterni e una risposta
vestibolo-oculare che verrà registrata e misurata (velocità delle fasi lente e
durata della risposta). Questa risposta raggiunge molto rapidamente un massimo,
quindi decresce progressivamente in 20-60 secondi in funzione dell'età del soggetto
(meno di 18-20 sec nel bambino molto piccolo, più spesso 20 sec nell'adulto
giovane). Un interessamento del vestibolo si manifesta con un'assenza di
risposta dal lato colpito o con una diminuzione della risposta in ampiezza e in
durata. Un'asimmetria delle risposte è segno di una lesione monolaterale. I
processi di compensazione centrale cancelleranno progressivamente questa
asimmetria, a spese tuttavia della durata delle risposte che sono allora molto
brevi dai due lati (il che indica una grande probabilità di inibizione centrale).
Test della rotazione intorno a un asse inclinato o test RAIG Figura 26 B
Si tratta di uno studio della funzione otolitica stimolata da rotazioni a velocità costante intorno a un asse inclinato rispetto alla gravità, chiamato Raig o off vertical axis rotation (OVAR). È lo studio delle risposte nistagmiche otolitiche generali. Questa stimolazione vestibolare otolitica viene realizzata con una sedia rotatoria inclinabile guidata da un computer
Fig.26.B Questa Mega Torque è una sedia rotatoria con asse di rotazione fuori dall’asse verticale per il test degli Otoliti.
Fig.26.C Il principale vantaggio clinico ,del test rotazionale informatizzato, è la capacità di produrre accelerazioni angolari che possono essere controllati e ripetuti . Stimoli multipli di varia intensità possono essere applicati al sistema vestibolare entro un tempo relativamente breve. Questi test permettono la valutazione del riflesso vestibolo-oculare e del percorsi neurale del sistema otticocinetico in un modo che non si ripetano procedure alternative.
Test OVAR o test RAIG: la poltrona girevole sulla quale il soggetto è seduto nell'oscurità è ruotata a velocità costante secondo un asse inclinato rispetto alla gravità. Questo movimento produce una stimolazione generale del sistema otolitico e in ritorno una risposta vestibolo-oculare che è registrata e misurata. Fig. 2-27 A,B
|
Figura 27. EVAR (Earth Vertical AxisRotation ) test: impulsi rotatori//asse verticale. A. La poltrona ruota rispetto a un asse verticale con un'accelerazione iniziale di 40°/s 2 seguita da una velocità di rotazione costante (60°/s durante la rotazione e 0 % dopo la rotazione). B. Il tracciato in basso mostra l'evoluzione nel tempo della velocità degli occhi, che passa attraverso un massimo seguito da una riduzione progressiva in 20 secondi dopo l'accelerazione iniziale.
|
Test di rotazione inclinata rispetto alla gravità (Figura 29 A, B)
|
|
Figura 29. OVAR test (Off Vertical Axis Rotation: : valuta la funzione otolitica) o test RAIG.
A. La sedia è inclinata di 13° rispetto alla gravità e ruotata a una velocità costante di 60°/s (secondo Darlot C et al. Exp Brain Res 1988). B. I due tracciati in basso mostrano le caratteristiche delle componenti orizzontali e verticali della risposta vestibolo-oculare otolitica in risposta a una rotazione OVAR oraria OVAR. La modulazione dei movimenti oculari (in posizione nonché in velocità delle fasi lente) è sincronizzata con la posizione della sedia durante la rotazione.
|
Test di rotazione intorno a un asse inclinato rispetto alla gravità o test RAIG
(Figura 30 A, B)
Test OVAR o test RAIG: la poltrona girevole sulla quale il soggetto è seduto nell'oscurità è ruotata a velocità costante secondo un asse inclinato rispetto alla gravità. Questo movimento produce una stimolazione generale del sistema otolitico e in ritorno una risposta vestibolo-oculare che è registrata e misurata. [4, Wiener-Vacher et al.,1994/6; Wiener-Vacher S.R., 2001 5, 6, 7, 8]

Si tratta di uno studio della funzione otolitica stimolata da rotazioni a velocità costante intorno a un asse inclinato rispetto alla gravità, chiamato Il test RAIG Off Vertical Axis Rotation (OVAR). È lo studio delle risposte nistagmiche otolitiche generali. Questa stimolazione vestibolare otolitica viene realizzata con una sedia rotatoria inclinabile guidata da un computer
La risposta vestibolo-oculare è registrata, al buio, con elettronistagmografia o video-oculografia. La sedia è sottoposta a un'accelerazione rotatoria breve, quindi a un movimento rotatorio costante (60°/secondo) in base a un asse verticale; vengono quindi stimolati i canali semicircolari orizzontali. A velocità di rotazione costante, la risposta canalare si annulla progressivamente. La sedia è allora inclinata di 13° rispetto alla gravità, sempre a velocità costante di 60°/secondo ; viene quindi stimolato, in maniera elettiva, l'apparato vestibolare otolitico. La stimolazione è effettuata in senso orario e antiorario. L'analisi del nistagmo indotto da questa stimolazione permette di analizzare il funzionamento dei sistemi otolitici di destra (rotazione oraria) e di sinistra (rotazione antioraria). La risposta oculare dovuta a questa stimolazione è un nistagmo complesso che comprende una componente orizzontale, una componente verticale e una componente di torsione del bulbo oculare. Le risposte sono registrate sul piano orizzontale e sul piano verticale: le velocità delle fasi lente del nistagmo descrivono una modulazione in funzione del ciclo di rotazione della sedia. I parametri misurati sono l'ampiezza della modulazione delle componenti verticali e orizzontali e la componente continua (o bias che corrisponde alla deviazione della media della sinusoide rispetto allo zero).
Il test RAIG è utile per definire le patologie del sistema otolitico
In caso di patologie vestibolari acute (neuriti, labirintectomia) poiché i fenomeni di compenso centrale cancellano rapidamente le asimmetrie delle risposte al test RAIG e mascherano in tal modo il deficit otolitico; queste asimmetrie all'esame RAIG permettono di distinguere le malattie vestibolari complete (canalari e otolitiche) o parziali (solo canalari); queste ultime riescono a recuperare più facilmente;
In caso di interessamento vestibolare fluttuante, dove il carattere fluttuante della lesione impedisce il compenso centrale; per esempio, nelle fistole perilinfatiche traumatiche, Il test RAIG evidenzia una preponderanza direzionale diretta verso il lato leso, segnale di irritabilità otolitica che può indicare la presenza di una fistola
PROVE PENDOLARI AD ACCELERAZIONE DECELLERAZIONE SINUSOIDALE
1e)Test pendolare rotatorio sinusoidale smorzato stimolazione
mantenuta(Grenier)
2e)Test pendolare sinusoidale a scansione di frequenza
3e)Test ad accelerazione sinusoidale
1e) La prova di stimolazione rotoacceleratoria pendolare o sinusoidale o Test pendolare rotatorio sinusoidale smorzato (Grenier)
La prova di stimolazione pendolare è stata applicata per la prima volta da Kreidl nel 1872 per lo studio della reflettività labirintica ed è entrata nella routine otoneurologica qualche decennio fa (1955) per merito di Hennebert e successivamente di Greiner e Conraux (1960). Questa prova si rifà al principio del pendolo di torsione, un sistema fisico che genera delle oscillazioni rotatorie sinusoidali di periodo costante e di ampiezza progressivamente ridotta. La risposta nistagmica riflette il grado di attivazione dei recettori cupolari dei canali semicircolari laterali dell’uno e dell’altro labirinto in rapporto alla dinamica della corrente endolinfatica. Durante l’oscillazione della sedia in senso orario, il flusso dell’endolinfa nel canale semicircolare laterale di destra sarà diretto in senso ampullopeto, durante l’oscillazione in senso antiorario il flusso dell’endolinfa sarà invece ampullipeto in quello di Sinistra.
Per eseguire la stimolazione, il paziente viene sistemato sulla sedia col capo flesso in avanti di 30° e ben fissato per impedirne ogni movimento. Gli occhi rimangono aperti sotto gli occhiali di Bartels o di Frenzel. Durante la rotazione, l’ambiente deve essere completamente oscuro e silente per evitare fenomeni d’interferenza d’origine otticocinetica e audio cinetica. Dopo aver ruotato la sedia dalla sua posizione normale di equilibrio fino a raggiungere un angolo di ampiezza di 180°, la si lascia libera di compiere una serie di oscillazioni sinusoidali dirette alternativamente in senso orario e antiorario. Tali oscillazioni, a causa dello smorzamento impresso alla sedia, tendono nel corso di 15 periodi, ciascuno della durata di 20 sec., a ridursi progressivamente di ampiezza. Sul grafico, all’inizio della oscillazione della sedia, compare una reazione oculomotoria documentata da una deviazione cupoliforme della penna scrivente. Tale deviazione corrisponde allo spostamento tonico degli occhi che si muovono lentamente nella direzione contraria al senso della rotazione. Successivamente, compaiono sul grafico le prime scosse del nistagmo che, dopo 2-3 sec., raggiungono il valore massimo sia di ampiezza che della velocità angolare della fase lenta. Questi valori permangono tali per 2/3 della durata dell’oscillazione della sedia. Poi si riducono in modo rapido e alla fine della oscillazione il nistagmo cessa completamente. Con l’inizio della successiva rotazione della sedia nella direzione opposta, ricompaiono sul grafico il movimento tonico degli occhi, già in precedenza osservato, ma di opposta polarità e successivamente le scosse nistagmiche che si succedono con le stesse caratteristiche di quelle precedenti (Fig. 31).

Fig. 31 -
Metodo di stim. labirintica rotoacceleratoria pendolare sul piano orizzontale.
A) L’accelerazione ang. positiva da rot. oraria determina una depolarizzazione
del recettore ampollare del can. sem. lat. di destra e l’attivazione dell’area
nucleare omolaterale (ANV) con la comparsa di un nistagmo diretto verso destra
(![]() )
B) Analoga è la reazione vestibolare a seguito di una stim. rotatoria
antioraria ma di segno opposto (
)
B) Analoga è la reazione vestibolare a seguito di una stim. rotatoria
antioraria ma di segno opposto (![]() ).
(da Greiner G., Conraux C., Collard M., 1969). da Babighian-Otoneurologia-
Piccin- 2008.
).
(da Greiner G., Conraux C., Collard M., 1969). da Babighian-Otoneurologia-
Piccin- 2008.
Esso presenta le seguenti caratteristiche: un periodo di 20 secondi (frequenza 0,05 Hz), un'ampiezza massima di 180°, uno smorzamento esponenziale in 15 periodi, un'accelerazione in partenza di 18°/s2. Il movimento oculare è registrato contemporaneamente al movimento della poltrona. Il parametro studiato è il più delle volte la velocità media della fase lenta del nistagmo, calcolata mediante computer, o l'ampiezza cumulativa del movimento dell'occhio. Quest'ultima è ottenuta addizionando le fasi lente e sopprimendo le fasi rapide. Il tracciato cumulativo ha allora la forma di un sinusoide smorzato sovrapponibile al movimento della poltrona. Sono allora misurati il guadagno e la fase del RVOH. Nel soggetto normale, essi sono rispettivamente vicini a 0,6 per il guadagno e a 10° per la fase. Questo test ha il vantaggio di essere rapido, ma esamina il sistema vestibolare soltanto nel campo delle risposte a basse frequenze, mentre può rispondere a un'ampia gamma di frequenze che vanno da 0,01 Hz a 20 Hz.
Si studia anche nel corso di questo test l'indice di inibizione del nistagmo con fissazione oculare (IFO). In questo caso, si chiede al soggetto di fissare un bersaglio luminoso posto nella maschera di videonistagmografia mentre è sottoposto a questa rotazione. La fissazione oculare induce un'inibizione di oltre il 50% del guadagno del RVOH. Un IFO superiore al 50% è sempre segno di una patologia vestibolare centrale, ma non ha un valore localizzatorio preciso.
In caso di distruzione acuta e unilaterale di un labirinto, si osserva una diminuzione bilaterale del guadagno del RVOH a questo test a basse frequenze, più marcata per le rotazioni verso il lato leso che per quelle verso il lato sano. A distanza, queste alterazioni a basse frequenze (0,05 Hz) scompaiono il più delle volte grazie al compenso vestibolare centrale il che, al contrario delle prove caloriche, limita l'interesse di questo esame quando è eseguito a distanza dalla lesione.

Fig.32
a
velocità angolare
progressivamente
smorzata
Fig 32 a -
Elettro nistagmogramma pendolare di un soggetto normale I due estratti della
curva sono stati rilevati verso i 90 di ampiezza massima del quadro all’inizio
della prova (tracciato superiore) e in prossimità della soglia, verso il
termine della prova (tracciato inferiore) La velocità di scorrimento della
carta è di l5mm al secondo Taratura dei movimenti oculari: lOmm per 10’ di
ampiezza del globo oculare
Su ciascun tracciato, dall’alto in basso:
- la registrazione dei movimenti orizzontali a corrente alternata (A.C ) Costante di tempo: 0,1 Le deflessioni dell’occhio a destra si iscrivono verso l’alto; le deflessioni a sinistra verso il basso;
- la registrazione dei movimenti orizzontali a corrente continua (CC ) Stessa convenzione per il senso del nistagmo;
- il movimento della sedia e la linea
isoelettrica, posizione di equilibrio del quadro pendolare;
- la registrazione dei movimenti verticali in corrente alternata (A C 0,1) I
movimenti verticali superiori sono registrati verso l’alto, i movimenti
verticali inferiori verso il basso.

Fig. 33
A velocità angolare
costante
La prova viene condotta oltre che con accelerazioni sinusoidali di valore sopraliminare anche con valori liminari (ampiezza massima dell’oscillazione della sedia di 10°).
Il video Head Impulse Test (vHIT) Fig. 34.A-B
Il più semplice indicatore clinico di una funzione deficitaria dei canali semicircolari è l’Head Impulse test (altrimenti definito come Head Thrust test, oppure Halmagyi-Curthoys test o anche Halmagyi test). Ma la valutazione della risposta di questo semplice test clinico è affidata alla soggettività dell’operatore che lo esegue, il quale deve riuscire a riconoscere una piccola saccade di rifissazione che segue un brusco movimento del capo in un piano dello spazio, di solito quello orizzontale.
 Il
video Head Impulse Test che descriviamo in questo articolo è un nuovo
indicatore di tipo oggettivo, in grado di fornire all’operatore una prova
“stampata su carta” della performance del paziente, grazie ad un sistema di videoregistrazione.
Prima di descrivere questo nuovo strumento diagnostico, è utile definire la
procedura del test e la logica che ne è alla base e ne costituisce il
fondamento
Il
video Head Impulse Test che descriviamo in questo articolo è un nuovo
indicatore di tipo oggettivo, in grado di fornire all’operatore una prova
“stampata su carta” della performance del paziente, grazie ad un sistema di videoregistrazione.
Prima di descrivere questo nuovo strumento diagnostico, è utile definire la
procedura del test e la logica che ne è alla base e ne costituisce il
fondamento
Questo segno clinico rivelato grazie ad un’accelerazione del capo è stato descritto per la prima volta da Halmagyi e Curthoys nel 1988 (Halmagyi et al, 1988) e da quel momento ad oggi l’uso clinico del test impulsivo del capo è stato ed è ampiamente utilizzato per valutare la funzione del canale deficitario da parte del clinico (con una valutazione soggettiva) per determinare se vi sia una overt saccade oppure no. Tuttavia, alcuni pazienti con deficit vestibolare non venivano opportunamente valutati con il test impulsivo del capo, in quanto anche osservatori esperti non erano in grado di rivelare movimenti saccadici evidenti, probabilmente a causa della presenza delle saccadi segrete, le covert saccades che abbiamo descritto sopra. Evidentemente l’ideale sarebbe avere misure oggettive di entrambi i movimenti della testa e la simultanea risposta del movimento degli occhi, con un sistema sufficientemente veloce ed il più possibile accurato, per la rilevazione delle cosiddette saccadi “segrete”. Il metodo con search coils è in grado di ottenere e raggiungere questo scopo, ma è clinicamente del tutto irrealistico da applicare, essendo una metodologia invasiva e molto costosa (Delori et al, 2007). Tendendo presente questa limitazione, abbiamo sviluppato una nuova procedura strumentale applicabile in ambito clinico, grazie ad un leggerissimo sistema video ideato da Hamish G. MacDougall ricercatore del Vestibular Research Laboratory presso la School of Psychology della University of Sydney, NSW, Australia ( Fig 2-16).
Abbiamo chiamato tale test con il nome di video Head Impulse Test (vHIT). Tale metodica è ampiamente e facilmente applicabile in ambito clinico.
 Ma
cosa ancora più importante, abbiamo dimostrato, grazie a misurazioni empiriche,
che la precisione del vHIT corrisponde a quella della tecnica con search
coils. Il vHIT è stato quindi validato da misure dirette in simultanea di
performance VOR, in soggetti sani e in pazienti con deficit vestibolare, con i
due metodi in maniera indipendente: search coils vs vHIT (Weber et al,
2008; Weber et al, 2009 b).
Ma
cosa ancora più importante, abbiamo dimostrato, grazie a misurazioni empiriche,
che la precisione del vHIT corrisponde a quella della tecnica con search
coils. Il vHIT è stato quindi validato da misure dirette in simultanea di
performance VOR, in soggetti sani e in pazienti con deficit vestibolare, con i
due metodi in maniera indipendente: search coils vs vHIT (Weber et al,
2008; Weber et al, 2009 b).
La procedura è essenzialmente quella descritta sopra, come originariamente proposta nel 1988 per l’Head Impulse test (Halmagyi et al, 1988), salvo che il paziente indossa un paio di occhiali super leggeri su cui è montata una piccola, ultra-leggera, super veloce, videocamera ad altissima velocità (250Hz) e un mezzo specchio argentato che riflette l’immagine dell’occhio del paziente alla telecamera (Fig 34B).
Un piccolo sensore–accelerometro è posto sugli occhiali ed ha il compito di misurare e quantificare il piano ed il movimento della testa.
L’intero sistema (maschera) è leggero (pesa circa 60 g) e deve essere fissato saldamente alla testa del paziente tramite una piccola cinghia, per ridurre al minimo la possibilità di slittamento/scivolamento. Infatti qualsiasi slittamento degli occhiali sarebbe registrato come un movimento degli occhi ed in tal modo si potrebbero generare e registrare artefatti.
Nei test, l’esaminatore effettua prima una taratura veloce in cui il paziente deve guardare alternativamente due spot laser proiettati dagli occhiali stessi sulla parete posta di fronte all’esaminando. Poi il medico chiede al paziente di cominciare a fissare un obiettivo, piccolo spot fisso sulla parete ed inizia ad imporre al capo del paziente brusche, imprevedibili dotazione della stessa nel piano orizzontale con un piccolo angolo di escursione. Le mani del medico (Fig. 34.A-B) devono essere tenute ben lontano dagli occhiali e della maschera come pure dalla cinghia che fissa l'apparato
Ciò è necessario per ridurre al minimo la possibilità che si possono realizzare i movimenti della macchina. Il movimento l'avesse misurato l'sensore posto sugli occhiali e l'immagine dell'occhio viene catturata dalla videocamera all'alta velocità 250 Hz. Tali dati vengono poi elaborati da un software molto veloce, in grado di registrare ed acquisire oltre da della lucida degli occhi anche quelle della testa ed assemblarli simultaneamente insieme. Alla fine di ogni rotazione la testa lo stimolo velocità della testa e la velocità di disposto dell'occhio sono poco visualizzati contemporaneamente sullo schermo. In tal modo si può valutare immediatamente, per ogni rotazione della testa quanto funzionano stimolo e la risposta oculare. In un testo completo di solito vengono effettuati 20 impulsi casuali in ogni direzione e ciò può durare in genere 2 o 3 minuti. Al termine della prova tutti gli stimoli, la velocità della testa e la velocità di risposta dell’occhio, sono sovrapposti e visualizzati sullo schermo del computer, insieme a un grafico del guadagno VOR (Fig. 35).
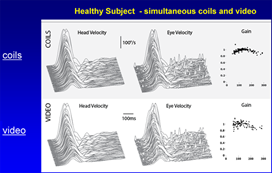 Fig.
35
Fig.
35
Il guadagno del VOR rappresenta il rapporto tra la velocità dell’occhio in risposta alla velocità della testa. Questo rapporto dovrebbe essere idealmente pari a 1,0. In pratica però non è proprio così; infatti volontari sani hanno tipicamente un guadagno del VOR inferiore ad 1,0 (ovvero un valore di circa 0,8-0,9). Ma con il vHIT una risposta insufficiente o asimmetria di risposta VOR è facilmente visibile. Così nello spazio di meno di 5 minuti l’operatore ottiene una misura oggettiva del funzionamento del VOR per entrambi i sensi di rotazione. La videocamera a 250Hz è sufficientemente e sorprendentemente veloce per garantire che le covert saccades possano essere rilevate e siano facilmente visibili sulle tracce sovrapposte (Figura 35).
Sintomi: vertigine rotatoria grave e prolungata, il movimento della testa accentua i sintomi, squilibrio posturale sul lato della lesione, nausea e nistagmo spontaneo orizzontale/torsionale battente verso l’orecchio sano.
Se Impulse identifica movimenti saccadici di recupero e c-VEMP od o-VEMP sono anomali, il test è completo. I movimenti saccadici di recupero nei canali laterali o anteriori e un test oVEMP anomalo indicano neurite vestibolare superiore. I movimenti saccadici di recupero nei canali posteriori e un test cVEMP anomalo indicano neurite vestibolare inferiore.
Impulse:
presenza di movimenti saccadici di recupero (nascosti o evidenti) e guadagno VOR ridotto.
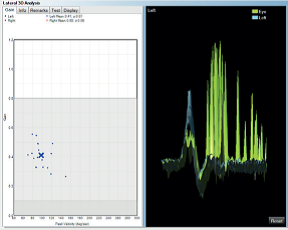
cVEMP:
riduzione di ampiezza sul lato interessato.
(Si noti che nei campi di neurologia e neurofisiologia, per convenzione si pone P1 (ad esempio p13) come deflessione verso il basso e N1 (ad esempio n23) come deflessione verso l’alto, ovvero il contrario di quanto illustrato sotto.)
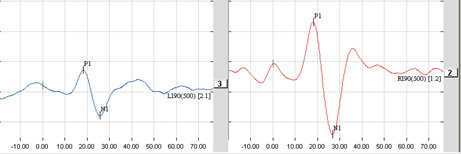
oVEMP:
risposta controlaterale assente al lato della lesione durante la stimolazione ipsilesionale.
(Si noti che nei campi di neurologia e neurofisiolo-gia, per convenzione si pone N1 (ad esempio n10) come deflessione verso l’alto, ovvero il contrario di quanto illustrato sotto.)
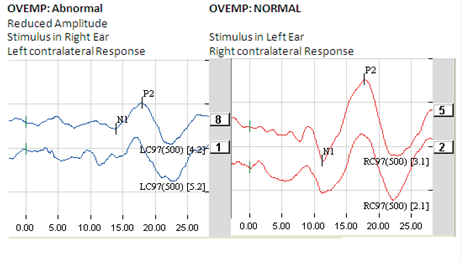
Stimolazioni Termiche:
marcata iporeflettività unilaterale

Neurite vestibolare superiore (riguarda i canali laterale e anteriore)
Neurite vestibolare inferiore (riguarda il canale posteriore)
Misurazione della verticale soggettiva (Figura 36.A.-B.-C.)
 Questa
prova è usata per valutare la funzione del otricolo, un altro sensore otolite
nell'orecchio interno È una misura che valuta la precisione con cui un
soggetto seduto nell'oscurità può porre in posizione verticale una barra
fosforescente con l'aiuto di un comando a distanza con una precisione di +/-
2°. Questo test è applicabile solo ai bambini di età superiore a 7-8 anni. I
bambini più piccoli non hanno la nozione di verticale fino all'età di 2-3 anni
e non possono quindi eseguire il compito, i bambini di 4-8 anni sono molto
imprecisi nel riprodurre la verticale in tali condizioni (precisione di +/-
4°). Una lesione recente (meno di 3 mesi) della parte otolitica del vestibolo
si manifesta con una deviazione della percezione della verticale soggettiva dal
lato della lesione vestibolare. I fenomeni di compensazione normalizzano in
seguito questi risultati.
Questa
prova è usata per valutare la funzione del otricolo, un altro sensore otolite
nell'orecchio interno È una misura che valuta la precisione con cui un
soggetto seduto nell'oscurità può porre in posizione verticale una barra
fosforescente con l'aiuto di un comando a distanza con una precisione di +/-
2°. Questo test è applicabile solo ai bambini di età superiore a 7-8 anni. I
bambini più piccoli non hanno la nozione di verticale fino all'età di 2-3 anni
e non possono quindi eseguire il compito, i bambini di 4-8 anni sono molto
imprecisi nel riprodurre la verticale in tali condizioni (precisione di +/-
4°). Una lesione recente (meno di 3 mesi) della parte otolitica del vestibolo
si manifesta con una deviazione della percezione della verticale soggettiva dal
lato della lesione vestibolare. I fenomeni di compensazione normalizzano in
seguito questi risultati.
|
|
|
|
Fig. 36.-B.-C.. Verticale e orizzontale soggettive. Prima dei 4 anni la nozione di verticalità non è compresa, mentre il corpo può riprodurre la verticale. Da 4 a 8 anni la verticalità può essere riprodotta ma con una grande variabilità di valutazione: ± 4°. Dopo gli 8 anni, il test è effettuato con la stessa precisione che nell'adulto: ± 2 °.
|
|
Valutare la Funzione otolitica del Sacculo e utricolo
Per valutare il sacculo e il ramo inferiore del nervo vestibolare, Potenziale Evocato Vestibolari Miogenico Cervicale (c-VEMPs) si sono rivelate utili, anche per bambini molto piccoli. Per quanto riguarda la valutazione del utricolo e il ramo superiore del nervo vestibolare, i Potenziali Vestibolari Evocati Miogenica Oculare (o-VEMPs) sono state registrati nei bambini di 1 mese di età.
Potenziale Evocato Vestibolari Miogenico Cervicale (cVEMPs) o Potenziali miogeni sacculo-collici (o PEOM: potenziali evocati otolitici miogeni) (Figura 29 A, B)
Le vie vestibolospinali sono stimolate con l'aiuto di impulsi sonori (tone burst) o di click di forte intensità (da 100 a 110 dB) distribuiti al livello di ogni orecchio. Si registra l'effetto di questa stimolazione sulla contrazione attiva dei muscoli sternocleidomastoidei registrata mediante elettromiografia. Un'assenza di risposta significa una lesione della via sacculo-spinale. Si può eseguire questo esame nel bambino non appena egli è capace di mantenere eretto il capo (a partire dai 3-4 mesi). La contrazione attiva dei muscoli è ottenuta inclinando all'indietro il bambino che è seduto sulle ginocchia di un genitore o se è più grande e cooperante (> 5-6 anni) chiedendogli di appoggiarsi sulla mano dell'esaminatore con il mento. [7] Per quanto riguarda la valutazione del utricolo e il ramo superiore del nervo vestibolare, oculare Evocati Miogenica Potenziali (o-VEMPs) sono state registrate nei bambini di 1 mese di età.
|
|
||
|
Fig.29.A,B.C. Pannello sinistro mostra un c-VEMPs (in alto) e o-VEMPs (in basso) registrati dall'orecchio sinistro ed il pannello di destra mostra un c-VEMPs (in alto) e o-VEMPs (in basso) registrato dall'orecchio destro. Lo stimolo era uno tono-pipe di 500 Hz presentato a 100 dB NHL. (A): IL c-VEMP è costituito da un picco iniziale positivo registrato a ~ 13 msec (P1) seguito da un picco negativo registrato a ~ 23 msec (N1). (B): Al contrario del c-VEMPs, l’ o-VEMPs è costituito da un picco negativo iniziale registrato a ~ 10 msec (N1) seguito da un picco positivo registrato a ~ 15 msec (P1). c’è una differenza di scala tra le forme d'onda c-VEMPs e o-VEMPs. Il c-VEMPs è notevolmente più grande del o-VEMPs, molto probabilmente perché il muscolo sternocleidomastoideo SCM è un muscolo più grande del muscolo obliquo inferiore.
|
Fig. 38.A-B Potenziali evocati otolitici miogeni (PEOM) o Vestibular Evoked Myogenic Potentials (VEOM). A. Tone burst : 6,6 ms, 750 Hz, 5/s, > 95 dB. Contrazione attiva a testa girata verso il lato opposto allo stimolo.
|
|
B. Metodi per ottenere una contrazione attiva dei muscoli del collo nel bambino. Il bambino è seduto sulle ginocchia di un genitore, con il tronco inclinato all'indietro mentre si sostiene la parte alta della schiena; il bambino tenta di raddrizzarsi per afferrare il giocattolo. Il bambino si appoggia sul pugno quando ruota la testa verso il lato opposto alla stimolazione per aumentare l'ampiezza della contrazione del muscolo sternocleidomastoideo di cui vede il tracciato elettromiografico sullo schermo.
|
Sheykholeslami, Megerian, Arnold, e Kaga (2005) raggiunti con successo tracciati VEMP con neonati in genere in via di sviluppo e con un gruppo che dimostra risultati clinici. Onda morfologia è risultata simile a quella degli adulti, anche se latenze apparivano brevi e ampiezze erano più variabili di quelli osservati con gli adulti. Kelsch e colleghi (2006) hanno registrato il VEMP nei bambini 3-11 anni di età, trovando anche latenze più brevi rispetto agli adulti. Hanno concluso che si tratta di una misura ben tollerato per lo screening funzione vestibolare nei bambini. Valente (2007) eseguito con successo i test VEMP con gruppi di età prescolare e bambini preadolescenti, seguendo le procedure accuratamente descritte da Akin e Murnane (2000). Gli stimoli utilizzati per ottenere registrazioni erano 500 tonebursts Hz e clic. Le forme d'onda più robusti stati suscitato tramite Hz stimolo 500, e sono state calcolate ampiezza misura normalizzate. Nessun effetto di età sono stati osservati con P1 o latenze di forma d'onda N1 tra i due gruppi di bambini, anche se entrambi i gruppi hanno dimostrato latenze significativamente più brevi rispetto ai dati normativi adulti. Tra le altre raccomandazioni erano che sviluppare metodi per monitorare e uniformare il livello di contrazione del collo nei bambini, poiché questo può introdurre variabilità nella interpretazione della ampiezza misura P1-N1. Questa zona è stata studiata negli adulti, con l'applicazione di elettrodi aggiuntivi e software per monitorare i livelli di attività EMG (Akin & Murnane, 2000). Può essere utile avere un bambino seduto su un giro genitore per le prestazioni di VEMP. Inoltre, simultanee, registrazioni bilaterali possono essere più efficace con i bambini che tradizionali registrazioni adulti unilaterali.
Potenziale Vestibolare Evocati Miogenica Oculare (o-VEMPs)
Un nuovo test per lo studio della funzione utriculare è stato recentemente introdotto e validato, cioè il potenziale evocato miogenico vestibolare oculare (o-VEMPs), che si riferisce ai potenziali miogenici registrati da elettrodi EMG posizionati sotto entrambi gli occhi in risposta alla vibrazione ossea esercitata (BCV) sulla testa o a stimolazione acustiche per via aerea (ACS). L'o-VEMP è un potenziale a breve latenza, composto di risposte miogeniche extraoculari che vengono attivate dalla stimolazione sonora e registrati con elettromiografia di superficie tramite l’attivazione muscolare extraoculare otolitica ipsilaterale e controlaterale.( Kingma H. 2006 ; Leigh RJ., Zee DS.,1999; Park HJ.,et al., 2010; Rosengren SM., et al.,2008; Todd NP.,ET AL2007/8.) Il muscolo obliquo inferiore è il più superficiale dei sei muscoli estrinseci che sono responsabili dei movimenti oculari. Pertanto, la misurazione degli o-VEMPs può essere eseguita facilmente utilizzando elettrodi superficiali sulla pelle sotto gli occhi, ipsi e controlateralmente al lato stimolato. (Todd NP.,ET AL2008.) Dizziness Evaluation
|
|
n10 |
Fig. 39 A-B.Gli o-VEMPs sono molto più piccoli rispetto ai c-VEMP (solo circa 10 microvolt, contro i circa 50 microvolt ottenuti con i c-VEMPs)
Posturografia Dinamica Computerizzato (CDP) Fig. 40
La Sensory
Organizzazione Test (SOT) subtest della Posturografia dinamica computerizzata
(CDP) è stato studiato anche con i bambini. Il lettore ricorderà che
questo è considerato essere un test di equilibrio funzionale che misura i
contributi relativi dei sistemi visivi, propriocettivi e vestibolari. Ci
sono sei condizioni, con il primo è una linea di base in cui la cornice visiva
e la piattaforma sono stabili. Condizioni  diventano sempre più difficili in modo che il soggetto mantiene
l'equilibrio con l'utilizzo di segnali vestibolari solo durante le condizioni
di quinto e sesto. Di Fabio e Foudriat (1996) ha riferito che un bambino
piccolo, anche con tre anni di ’età può essere efficacemente testato con la
posturografia dinamica Computerizzato (CDP). Hirabayashi e Iwasaki (1995)
ha riferito che la funzione somatosensoriale raggiunge livelli di maturazione
all'età di tre o quattro anni. Il sistema visivo si sviluppa per
l'acutezza nell’adulto dai quindici anni di età, mentre il sistema vestibolare
è l'ultimo a svilupparsi. Shimizu et al. (1994) trovarono che i
punteggi pediatrici nei subtests SOT differivano significativamente da punteggi
degli adulti in molte condizioni. Colonne sonore Maschi 'hanno continuato
a migliorare, dopo sette anni, mentre decine di soggetti di sesso femminile
sono rimaste relativamente stabili. Rine et al. (2000) hanno condotto
studi con la CDP in bambini vecchi con 3-7 anni, trovando che questo test
fornisce informazioni utili relative ai sistemi sensoriali ed alla loro maturazione. Cyr
et al.(1988) ha studiato CDP in aggiunta a RC, avvertendo che CDP essere
utilizzato con i bambini quando si verificano le seguenti condizioni: la storia
di squilibrio, goffaggine secondo il rapporto dei genitori, coinvolgimento
neurologico, e sospetta malattia organica.
diventano sempre più difficili in modo che il soggetto mantiene
l'equilibrio con l'utilizzo di segnali vestibolari solo durante le condizioni
di quinto e sesto. Di Fabio e Foudriat (1996) ha riferito che un bambino
piccolo, anche con tre anni di ’età può essere efficacemente testato con la
posturografia dinamica Computerizzato (CDP). Hirabayashi e Iwasaki (1995)
ha riferito che la funzione somatosensoriale raggiunge livelli di maturazione
all'età di tre o quattro anni. Il sistema visivo si sviluppa per
l'acutezza nell’adulto dai quindici anni di età, mentre il sistema vestibolare
è l'ultimo a svilupparsi. Shimizu et al. (1994) trovarono che i
punteggi pediatrici nei subtests SOT differivano significativamente da punteggi
degli adulti in molte condizioni. Colonne sonore Maschi 'hanno continuato
a migliorare, dopo sette anni, mentre decine di soggetti di sesso femminile
sono rimaste relativamente stabili. Rine et al. (2000) hanno condotto
studi con la CDP in bambini vecchi con 3-7 anni, trovando che questo test
fornisce informazioni utili relative ai sistemi sensoriali ed alla loro maturazione. Cyr
et al.(1988) ha studiato CDP in aggiunta a RC, avvertendo che CDP essere
utilizzato con i bambini quando si verificano le seguenti condizioni: la storia
di squilibrio, goffaggine secondo il rapporto dei genitori, coinvolgimento
neurologico, e sospetta malattia organica.
Valente (2007) ha studiato la SOT e il test di controllo del motore (MCT)
con gli stessi due gruppi di bambini sopra descritti e confrontati i risultati
pediatrici con i dati normativi negli adulti. Una performance
significativamente peggiore si è riscontrata in tutte e sei le condizioni SOT
quando decine di giovani, -bambini in età pre-scolare sono stati confrontati
con quelli di anziani, bambini in età pre-adolescenziale. Allo stesso
modo, i punteggi significativamente diminuita sono stati visti in tutte le
condizioni in cui i risultati pediatrici di entrambi i gruppi di età sono stati
confrontati con i dati normativi adulti. Questi risultati sottolineano
l'importanza di studiare gli effetti della maturazione e di confrontare i
risultati pediatrici con dati normativi pediatrici. Con la MCT, il bambino
è fissato con i piedi sulla piattaforma e la piattaforma subisce inaspettato,
casuale in avanti e indietro le traduzioni. Le traduzioni sono di piccole,
medie e grandi grandezze con un metro di latenza in millisecondi
calcolati. Questa latenza rappresenta il tempo necessario dall'inizio del
movimento di piattaforma per la pressione dei tempi viene esercitata dai piedi
per mantenere l'equilibrio. Estensione della traduzione dipende altezza
del soggetto e, al momento dello studio è stato condotto, le raccomandazioni
del produttore attrezzature erano che il bambino pesano almeno 40 sterline per
azioni di ricerca ottimale affidabili. Valente (2007) adattato tecniche di
MCT e ha scoperto che la misura di latenza potrebbe anche essere raggiunto in
modo efficace con i bambini e ha contribuito ad pediatrici banche dati
normativi per questo sottotest.
Adattamenti per i bambini comprendono l'utilizzo dei più piccoli cablaggio e
l'implementazione di un interessante, il surround infantile. Con SOT,
affidabilità è migliorata con le prestazioni di tre prove di ogni
condizione. Durante i 20 secondi di ogni prova, un continuo rinforzo
positivo è essenziale. I bambini spesso si sentono anche che questa misura
è "guidare-like" e li rassicura sapere che non possono cadere e che
un genitore non è lontano.
Quali sono le cause di vertigine nel bambino?
I DISTURBI VESTIBOLARI SPECIFICI CHE CHE POSSONO VERIFICARSI DURANTE L'INFANZIA COMPRENDONO
Tra le diagnosi da ipotizzare in presenza di vertigini del bambino, la più frequente è quella di equivalenti emicranici (25%) (Figura 41 ): la vertigine si associa a cefalee, le precede, le accompagna o insorge in alternanza con le cefalee. Queste vertigini equivalenti emicranici sono spesso mal tollerati (nausea, vomito non sono eccezionali) e possono associarsi a fotofobia (sintomo caratteristico della natura emicranica dell'episodio). Gli episodi di vertiginii equivalenti emicranici possono durare diverse ore, verificandosi più spesso per fatica, alla fine della giornata. Gli esami otologici, vestibolare e neurologico sono rigorosamente normali. La frequenza e l'intensità degli equivalenti emicranici sono spesso aggravate dalla presenza di disturbi oftalmologici (disturbi della rifrazione misconosciuti e non corretti, disturbi della convergenza oculare). [9] Ogni equivalente emicranico dovrebbe subire una valutazione oculistica completa per eliminare questo fattore aggravante. Il trattamento degli equivalenti emicranici del bambino deve prima di tutto iniziare con l'eliminazione dei fattori aggravanti (problemi oftalmologici, igiene di vita, sonno corretto, riduzione dello stress, gestione psicologica se necessario) associata a trattamenti analgesici semplici (paracetamolo, antinfiammatori isolati o in associazione, acido acetilsalicilico). Questo solo atteggiamento terapeutico è spesso sufficiente a ridurre la frequenza e l'intensità delle crisi. Se queste misure preventive sono insufficienti, può essere efficace una terapia con derivati della segale cornuta a basse dosi, che però non può essere somministrata a lungo termine nel bambino. I derivati antiserotoninergici non sono autorizzati prima dell'età di 12 anni e saranno presi in considerazione esclusivamente nei casi refrattari.
|
|
|
Fig. 41. Diagnosi da ipotizzare in presenza di ver tigini del bambino. SNC: sistema nervoso centrale; VPPB: vertigine posizionale parossistica benigna.
|
|
Varianti dell’emicrania e complicazioni dell’emicrania: 1. torcicollo parossistico infantile 2. vomito ciclico 3. emicrania dell’arteria basilare 4. emicrania emiplegica familiare 5. emicrania addominale 6. vertigine idiopatica parossistica benigna |
A1.3.5.torcicollo parossistico benigno
Descrizione:
Episodi ricorrenti di inclinazione del capo da un lato, talora con lieve rotazione, a remissione spontanea. Tale condizione insorge in lattanti e bambini piccoli nel corso del primo anno di vita. Può evolvere nella 1.3.3 Vertigine parossistica benigna dell’infanzia o nella 1.2 Emicrania con aura, o andare incontro a remissione completa.
Criteri diagnostici:
A. Episodi accessuali, in un bambino piccolo, con tutte le caratteristiche seguenti e in accordo al criterio B:
1. inclinazione del capo da un lato (non sempre lo stesso), con o senza lieve rotazione
2. durata da minuti a giorni
3. remissione spontanea e tendenza a ricorrenza mensile
B. Durante gli attacchi, uno o più dei seguenti sintomi e/o segni:
1. pallore
2. irritabilità
3. malessere
4. vomito
5. atassia1
C. Esame neurologico negativo in fase intercritica
D. Non attribuito ad altra condizione o patologia
Nota:
1. L’atassia è più probabile in bambini di età più avanzata nell’ambito della fascia d’età affetta.
Commento:
Il capo del bambino può essere ricondotto alla posizione neutra nel corso degli attacchi: si può incontrare resistenza, ma essa può essere superata.
La forma A1.3.5 Torcicollo parossistico benigno può evolvere in 1.3.3Vertigine parossistica benigna dell’infanzia o in 1.2 Emicrania con aura (in particolare 1.2.6 Emicrania di tipo basilare).
Queste osservazioni necessitano di essere ulteriormente validate mediante la compilazione di diari da parte dei pazienti, interviste strutturate e raccolta prospettica dei dati. La diagnosi differenziale comprende il reflusso gastroesofageo, la distonia idiopatica da torsione e le crisi parziali complesse; è importante rivolgere particolare attenzione alla fossa posteriore e alla giunzione craniocervicale, le cui anomalie congenite o acquisite possono provocare torcicollo.
|
IHS |
Diagnosi |
ICD-10 |
|
1.3.1 |
Vomito ciclico |
G43.82 |
Descrizione:
Attacchi ricorrenti di vomito e nausea intensa, solitamente stereotipati nel singolo paziente, spesso associati a pallore e letargia. La sintomatologia si risolve completamente e i pazienti sono del tutto asintomatici nel periodo intercritico.
Criteri diagnostici:
A. Almeno 5 attacchi che soddisfino i criteri B e C
B. Attacchi episodici, stereotipati nel singolo paziente, di nausea intensa e vomito che perdurano da 1 ora a 5 giorni
C. Il vomito durante l’attacco si verifica come minimo 4 volte all’ora per almeno un’ora
D. Assenza di sintomi tra gli attacchi
E. Non attribuito ad altra condizione o patologia1
Nota:
1. In particolare vanno escluse patologie gastrointestinali attraverso l’anamnesi e l’esame obiettivo.
Commento:
Il vomito ciclico è una condizione episodica autolimitantesi tipica del bambino, con periodi di completo benessere tra gli episodi critici. Questo disturbo non era incluso fra le sindromi periodiche dell’infanzia nella prima edizione della Classificazione Internazionale delle Cefalee (1988). Tuttavia, le caratteristiche cliniche della sindrome richiamano i sintomi di accompagnamento dell’emicrania e molti studi suggeriscono che il vomito ciclico sia una condizione correlata all’emicrania.
|
IHS |
Diagnosi |
ICD-10 |
|
1.2.6 |
Emicrania di tipo basilare |
G43.103 |
|
Terminologia utilizzata in precedenza |
Emicrania dell'arteria basilare, emicrania basilare |
|
Descrizione:
Emicrania in cui i sintomi dell'aura originano inequivocabilmente dalla regione tronco-encefalica e/o riflettono il simultaneo interessamento di entrambi gli emisferi, in assenza di deficit motori.
Criteri diagnostici:
A. Almeno 2 attacchi che soddisfino i criteri B-D
B. L'aura è costituita da almeno due dei seguenti sintomi completamente reversibili, in assenza di deficit motori:
1. disartria
2. vertigini
3. acufeni
4. ipoacusia
5. diplopia
6. sintomi visivi bilaterali presenti simultaneamente nel campo sia temporale che nasale di entrambi gli occhi
7. atassia
8. riduzione del livello di coscienza
9. parestesie bilaterali simultanee
C. Almeno una delle seguenti caratteristiche:
1. almeno un sintomo dell'aura si sviluppa gradualmente in ≥5 minuti e/o vari sintomi si susseguono in ≥5 minuti
2. ogni sintomo dell'aura ha una durata compresa fra 5 e 60 minuti
D. Una cefalea, che soddisfa i criteri B-D per 1.1 Emicrania senza aura, inizia durante l'aura o la segue entro 60 minuti
E. Non attribuita ad altra condizione o patologia1
Nota:
1. L'anamnesi, l'esame obiettivo generale e neurologico non suggeriscono alcuna condizione o patologia elencate nei gruppi 5-12, oppure l'anamnesi e/o l'esame obiettivo generale e/o l'esame obiettivo neurologico ne suggeriscono la presenza, ma questa viene esclusa da appropriate indagini strumentali, oppure ancora la condizione o patologia è presente, ma gli attacchi di cefalea non si manifestano per la prima volta in stretta relazione temporale con essa.
Commento:
Gli attacchi di tipo basilare sono per lo più osservati in giovani adulti, che spesso presentano anche crisi con aura tipica, nel qual caso è necessario codificare entrambe le forme.
In presenza di deficit motori, occorre porre diagnosi di 1.2.4 Emicrania emiplegica familiare oppure 1.2.5 Emicrania emiplegica sporadica. I pazienti affetti da 1.2.4 Emicrania emiplegica familiare presentano, nel 60% dei casi, sintomi di tipo basilare. La diagnosi di 1.2.6 Emicrania di tipo basilareandrebbe pertanto posta soltanto in assenza di deficit motori.
Molti dei sintomi elencati al punto B sono soggetti a interpretazione errata, in quanto possono essere indotti da stati di ansia e da iperventilazione.
In passato, sono stati utilizzati i termini emicrania dell'arteria basilare oemicrania basilare, ma, dal momento che il coinvolgimento del territorio dell'arteria basilare è incerto, in quanto potrebbe trattarsi di una localizzazione biemisferica, si è preferito adottare il termine emicrania di tipo basilare.
|
HS |
Diagnosi |
ICD-10 |
|
1.2.4 |
Emicrania emiplegica familiare (Familial hemiplegic migraine, FHM) |
G43.105 |
Descrizione:
Emicrania in cui l'aura include deficit motorio e dove almeno un congiunto di primo o di secondo grado presenta aura emicranica con deficit motorio.
Criteri diagnostici:
A. Almeno 2 attacchi che soddisfino i criteri B e C
B. L'aura comporta un deficit motorio completamente reversibile e almeno uno dei seguenti:
1. sintomi visivi completamente reversibili, positivi (come luci tremolanti, macchie, linee) e/o negativi (per es., perdita del visus)
2. sintomi sensitivi completamente reversibili, positivi (per es., "punture di spilli") e/o negativi (per es., ipoestesia)
3. disturbo del linguaggio di tipo disfasico completamente reversibile
C. Presenza di almeno due delle seguenti caratteristiche:
1. almeno un sintomo dell'aura si sviluppa gradualmente in ≥5 minuti e/o vari sintomi si susseguono in ≥5 minuti ≥5 minutes
2. ogni sintomo dell'aura ha una durata ≥5 minuti e <24 ore
3. una cefalea, che soddisfa i criteri B-D per 1.1 Emicrania senza aura, inizia durante l'aura o la segue entro 60 minuti
D. Almeno un parente di primo o di secondo grado ha avuto attacchi con aura che soddisfino questi criteri A-E
E. Non attribuita ad altra condizione o patologia1
Nota:
1. L'anamnesi, l'esame obiettivo generale e neurologico non suggeriscono alcuna condizione o patologia elencate nei gruppi 5-12, oppure l'anamnesi e/o l'esame obiettivo generale e/o l'esame obiettivo neurologico ne suggeriscono la presenza, ma questa viene esclusa da appropriate indagini strumentali, oppure ancora la condizione o patologia è presente, ma gli attacchi di cefalea non si manifestano per la prima volta in stretta relazione temporale con essa.
Commento:
La distinzione tra deficit motorio e sensitivo può risultare difficile.
Dati recenti derivanti da studi genetici dell'emicrania consentono oggi una più accurata definizione di FHM. Sono stati infatti identificati specifici sottotipi genetici di 1.2.4 Emicrania emiplegica familiare: FHM1, in cui sono presenti mutazioni del gene CACNA1A sul cromosoma 19 e FHM2, in cui sono presenti mutazioni nel gene ATP1A2 sul cromosoma 1. Dopo test genetico, il relativo sottotipo va specificato tra parentesi.
È stato riportato che la FHM1 spesso presenta sintomi di tipo basilare in aggiunta a quelli tipici dell'aura, mentre la cefalea è quasi invariabilmente presente. Durante gli attacchi di FHM1 si possono manifestare disturbi della coscienza (fino al coma), febbre, pleiocitosi del liquido cerebrospinale e confusione. Gli attacchi possono essere innescati da trauma cranico lieve. Circa il 50% delle famiglie affette da FHM1 presenta anche atassia cerebellare progressiva cronica, indipendentemente dagli attacchi emicranici.
La FHM viene spesso confusa con epilessia e come tale trattata (inefficacemente).
|
IHS |
Diagnosi |
ICD-10 |
|
|
1.3.2 |
Emicrania addominale |
G43.820 |
|
Descrizione:
Disturbo idiopatico ricorrente, osservato prevalentemente nei bambini e caratterizzato da dolore addominale episodico a livello della linea mediana, che si manifesta con attacchi della durata di 1-72 ore e completa asintomaticità nelle fasi intercritiche. Il dolore è di intensità medio-forte ed è associato a sintomi vasomotori, nausea e vomito.
Criteri diagnostici:
A. Almeno 5 attacchi che soddisfino i criteri B-D
B. Attacchi di dolore addominale della durata di 1-72 ore (senza trattamento o con trattamento inefficace)
C. Il dolore addominale presenta tutte le seguenti caratteristiche:
1. localizzazione a livello della linea mediana, periombelicale o non ben definita
2. qualità sorda o “semplicemente dolente”
3. intensità media o forte
D. Durante la fase algica sono presenti almeno due dei seguenti sintomi:
1. anoressia
2. nausea
3. vomito
4. pallore
E. Non attribuita ad altra condizione o patologia1
Nota:
1. Nessun sospetto di malattia gastrointestinale o renale emerge dall’anamnesi e dall’esame obiettivo, o tale malattia è esclusa a seguito di indagini appropriate.
Commento:
Il dolore è abbastanza intenso da interferire con le attività della vita quotidiana.
Per il bambino può risultare difficile distinguere tra anoressia e nausea. Il pallore è spesso associato a occhiaie, ma, in alcuni soggetti, il fenomeno vasomotorio predominante è rappresentato dall’iperemia al volto.
La maggior parte dei bambini affetti da emicrania addominale svilupperà cefalea di tipo emicranico nel corso della vita.
|
IHS |
Diagnosi |
ICD-10 |
|
|
1.3.3 |
Vertigine parossistica benigna dell’infanzia |
G43.821 |
|
Descrizione:
Questo disturbo, probabilmente eterogeneo, è caratterizzato da attacchi vertiginosi brevi e ripetuti in bambini per il resto sani. Gli attacchi si manifestano all’improvviso e vanno incontro a risoluzione spontanea.
Criteri diagnostici:
A. Almeno 5 attacchi che soddisfino il criterio B
B. Episodi multipli con vertigini intense1, che si verificano senza alcun sintomo premonitore e si risolvano spontaneamente nell’arco di minuti o ore
C. L’esame nurologico, le funzioni audiometriche e quelle vestibolari risultano normali nel periodo intercritico
D. L’EEG è normale
Nota:
1. Spesso associate a nistagmo o vomito. Talora, durante l’attacco può manifestarsi cefalea pulsante.
L'inizio molto precoce degli episodi (durante i due primi anni di vita), il loro carattere recidivante e regolare (ogni mese od ogni 2 mesi) senza fattore scatenante e molto mal tollerato (vomito) quando esistono dei precedenti familiari di emicrania vera (o di emicranie accompagnate) devono far sospettare un'atassia episodica di tipo II, malattia genetica il cui trattamento è diverso dall'emicrania vera. In effetti in questo caso gli attacchi si possono risolvere con un trattamento con acetazolamide, ma la terapia di lunga durata favorisce in alcuni pazienti la litiasi renale. La risposta a questo trattamento ha attualmente valore diagnostico. Nel bambino si può ricorrere in prima intenzione al trattamento con la l-leucina, molto meglio tollerato e che sembra essere efficace nei bambini piccoli che presentano questa patologia senza avere gli effetti secondari e le complicanze dell'acetazolamide (terapia in corso di valutazione).
Equivalenti emicranici
Bambina di 7 anni.
Da 1 mese, diversi episodi di vertigini , nausea e mal di testa da 1/2 ora a 1 ora, fotofobia.
A scuola, a fine giornata, dopo la televisione, la lettura.
Esame oto-neuro-vestibolare: normale al di fuori di un'ipofunzione canalare destra isolata al test calorico (?).
Scanner: normale.
Esame oftalmologico: ipermetropia e disturbo della convergenza; occhiali e rieducazione ortottica.
Terapia medica antiemicranica: antiinfiammatori non steroidei e antalgici.
La vertigine emicranica equivalente (VEE)
La VE può essere definita come “equivalente” solo quando l’attacco vertiginoso-posturale sostituisce completamente l’attacco di cefalea, presentandosi in forma isolata, senza alcun rapporto temporale diretto con le crisi di cefalea. La vertigine rappresenta un sintomo alternativo alla crisi cefalalgica, scatenato probabilmente da meccanismi patogenetici analoghi e struttura bersaglio diversa.
Nella VEE non esiste uno stretto rapporto temporale tra la singola crisi di cefalea e di vertigine, ma la seconda si verifica quasi sempre nella fase florida come manifestazione sostitutiva, quindi equivalente, della prima. La VEE può essere di vario tipo, in base al rapporto temporale esistente tra il periodo d’esordio della vertigine ed il periodo fondo delle crisi algiche; nella vita del soggetto emicranico la VEE può infatti precedere (VEE precoce), sostituire parzialmente (VEE intercnitica) o seguire (VEE tardiva), il periodo fondo della cefalea emicranica.
La VEE precoce
Si tratta di turbe vertiginoso-posturali che rappresentano un sintomo alternativo (equivalente) alla cefalea, precedendo nel tempo (precoce) il periodo delle crisi algiche (precritica), configurandosi spesso come la prima vera manifestazione clinica dell’habitus emicranico del paziente.
Le due principali forme cliniche di VEE precoce sono rappresentate dal torcicollo parossistico e dalla vertigine parossistica dell’infanzia.
Queste due entità nosologiche sono troppo spesso definite come precursori emicranici, ossia come prime manifestazioni di un habitus che poi si esplicherà sotto forma di cefalea emicranica, A nostro giudizio, invece, sia la vertigine parossistica che il torcicollo parossistico dell’infanzia hanno già tutte le caratteristiche di una VEE precoce, con dignità clinica e caratteristiche nosologiche proprie: sono pertanto una vera patologia vestibolare emicranica e non un semplice precursore.
La vertigine parossistica infantile si manifesta in modo subacuto e senza prodromi, con malessere ed arresto motorio volontario del bambino che può rimanere sofferente da alcuni minuti a poche ore per poi riprendere normalmente la propria attività motoria ed anche ludica. Il bambino, in età prescolare, non è per lo più in grado di descrivere la propria sintomatologia e spesso queste manifestazioni, proprio per l’arresto motorio, vengono scambiate per assenze epilettiche. Quando il bambino è in grado di descrivere i sintomi, riferisce una vertigine oggettiva rotatoria che è responsabile, insieme alla paura, dell’arresto motorio, Sono quasi sempre presenti il pallore e la sudorazione, mentre la nausea ed il vomito possono anche mancare. Non abbiamo mai avuto l’occasione di osservare direttamente una fase acuta, ma alcuni genitori hanno riferito di aver notato i movimenti oculari del nistagmo (un padre è riuscito anche a fornire un filmato del nistagmo, che aveva caratteristiche periferiche). La presentazione di questa VEE avviene di solito fra i 3 e gli 8 anni, ma abbiamo avuto anche pazienti con esordio tardivo, comunque sempre prima del periodo cefalalgico. La diagnosi è sempre anamnestica: l’esordio in pieno benessere senza rapporti causali, la durata limitata (da minuti ad un massimo di 2 ore), la risoluzione completa con ripresa della normale attività motoria, la tendenza a recidivare senza alcuna regola temporale (talora una presentazione periodica a grappolo), la negatività audio-vestibolare al di fuori delle crisi e la accertata familiarità emicranica, sono i cardini anamnestici per la diagnosi. La risonanza magnetica è indicata in caso di possibile persistenza post-critica di segni nistagmici o per placare i timori di genito ri ansiosi. La terapia è prevalentemente psicologica: far ben comprendere ai genitori la natura dei disturbi, spiegare loro che i sintomi scompariranno spontaneamente nel tempo, invitarli ad essere rassicuranti verso il bambino al momento della crisi. L’uso dei farmaci per la profilassi emicranica è sconsigliata, vista l’età dei pazienti. E opportuno avvisare i genitori della possibilità che il figlio sviluppi una cefalea emicranica dopo la pubertà.
Il torcicollo parossistico infantile Tanzariello è caratterizzato da episodi di tonica rotazione del capo con flessione (tilt) verso la spalla, della durata da minuti a poche ore, con risoluzione senza esiti organici. Rispetto alla vertigine parossistica infantile, è più raro, si sviluppa più precocemente, tende ad essere più prolungato e gli episodi sono meno numerosi. Nella nostra casistica abbiamo avuto solo due bambini che hanno presentato sia la vertigine che il torcicollo parossistico: in entrambi i casi, il torcicollo era esordito prima della vertigine e si era esaurito con la comparsa della vertigine parossistica. Verosimilmente il torcicollo è espressione di sofferenza emicranica del sistema discendente maculospinale e la vertigine di una analoga sofferenza del sistema ascendente canalare-oculomotorio.
VERTIGINE PAROSSISTICA BENIGNA DEL BAMBINO (20%)
È la seconda diagnosi da prendere in considerazione in ordine di frequenza. Deve essere sospettata in particolare nei bambini di 2-3 anni, se e solo se la vertigine è breve (meno di 10 min) non associata a una cefalea (bambino non dolente), in genere ben sopportata (a volte pallore, nausea ma raramente vomito) e priva di ripercussioni sulle attività prima e dopo il periodo di malessere. . Si tratta di un disturbo comune che accade a circa il 2,6% dei bambini alcuni esperti ritengono che sia un precursore di emicrania . (Abu-Arufeh e Russell, 1995). A volte è anche osservato come complicazione chirurgica di impianto cocleare. 1,26,27
DIAGNOSI
 Per una diagnosi di vertigine parossistica benigna
dell'infanzia da apportare al bambino deve avere:
Per una diagnosi di vertigine parossistica benigna
dell'infanzia da apportare al bambino deve avere:
•almeno cinque attacchi.
•ottenere vertigini (capogiri) un sacco, che succede tutto ad un tratto, e andare via dopo pochi minuti ad alcune ore.
•un normale esame neurologico: test per assicurarsi che non vi è alcun problema nel cervello
•funzioni audiometrici e vestibolari normale tra gli attacchi: non c'è problema che può essere trovato nell'orecchio interno (parte interna delle orecchie).
•normale elettroencefalografia (EEG): il cervello di una persona fa piccole quantità di energia elettrica e di questo test fa in modo che questo sta lavorando bene.
Adattato da:. L'Headache Classification sottocommissione della International Headache Society 2004 [3]
La diagnosi differenziale
Le diagnosi differenziali sono diversi disturbi medici che possono causare gli stessi sintomi. Prima che un medico fa una diagnosi finale , che significa che sono sicuri di ciò che disturbo medico sta causando il problema, pensano di ciò che altre condizioni mediche hanno quasi gli stessi sintomi stessi o, e assicurarsi che non è uno di loro. [Wiener-Vacher et al 1994 4]
Alcune delle diagnosi differenziali di vertigine parossistica benigna dell'infanzia sono:
•fossa posteriore tumori: questo un tumore nella parte del cervello in prossimità del fondo del cranio. Tumori della fossa posteriore accadono più nei bambini che fanno in adulti. Circa il 54% -70% di tutti i tumori cerebrali che i bambini iniziano nella fossa posteriore.
•anomalie della colonna vertebrale cervicale: questi sono problemi con la parte della colonna vertebrale nel collo.
•Patologie otologiche: questi sono problemi nella parte interna di orecchie.
•epilessia (l'epilessia occipitale benigna): questo è un tipo di malattia del cervello.
•Disturbi metabolici: questo è quando c'è un problema con il modo in cui il corpo produce energia dal cibo.
L'esame otologico, vestibolare e neurologico clinico è normale. Gli episodi si possono ripetere per qualche mese, o 1 anno, e scompaiono spontaneamente. Se questi sintomi insorgono in bambini un poco più grandi (4-5 anni o più), è fondamentale ricercare un'altra causa e in particolare un disturbo oftalmologico prima di considerare questa diagnosi. In genere non è necessario alcun trattamento. È importante informare i genitori della benignità di questa affezione di origine sconosciuta e chiedere loro di ritornare se i sintomi non si risolvono o si modificano. Non è utile eseguire una RM in questi casi particolari dove gli esami otologici neurologici e vestibolari sono normali; la RM non è priva di rischi a questa età (è eseguita in anestesia generale ed è relativamente traumatizzante) ed è costosa, mentre è sempre normale in questi casi. Vertigine parossistica benigna dell'infanzia (BPVC in breve) (questo significa vertigini innocuo, che avviene ancora e ancora e accade all'improvviso) è una condizione medica che si verifica di solito nei bambini a partire dai due ai cinque anni di età; scompare spesso dall'età di otto anni. Ma BPVC può iniziare giovane come un paio di mesi al più tardi a 12 anni di età. Essa provoca una sorta di vertigine chiamata vertigine parossistica . Con questo tipo di vertigine persone sentono che sono in movimento o rotazione o che l'interno della loro testa è in movimento o spinning.
Vertigine parossistica benigna
Maschio di 2 anni e 1/2.
Quattro episodi ricorrenti di vertigini: dice «la casa gira».
Durata breve: alcuni secondi, meno di 10 minuti.
Si aggrappa o si siede.
Movimenti oculari (nistagmo?) talora osservati.
Molto ben tollerato: non dolori, non nausee, non vomiti?
Gioca normalmente in seguito.
Esame oto-neuro-vestibolare: normale.
Richiesta di esame oftalmologico, non di diagnostica per immagini, ma rivedere al termine di 4 mesi o prima se vi fosse un cambiamento dei segni.
Rivisto al 4°mese: esame normale.
Scomparsa spontanea delle vertigini in 6 mesi, nessun trattamento.
Quadro di trauma cranico (10%) Tanzariello
Le vertigini devono essere prese molto sul serio perché possono essere il segno di una frattura della rocca petrosa e/o di una fistola perilinfatica. [10 Wiener-Vacher et al 1998] Una frattura o fessura del guscio dell'orecchio interno, permettendo la fuoriuscita di liquidi dell'orecchio interno, può portare a sordità evolutiva e areflessia vestibolare se non è effettuato rapidamente un intervento chirurgico di riempimento di questa breccia. Una tale fistola espone il bambino a meningiti recidivanti. Ogni bambino che ha una turba dell'equilibrio (atassia, deviazione posturale) o una vertigine, e in più, presenta una otorragia e una ipoacusia nell'immediato periodo successivo a un trauma cranico dovrebbe almeno essere sottoposto a un esame otorinolaringoiatrico in urgenza (audiometria ed esame otovestibolare) per verificare la presenza di segni di frattura della rocca (emottisi, otorragia, sordità di trasmissione, di percezione o mista, areflessia o nistagmo da lesione o da irritazione vestibolare). Questi segni dovranno portare alla richiesta di una TC in urgenza alla ricerca:
• di una linea di frattura sulla squama temporale che attraversa o meno l'orecchio interno, non sempre evidente nel bambino;
• di un'immagine aerea nel labirinto, che indica l'apertura dell'orecchio interno nell'orecchio medio (segno molto transitorio, che scompare in meno di 8 giorni) e la presenza di una fistola che deve essere esplorata chirurgicamente in urgenza.
È interessante di sapere che nel bambino la rima di frattura può non essere visibile e tuttavia essere associata a un interessamento funzionale vestibolare o uditivo importante per emorragia intralabirintica o contusione labirintica (Figura 43 ).
|
Fig.43. Gestione di fronte a un sospetto di un trauma della rocca in occasione di un trauma cranico. PEOM: potenziali evocati otolitici miogeni.
|
Una lesione funzionale uditiva e/o vestibolare che non dimostra una fistola o un trauma della catena ossiculare dovrà essere rivista entro 8-10 giorni per un nuovo esame audiometrico e vestibolare al fine di valutare l'evolutività delle lesioni; l'aggravamento dei deficit audiovestibolari porta a sospettare un processo evolutivo e una fistola e porta a un'esplorazione chirurgica, mentre la stabilità dei deficit o il loro miglioramento fanno porre la diagnosi di sequela o di contusione semplice. La stabilità, o il miglioramento dei deficit, sarà il segno di una contusione dell'orecchio interno in fase di recupero. Il bambino deve essere oggetto di controlli regolari per confermare questa evoluzione favorevole.
Traumi della rocca: rilevare la fistola perilinfatica, evitare il peggioramento uditivo, limitare il rischio di meningite
Bambina di 6 anni.
Caduta da un mezzanino, perdita di coscienza + trauma cranico + otorragia destra, emotimpano destro, vertigini per 48 ore, urgenza: TC normale, non controllo.
10 giorni dopo: torcicollo, ipoacusia, non vertigini.
Esame: emotimpano, assenza di riflesso dello stapedio destro, sordità mista destra, areflessia vestibolare destra al test calorico, non compensata, segno di Tullio destro ai suoni forti (120 dB, 1kHz), preponderanza direzionale destra nel test RAIG: segno di irritabilità otolitica.
revisione della prima TC: pneumolabirinto, sparito alla seconda TC.
Esplorazione chirurgica: fessura palatina, riempimento senza stapedectomia.
Evoluzione: recupero completo uditivo e vestibolare, stabile.
La malattia di Ménière è meno comune nei bambini. Si tratta di un disturbo periferico coinvolge uno squilibrio di un fluido dell'orecchio interno chiamato endolymph. I sintomi includono perdita fluttuante dell'udito, tinnito, pressione auricolare o sensazioni di pienezza, e gli episodi di vertigine e nausea.
Alcuni disturbi vestibolari meno comuni nei bambini includono questi disturbi periferici: Fistola Perilinfatica (fuoriuscita di endolinfa delle finestre ovali o rotonde dell'orecchio interno), e la Sindrome dell'acquedotto Vestibolare Allargato(un tubo di collegamento endolinfatico anormalmente grande tra orecchio interno e sacco endolinfatico)
Disturbi oftalmologici
Segni: cadute frequenti (meno di 5 anni), vertigini i dopo i tentativi di lettura, videogiochi e televisione, a scuola, in fine di giornata (oltre i 5 anni).
Mai una grande vertigine permanente.
Spesso cefalee (associate o in alternanza), a volte solo sensazioni vertiginose; spesso terreno emicranico.
Esame oto-neuro-vestibolare normale.
Talvolta, tuttavia, visualizzazione di un disturbo di convergenza.
Non diagnostica per immagini.
Richiesta di bilancio oftalmologico: misurazione della rifrazione sotto dilatatori (Ciclolux®) e bilancio ortottico.
La terapia è oftalmologica: uso degli occhiali e/o rieducazione ortottica.
Nel 10% dei casi, le vertigini del bambino a partire dall'età di 5-6 anni non hanno come sola e unica causa dei disturbi visivi. ( Anoh-Tanon et al.,2000 , Bucci et al., 2003/4) La correzione di questi disturbi visivi (uso degli occhiali e/o rieducazione ortottica) da sola fa scomparire i disturbi. I disturbi visivi possono essere dei disturbi di rifrazione (miopia, ipermetropia, astigmatismo) o delle anomalie della vergenza oculare. Le sensazioni di vertigine sono delle sensazioni di rotazione o di oscillazione, brevi ma ripetute, spesso legate alla stanchezza (a scuola, alla fine della giornata, dopo sedute prolungate al computer o alla televisione, sedute prolungate di lettura), possono insorgere a volte all'addormentamento o al risveglio il mattino. Queste sensazioni possono essere isolate o associate a cefalee, a nausea ma raramente a vomito. Insorgono spesso in bambini che hanno un terreno emicranico. L'esame può evidenziare un difetto di convergenza oculare facendo fissare un piccolo bersaglio (disegno su un abbassalingua per esempio) mentre lo si avvicina progressivamente sulla linea mediana della radice del naso. L'espressione clinica di questi problemi con vertiginii è attualmente in aumento nei bambini dato lo sviluppo delle attività ricreative che utilizzano degli schermi televisivi o dei computer, dei videogiochi che richiedono degli sforzi di fusione oculare importanti e prolungati spesso per molte ore. In questi casi solamente il controllo oftalmologico (valutazione della rifrazione sotto dilatatori per eliminare l'effetto correttivo dei processi accomodativi, molto efficaci nel bambino piccolo, e bilancio ortottico eseguito da un ortottista) è anormale. Non saranno la RM o la TC ad aiutare nella diagnosi e portare al solo trattamento adatto, che è l'uso di occhiali e/o la rieducazione ortottica.
 Una grande vertigine
rotatoria con vomito nel decorso di un episodio infettivo virale deve far
pensare a una neurite vestibolare (5% delle vertigini del bambino).
Il quadro può essere ingannevole nei bambini piccoli che non si esprimono
ancora chiaramente e dove la vertigine si manifesta solo con vomito,
dolori addominali, quadro che può mimare completamente quello di una
gastroenterite. Tuttavia all'esame clinico esistono dei segni associati che non
ingannano se vengono ricercati: la perdita di equilibrio sempre dallo stesso
lato quando il bambino si tiene in piedi sul materasso o sul suolo, a occhi
chiusi, la presenza di nistagmo (a condizione che sia ricercato senza la
fissazione dello sguardo, con occhiali di Frenzel). Tali constatazioni devono
far prescrivere una valutazione audiovestibolare. Questa valutazione permette
di dimostrare l'assenza di interessamento dell'udito e di quantificare il danno
vestibolare. Se questo è rilevante, le possibilità di recupero sono minime, se
la lesione è parziale si osserva il 25% di recupero con un ritorno a una
funzione vestibolare normale o subnormale in poche settimane o mesi. In ogni
modo si ottiene una compensazione, tanto più rapida quanto più il bambino è
mobilizzato rapidamente e senza trattamento vestiboloplegico. Una RM potrebbe
mostrare un ipersegnale a livello del nervo vestibolare, ma questo segno è
molto incostante. Il trattamento di queste neuriti è soprattutto sintomatico,
per limitare nausea e vomito e facilitare il compenso centrale del deficit vestibolare,
attraverso la rieducazione vestibolare, che nel bambino deve essere attuata
sotto forma di giochi (giochi con la palla, raccolta di giocattoli al suolo,
movimenti rapidi della testa con fissazione visiva di riferimenti fissi).
Una grande vertigine
rotatoria con vomito nel decorso di un episodio infettivo virale deve far
pensare a una neurite vestibolare (5% delle vertigini del bambino).
Il quadro può essere ingannevole nei bambini piccoli che non si esprimono
ancora chiaramente e dove la vertigine si manifesta solo con vomito,
dolori addominali, quadro che può mimare completamente quello di una
gastroenterite. Tuttavia all'esame clinico esistono dei segni associati che non
ingannano se vengono ricercati: la perdita di equilibrio sempre dallo stesso
lato quando il bambino si tiene in piedi sul materasso o sul suolo, a occhi
chiusi, la presenza di nistagmo (a condizione che sia ricercato senza la
fissazione dello sguardo, con occhiali di Frenzel). Tali constatazioni devono
far prescrivere una valutazione audiovestibolare. Questa valutazione permette
di dimostrare l'assenza di interessamento dell'udito e di quantificare il danno
vestibolare. Se questo è rilevante, le possibilità di recupero sono minime, se
la lesione è parziale si osserva il 25% di recupero con un ritorno a una
funzione vestibolare normale o subnormale in poche settimane o mesi. In ogni
modo si ottiene una compensazione, tanto più rapida quanto più il bambino è
mobilizzato rapidamente e senza trattamento vestiboloplegico. Una RM potrebbe
mostrare un ipersegnale a livello del nervo vestibolare, ma questo segno è
molto incostante. Il trattamento di queste neuriti è soprattutto sintomatico,
per limitare nausea e vomito e facilitare il compenso centrale del deficit vestibolare,
attraverso la rieducazione vestibolare, che nel bambino deve essere attuata
sotto forma di giochi (giochi con la palla, raccolta di giocattoli al suolo,
movimenti rapidi della testa con fissazione visiva di riferimenti fissi).
Neurite vestibolare provoca vertigini e labirintite causa sia vertigini e sintomi acustici. Entrambi derivare da infezioni dell'orecchio gravi e possono causare sintomi acuti di vertigine e nausea che di solito, ma non sempre, regrediscono entro 4-6 settimane. Questi disturbi sono attribuiti ad una infezione virale del ganglio trigeminale, un insieme di cellule nervose situate proprio dietro l'orecchio, (neurite vestibolare) o infezione batterica o virale dell'orecchio interno (labirintite).
La diagnosi di neurite sarà differenziata da quella di labirintite con l'esame otoscopico che riscontra, in caso di labirintite, un'otite media acuta purulenta. In questo caso, il trattamento comporta una paracentesi per un prelievo batteriologico, una terapia antibiotica a largo spettro per via endovenosa condotta in ambiente ospedaliero per evitare la distruzione cocleovestibolare e l'estensione dell'infezione (mastoidite, paralisi faciale, setticemia, meningite e localizzazioni settiche extrapetrose). L'udito e la funzione vestibolare sono purtroppo compromessi gravemente e spesso è inevitabile una cofosi con areflessia vestibolare nonostante una terapia precoce.
Compensazione dei deficit vestibolari nel bambino
Il bambino tollera e compensa molto rapidamente un deficit vestibolare acuto monolaterale.
Attenzione alle compensazioni ritardate, segno di evolutività della lesione dell'orecchio interno.
Bambino di 3 anni, angina febbrile, dolori addominali, vomito: diagnosi di gastroenterite nel reparto d'urgenza.
15 o giorno, lamenta ipoacusia sinistra (al telefono): cofosi sinistra; TC normale; diagnosi di neurite.
Quarto mese, visto a Parigi dopo trasloco; visita di controllo: deficit vestibolare non compensato... Al 13o mese, idem; nuova TC: labirintite ossificante.
Tumore della fossa posteriore Tanzariello
La diagnosi di tumore della fossa posteriore, tanto temuta in presenza di vertigini del bambino, è rara: meno dell'1%. I tumori della fossa posteriore sono piuttosto responsabili di disturbi dell'equilibrio che non di vertigini , e soprattutto sono sempre associati ad altri segni neurologici. È per questo motivo che l'esame vestibolare clinico di un bambino portatore di vertigini o di disturbi dell'equilibrio deve sempre essere completato da un esame dell'oculomotricità e da un esame neurologico (ricerca di una sindrome cerebellare, valutazione di nervi cranici, motilità, sensibilità profonda, riflessi osteotendinei, segni piramidali). Il minimo segno neurologico di localizzazione (lesione audiovestibolare, torcicollo permanente, paralisi faciale oculomotoria, emianopsia, segno di Babinski, ipertono monolaterale…) deve portare alla richiesta di una TC e di una RM. Nel bambino i tumori più frequenti sono quelli della fossa posteriore con gli astrocitomi. La loro diagnosi precoce permette un'exeresi chirurgica che può essere completa allo stadio precoce e ottenere la guarigione.
La patologia neurologica di interesse vestibolare
PSEUDOTUMOR CEREBRI
La prima relazione sull'ipertensione intracranica idiopatica si deve al medico tedesco Heinrich Quincke, che la descrisse nel 1893 sotto il nome di meningite sierosa. Il termine "pseudotumor cerebri" è stato introdotto nel 1904 dal suo connazionale Max Nonne. Varie altre denominazioni sono state successivamente proposte per indicare la suddetta condizione e tra queste quelle che hanno a uto maggior diffusione sono “Ipertensione endocranica benigna” ed ultimamente “Ipertensione intracranica idiopatica” dizione quest’ultima non scevra di critiche, ma ufficialmente adottata e costantemente utilizzata dalla comunità scientifica anglosassone con la sigla IIH (Idiopathic Intracranial Hypertension). Con questi termini attualmente si definisce una sindrome da ipertensione intracranica mano metricamente accertata e con decorso benigno (salvo un rischio di cecità nel 10-30% dei pazienti), decorrente senza alterazioni liquorali né sintomi neurologici localizzatori (tranne papilledema ed occasionale paresi del VI nervo cranico) o disturbi della coscienza, e con neuroimmagini negative per presenza di tumori, patologia venosa o dilatazione ventricolare. La diagnosi di questa sindrome quindi può essere posta solo dopo aver escluso qualsiasi altra causa di ipertensione endocranica ed inoltre dopo aver eseguito una rachicentesi per documentare la normalità dei parametri liquorali. La eziologia è ignota pur essendo accertato che questa malattia può essere determinata da alcuni farmaci (contraccettivi orali, eccesso di vitamina A, tetracicline, minociclina, ormone della crescita e vari altri) e verificarsi in corso di affezioni sistemiche infiammatorie, dismetabolismi ed in particolare nell’obesità. L’incidenza annuale è stimata di 1-2 casi per 100.000 abitanti ed aumenta a 20 per 100.000 nel gruppo ad alto rischio di giovani donne obese, La sintomatologia si instaura generalmente nell’arco di alcune settimane ma esistono anche forme acute e croniche.
Le cefalee sono il sintomo più frequente e, nel corso della malattia, possono interessare sino al 99% dei pazienti ed altrettanto frequente (98-100%) è l’edema della papilla ottica, solitamente ma non sempre bilaterale e generalmente caratterizzato da una lenta evoluzione sino all’atrofia ottica. Questa alterazione spesso non è accusata dai pazienti salvo che per la comparsa brusca di transitorie eclissi visit’e con completa cecità. La diplopia si riscontra in circa un terzo dei casi e per lo più è riferibile a paralisi uni o bilaterale dell’abducente. Molto frequenti sono anche i sintomi di interesse audiovestibolare come gli episodi di disequilibrio, i deficit uditivi e gli acufeni, disturbi che essendo spesso associati nello stesso soggetto e non raramente presenti all’esordio della malattia fanno si che non raramente il primo approccio medico con questi pazienti avvenga proprio da parte dell’otolaringologo (Murphy, 1991).
Gli acufeni sono il più spesso intermittenti ed unilaterali e di solito con carattere pulsante (Sismanis et al., 1985). Resta infine da ricordare che esistono in letteratura alcuni studi (Rudnick e Sismanis, 2005) che descrivono la presenza di rinoliquorrea in soggetti affetti da ipertensione endocranica idiopatica e questo dato appare decisamente impegnativo a focalizzare l’inchiesta anamnestica anche su domande che permettano di escludere la coesistenza di questa potenzialmente grave patologia.
Restano (la considerare alcune malattie nelle quali la Compressione/ischemia sui centri vestibolari troncoencefalici si verifica attraverso alterazioni della dinamica del liquido cerebrospinale che inducono una dilatazione ventricolare attiva (idrocefalo) con conseguente sofferenza del tessuto nervoso circostante. L’aumento del volume dei ventricoli, oltre che per meccanismo ex-vacuo per atrofia del parenchima cerebrale circostante, può determinarsi per ostacoli alla sua circolazione a vari livelli (ivi comprese le strutture deputate al suo riassorbimento) dovuti a cause assai diversificate, per lo più di tipo infiammatorio o neoplastico, od anche a malformazioni congenite a carico dei tessuti cerebrali dei vasi endocranici o delle strutture osteo-articolari craniocervicali. Nella massima parte dei casi la sintomatologia audio-vestibolare appare come elemento non costante (e quasi mai di esordio) e di solito di entità minore rispetto a sintomi più eclatanti di disfunzioni di altre strutture del sistema nervoso e ciò è indipendente dal fatto che strumentalmente si possano evidenziare alterazioni vestibolari centrali in un’alta percentuale di questi pazienti (Lòppònen et al., 1992).
Anche per ragioni di spazio non riteniamo utile descrivere queste forme in modo sistematico limitandoci quindi ad alcune importanti entità cliniche che fanno “eccezione” al comportamento a cui abbiamo sopra accennato: su di esse ci soffermeremo brevemente riportandone le caratteristiche cliniche essenziali e soprattutto gli aspetti di interesse otoneurologico.
Prima di passare alla descrizione di queste eccezioni, è comunque opportuno fare un breve inciso per richiamare l’attenzione su due patologie della fossa cranica posteriore, il neurinoma del nervo vestibolare e le malformazioni dell’arteria basilare (dolicoectasia, megabasilare, aneurismi), che prevedono l’idrocefalo tra le loro possibili complicazioni. Il neurinoma dell’acustico (per la cui descrizione si rinvia all’apposito capitolo di questo volume), pur avendo origine nel sistema nervoso periferico può nella sua evoluzione compromettere, come è ben noto, strutture nervose vicine (ponte, cervelletto, altri nervi cranici) inducendo in esse condizioni di disfunzione che, unitamente ai segni audiovestibolari, costituiscono il complesso della sindrome dell’angolo ponto-cerebellare. Questa neoplasia è peraltro causa molto frequente anche di un idrocefalo da mancato riassorbimento del liquo1 che è fortemente alterato per la presenza di un’alta quantità di proteine (Rogg et al., 2005). Questo tumore neuro periferico, attraverso la complicazione suddetta, può quindi interferire sul quadro sintomatologico abitualmente atteso condizionando eventualmente anche la presenza e/o le caratteristiche di segni e sintomi di tipo vestibolare centrale.
L’altra eccezione a cui abbiamo accennato è costituita dalle malformazioni dell’arteria basilare e tra esse soprattutto e la dolicoectasia e gli aneurismi giganti. L’aumento consistente del volume del letto vascolare e la tortuosità dell’arteria basilare sono causa di disfunzione, spesso multipla a carico di nervi cranici mentre più raramente queste alterazioni congenite ed acquisite dell’arteria basilare possono determinare ischemie a carico del tronco encefalico (Kwon et al., 2009) o condizioni di idrocefalo occlusivo per lo più attraverso la compressione sul terzo ventricolo a livello dell’acquedotto di Silvio (Kansal et al., 2011) o l’ostruzione dei forami di Monroe (Celik et al., 2012).
I sintomi relativi alla compressione sui nervi cranici sono i più precoci e frequenti (Yu et al., 1982) e possono esprimersi con nevralgie trigeminali in caso di compressione sul V nervo cranico o con alterazioni a carico dei muscoli mimici (spasmi o paresi) nell’interessamento del n. faciale, sindromi vertiginose e deficit uditivi di tipo percettivo da compromissione dell’VIli nervo; successivamente compaiono i sintomi generali dell’ ipertensione endocranica (cefalea, nausea, vomito e deterioramento cognitivo) e quelli di sofferenza focale delle strutture del tronco encefalico come atassia, vertigini, diplopia, alterazioni motorie piramidali ecc. Con discreta frequenza si riscontrano inoltre acufeni per lo più di tipo pulsante (Hafeez et al., 1999). Tra i reperti dell’esame vestibolare viene segnalata pressoché costantemente l’esistenza di un nistagmo verticale verso il basso (Jacobson e Corbett, 1989).
Bambino di 18 mesi.
Torcicollo acquisito permanente dall'età di 13 mesi.
Difficoltà alla deambulazione (deambulazione acquisita a 12 mesi).
Segni neurologici: non vertigini ma instabilità.
Cofosi sinistra, nistagmo spontaneo sinistro, test di Halmagyi) + a destra.
Negligenza visiva dell'emicampo destro (visibile con l'inseguimento oculare e l'esame optocinetico).
Segno di Babinski + sui due lati, riflessi osteotendinei molto vivaci agli arti inferiori.
Piccola dismetria degli arti superiori.
Iporeflessia destra al test calorico e preponderanza direzionale sinistra.
TC e risonanza magnetica: astrocitoma del cervelletto.
Terapia: chirurgia (X3), radioterapia e chemioterapia.
L’atassia spino-cerebellare di Friedreich (FRDA)
È l’atassia ereditaria più comune. È una malattia neurodegenerativa autosomica recessiva con una prevalenza stimata di 1:50000-1: 29000. L’incidenza è molto più bassa negli asiatici e nei soggetti di discendenza africana. La percentuale dei portatori è stata stimata a 1:120-1:60. La malattia è causata dall’espansione ripetuta di un trinucleotide, cioè dall’espansione di una tripletta di GÀA localizzata all’interno del primo introne del gene della fratassina nel cromosoma 9q. C’è una correlazione chiara tra dimensione della ripetizione espansa e la gravità del fenotipo in FRDÀ. La fratassina è una proteina mitocondriale che ha un ruolo nell’omeostasi del ferro La deficienza di fratassina dà luogo ad accumulo mitocondriale di ferro, a difetti a carico di enzimi mitocondriali specifici, ad aumentata sensibilità agli stress ossidativi ed infine alla morte cellulare mediata da radicali liberi. Le lesioni sono rappresentate da fenomeni di tipo degenerativo a carico dei cordoni posteriori e laterali del midollo spinale, delle strutture del tronco encefalico compresi i nuclei vestibolari e della corteccia cerebellare.
L’esordio di solito è verso la pubertà, ma può variare dall’ età di 2-3 anni ad oltre 2.5 anni di età e solitamente è rappresentato da un disturbo della deambulazione di tipo atassico, che progressivamente si aggrava sino alla perdita della deambulazione che avviene mediamente dai 7 ai 15 anni dall’esordio della malattia e si va ad accompagnare ad altri sintomi e segni neurologici che in fase conclamata sono: riflessi tendinei assenti alle estremità inferiori, evidenza elettrofisiologica di neuropatia assonale sensitiva seguita da (entro 5 anni dall’esordio) disartria, areflessia in tutti i quattro arti, perdita distale della sensibilità di posizione e pallestesica, amiotrofia dei piccoli muscoli della mano e dei mu scoli distali della gamba e del piede, risposta piantare in estensione. Più della metà dei pazienti manifesta scoliosi progressiva, e circa la metà manifesta piede cavo, piede equinovaro e dita dei piedi ad artiglio. Altri reperti neurologici variabili includono anormalità oculomotorie, nistagmo, atrofia ottica (25%) e perdita d’udito neurosensoriale (20%).
L’anomalia del movimento oculare più comune è l’instabilità nello sguardo fisso. Non si osserva oftalmoparesi. Circa il 10% dei pazienti FRDA sono diabetici e la maggior parte di essi richiede terapia insulinica. In circa i due terzi dei pazienti vi sono alterazioni cardiache (cardiomiopatia ipertrofica) che costituiscono la causa più comune di morte che per tale patologia può verificarsi anche in età giovanile.
Le alterazioni di competenza otoneurologica sono costituite in circa la metà dei casi dalla presenza di un nistagmo spontaneo orizzontale (più raramente verticale verso il basso) o di tipo “alternante”. Nella maggior parte dei casi la reflettività vestibolare risulta ridotta. Oltre alla diminuzione dei valori dei parametri quantitativi, il nistagmo provocato dallo stimolo calorico presenta varie alterazioni qualitative (Eh et al.,1984). Il sintomo vertigine è riferito raramente ed in genere è di modesta entità, mentre sono rilevanti i disturbi della postura che si aggravano nettamente con la chiusura degli occhi.
La FRDA è una malattia a carattere progressivo con esito infausto per la quale non esistono terapie farmacologiche efficaci ma solo provvedimenti di tipo sintomatico, Questo motivo, unitamente al fatto che esistono moltissimi quadri cimici che, per lo meno in fase di esordio, possono presentarsi con una sintomatologia atassica sostanzialmente sovrapponibile a quella della malattia di Friedreich, rende indispensabile una diagnostica differenziale particolarmente scrupolosa al fine di escludere di trovarsi di fronte ad una delle cosiddette “atassie trattabili” e tra queste soprattutto l’atassia da deficit isolato di vitamina E (AVED). Si tratta di un’atassia ereditaria di origine genetica (cromosoma 8Q13, gene codificante il trasportatore dell’alfa tocoferolo) ad esordio giovanile i cui sintomi sono molto simili a quelli dell’atassia di Friedreich ma, per la quale, a differenza di questa, per lei esiste in realtà un trattamento curativo in assenza del quale le lesioni neurologiche (e la sintomatologia) continuano e si aggravano irrimediabilmente in modo progressivo.
L’esame dei livelli plasmatici di vitamina E è di conseguenza decisivo la CT, la diagnosi, per l’instaurazione della terapia sostitutiva e quindi per la prognosi. Oltre alla rara AVED esistono diverse altre affezioni “trattabili” che debbono essere prese in considerazione di fronte ad una sindrome atassica e, limitandoci per motivi di spazio solo alla loro citazione, ricordiamo principalmente l’AbetalipoproteinemIa, la celiachia, la malattia di Refsum, il morbo di Wilson, la malattia di Wernicke-Korsakoff, la tabe, la pseudotabe alcolica, la mielosi funicolare da deficit di vitamina B12, la carenza di acido folico, la xantomatosi cerebro-tendinea, la malattia di Tay-Sachs ad esordio tardivo, la malattia di Behet, la malattia di Fabry, l’ipotiroidismo, le sindromi paraneoplastiche, le intossicazioni da ossido di carbonio e da farmaci (litio, difenilidantoina ecc.).
CAUSE DI DISFUNZIONE VESTIBOLARE
Malformazione o Displasia di Mondini Tanzariello Sindrome di Pendered Tanzariello disordini uditivi centrali sindromi autosomiche recessive
Un tale quadro può anche essere il modo di rivelarsi di una malformazione dell'orecchio interno (malformazione di Mondini) scompensata in occasione di un trauma cranico anche lieve e rivelata allora dalla TC. [11, 12, 13] Il quadro è quello di un deficit vestibolare, spesso associato a un'ipoacusia dal lato del deficit, comparso in seguito a un trauma cranico che può essere leggero o senza trauma evidente, ma senza contesto infettivo virale che precede da qualche giorno a 1 settimana (il che sarebbe piuttosto suggestivo di neurite), né otite media acuta (che sarebbe piuttosto suggestiva di labirintite). Il deficit vestibolare e la sordità sono attestati con le indagini audiovestibolari, e la TC consente di porre la diagnosi. La malformazione dell'orecchio è molto spesso isolata, a volte bilaterale, talvolta inclusa nel quadro di una sindrome malformativa più generale (sindrome di Pendred con ipotiroidismo, malformazioni vertebrali, sindrome di CHARGE che associa coloboma retinico, malformazioni cardiache, atresia coanale, ritardo dello sviluppo psicomotorio e somatico, alterazioni genitali). Le malformazioni dell'orecchio interno sono di grado variabile per la parte cocleare, ma pressoché nel 100% dei casi esiste un'assenza di canali semicircolari a livello del vestibolo. I bambini portatori di malformazioni dell'orecchio interno devono essere seguiti regolarmente, sia sul piano uditivo che vestibolare, poiché i deficit uditivi e vestibolari sono in questi casi spesso evolutivi e richiedono una gestione specifica.
• Altre malattie genetiche come la sindrome di Usher di tipo I (con grave profonda perdita neurosensoriale dell'udito e problemi di equilibrio e la visione che s deteriora dai 10 anni) o di tipo III (con problemi di equilibrio e di visione che appaiono più tardi nella vita)
Altre diagnosi
Alle vertigini possono anche essere associati segni neurologici nel quadro di malattie del sistema nervoso centrale come quelle delle intossicazioni da farmaci, delle encefaliti, delle sindromi paraneoplastiche (piuttosto frequenti con i neuroblastomi). Tuttavia, in questi casi le vertigini sono piuttosto dei disturbi dell'equilibrio piuttosto che delle reali sensazioni vertiginose e non sono in primo piano; i disturbi neurologici sono numerosi, così come ricco è il contesto clinico.
Le altre diagnosi da ipotizzare nel bambino sono più raramente riscontrate.
Le otiti croniche (in particolare colesteatomatose) possono raggiungere il labirinto posteriore creando una fistola e/o una labirintite. Questa otite cronica può essere misconosciuta e rappresentare la modalità di presentazione dell'otite. L'esame otoscopico mette in genere in evidenza una perforazione timpanica infetta o un tappo epidermico che ostruisce il condotto o una sacca di retrazione timpanica profonda e, molto più raramente (in caso di colesteatoma congenito), il timpano può essere normale o bianco, sospinto o invaso dal colesteatoma, ed è la TC delle rocche che consente la diagnosi. Il trattamento è chirurgico e deve essere intrapreso dopo una valutazione completa cocleovestibolare.
I disturbi dell'equilibrio di origine psichiatrica sono rari e soprattutto riscontrati nei bambini verso l'età di 8-10 anni. Essi sono facilmente riconoscibili per la loro atipia (sono una caricatura esagerata dei disturbi dell'equilibrio senza rapporto con condizioni di equilibrio) e per l'assenza di disturbi dell'equilibrio in alcuni comportamenti automatici (come l'allacciarsi le scarpe, la raccolta di un oggetto che è appena caduto, un cambiamento brusco non anticipato di direzione ecc.). L'esame vestibolare e neurologico è normale e un colloquio psicologico con il bambino e i genitori mette in luce un problema sottostante (aggressione a scuola, conflitti familiari...).
L'ipotensione ortostatica è soprattutto riscontrata nei bambini in periodo di crescita rapida (prepuberale e puberale) e corrisponde a un difficile adattamento transitorio del sistema cardiovascolare alle improvvise variazioni di posizione. Le vertigini compaiono in effetti in occasione dell'alzarsi al mattino (passaggio troppo brusca dalla posizione sdraiata alla posizione eretta) o durante la stazione eretta prolungata. Le sensazioni di vertigine si accompagnano a sensazione di testa vuota, fosfeni e cefalee e durano da alcuni secondi a qualche minuto. Esse possono anche essere accompagnate da lipotimie, raramente da perdita di coscienza. L'esame vestibolare è normale e la diagnosi è confermata con misurazione della pressione arteriosa in posizione supina dopo 20 minuti di decubito dorsale e al momento della brusca assunzione della posizione eretta. I valori pressori della massima cadono di 20-40 mmHg al momento della posizione eretta mentre la manovra riproduce le sensazioni di cui si lamenta il giovane paziente. Il trattamento consiste nell'evitare i cambiamenti improvvisi di posizione.
La vertigine parossistica benigna posizionale (VPPB) in rapporto con una patologia otolitica (migrazione di cristalli otolitici nei dotti oppure sulla cupola dei canali semi-circolari) è soprattutto una patologia dell'adulto. Queste vertigini posizionali si manifestano raramente nel bambino e in genere piuttosto in un contesto traumatico (trauma cranico in seguito a una caduta o un incidente stradale). Le caratteristiche sono le stesse che nell'adulto: vertigine che compare al momento di un cambiamento di posizione con nistagmo geotropico con una latenza, estinguibile, adattabile. La sensazione vertiginosa è spesso meglio tollerata dai bambini che dagli adulti. Le valutazioni otologica, vestibolare e neurologica sono normali, il trattamento comporta come per gli adulti una manovra liberatoria (Semont-Toupet, Epley).
La malattia di Ménière e le sindromi di Ménière sono rare nel bambino e, nella nostra esperienza, le sindromi di Ménière che associano vertigini i, ipoacusia e acufeni con sensazione di orecchio ovattato sono state osservate solo a partire dall'età di 2-8 anni. Forse è una diagnosi sottostimata poiché i sintomi non sono sempre ritrovati all'anamnesi e, per esempio, l'ipoacusia (predominante sulle frequenze gravi) può essere una scoperta occasionale all'audiogramma richiesto in presenza di vertigini anche quando il bambino non aveva avvertito questa ipoacusia. Gli acufeni non sono necessariamente riferiti spontaneamente dal bambino. La vertigine è di regola il sintomo principale, invalidante, associata a nausea e vomito, senza cefalea e della durata di diverse ore o anche di una giornata. Se il bambino è visitato nel corso della crisi, si può constatare il nistagmo spontaneo spesso intenso. Gli esami otologico, neurologico sono normali e l'esame vestibolare al di fuori delle crisi è il più delle volte normale. L'audiogramma dimostra la caduta delle soglie uditive sulle frequenze gravi mentre la timpanometria esclude un problema tubarico. La misura dei PEOM può aiutare nella diagnosi mostrando un'assenza di risposta sul lato della sordità (in conduzione aerea e in conduzione ossea). Il test al glicerolo (esame molto lungo con due audiogrammi a 1 ora di intervallo) è raramente realizzato nel bambino, ma può mostrare un miglioramento delle soglie uditive 1 ora dopo l'assunzione di glicerolo, che indica la presenza di un'idrope. Questo tipo di test non è tuttavia sempre positivo. Bisogna guardarsi dal porre questa diagnosi al momento di una prima crisi, controllare il bambino regolarmente ed essere pronti a rimettere in causa questa diagnosi se la sintomatologia cambia. Se le vertigini sono ripetute e invalidanti, si può prescrivere una terapia di lunga durata con betaistina, che non ha alcun effetto secondario nel bambino.
La delayed vertigo o vertigine ritardata si verifica in genere da alcuni mesi a qualche anno dopo una lesione dell'orecchio interno con una sordità secondaria a un trauma (esempio: frattura della rocca) o una lesione infettiva o virale (esempio: la parotite prima della vaccinazione morbillo-parotite-rosolia [MPR] era una malattia che spesso produceva cifosi e delayed vertigo; la frequenza delle delayed vertigo è peraltro diminuita in modo notevole da quando esiste la vaccinazione sistematica dei bambini). Queste delayed vertigo possono manifestarsi come delle sindromi di Ménière ma nella storia del paziente è presente la nozione di una lesione dell'orecchio interno e la sindrome è spesso incompleta, senza segni uditivi associati alla crisi vertiginosa. Il meccanismo evocato all'origine di queste vertigini sarebbe molto vicino a quello evocato nelle sindromi di Ménière e i trattamenti delle delayed vertigo identici a quelli proposti nella malattia di Ménière. Quando le vertigini resistono alla terapia medica, si propone più facilmente, in caso di cofosi, una labirintectomia chirurgica o chimica.
Alcuni disturbi vestibolari meno comuni nei bambini sono questi disturbi periferici: Fistola Perilinfatica (fuoriuscita di endolinfa delle finestre ovali o rotonde dell'orecchio interno), la Sindrome dell'Acquedotto Vestibolare (un tubo anormalmente grande che collega l’endolinfa dell'orecchio interno al sacco endolinfatico) . Vertigine Parossistica Posizionale Benigna (VPPB) Tanzariello, una condizione causata da otoconia sloggiato in un canale semicircolare che anormalmente stimolano le cellule nervose-movimento di rilevamento, a volte è visto nei bambini. 21,22,23,24,25 Tuttavia, ha una incidenza molto più basso nei bambini rispetto agli adulti. A volte è anche osservato come complicanza chirurgica di impianto cocleare. 1,26,27
Ototossicità Tanzariello Malattie Dell'orecchio Interno Otossicita’ (avvelenamento orecchio) è causata da farmaci che distruggono le cellule ciliate dell'orecchio interno, che trasmettono i segnali di equilibrio dall'orecchio interno al cervello. Farmaci che possono causare danni significativi bilaterale vengono somministrati per via endovenosa antibiotici aminoglicosidi (come la gentamicina) e di alcuni tipi di chemioterapie, 20 che nei bambini può causare gravi squilibri, cadute e problemi visuo-motori, tra cui oscillopsia (bouncing visione). Molti bambini che hanno sperimentato ototossicità hanno difficoltà a scuola, lavorando ad un computer, o imparare a guidare un'automobile.
La Vertigine parossistica dell’infanzia (CPV), nota anche come vertigine parossistica benigna (BPV), è il disturbo vestibolare pediatrico più comune associato a capogiri, ed è a volte indicato come l'emicrania equivalente. Si tratta di un disturbo vestibolare centrale tipicamente osservati nei bambini di età compresa tra i 2-12 anni. E 'caratterizzata da vertigini , nistagmo, nausea e vomito. Un bambino con CPV è spesso sensibile al movimento, alla luce ed al suono, ma in genere è asintomatica dopo aver dormito. I bambini tendono a crescere fuori CPV; tuttavia, a volte la CPV progredisce in età adulta in vertigini emicranica associata. Questo disturbo è indicato anche con una varietà di altri nomi e sigle, ma non è lo stesso della vertigine parossistica posizionale benigna (VPPB).
La Neurite vestibolare provoca vertigini, e la labirintite causa sia vertigini che sintomi uditivi. Entrambi derivano da infezioni dell'orecchio gravi che possono causare sintomi acuti di vertigini e nausea e che di solito, ma non sempre, regrediscono entro 4-6 settimane. Questi disturbi sono attribuiti ad una infezione virale del ganglio di Gasser, un insieme di cellule nervose situate appena dietro l'orecchio, (neurite vestibolare) o infezione batterica o virale dell'orecchio interno (labirintite).
Le vertigini d'origine comiziale sono di regola rare e fanno parte delle aure delle crisi comiziali, generalmente associate a un corteo di segni che evocano una comizialità: allucinazioni di movimenti complessi (più che una vertigine rotatoria isolata), allucinazioni uditive, segni neurologici di localizzazione, assenza con perdita di conoscenza. Un tale quadro impone una consulenza neurologica che sarà in genere seguita da un elettroencefalogramma e un'indagine diagnostica cerebrale.
La lesione auto-immune dell'orecchio interno, (Ndiaye et al. 2002) o sindrome di Cogan, si manifesta con una "banale congiuntivite". Nei tre casi osservati in 12 anni, ogni volta la sindrome infiammatoria è stata secondaria a una stimolazione eccessiva del sistema immunitario (BCGite dopo una seconda vaccinazione BCG, parotite dopo un richiamo di vaccinazione MPR in un ragazzo di 14 anni, dopo le prime inoculazioni di desensibilizzazione contro gli acari). Il bambino ha gli occhi rossi e ciò è interpretato come una congiuntivite virale, ma svilupperà una sordità improvvisa con instabilità o vertigine che segna il danno vestibolare talvolta progressivo. La valutazione laboratoristica mostra una sindrome infiammatoria importante e l'esame oftalmologico una cheratite interstiziale evocatrice. È una diagnosi rara ma deve essere conosciuta perché deve essere prescritto un trattamento steroideo a forti dosi in urgenza per evitare la perdita dell'udito.
TRATTAMENTO
I risultati della valutazione e di valutazione aiutano a determinare il piano di trattamento più efficace. Ad esempio, cambiamenti nella dieta sono fondamentali nei bambini con vertigini parossistiche dell’infanzia.
A seconda della diagnosi, il recupero della disfunzione vestibolare periferica unilaterale può essere completa o quasi completa. Con problemi bilaterali e centrali, è necessaria un po’ di adattamento per realizzare la funzione quasi normale.
I bambini con disturbi vestibolari spesso rispondono bene a una forma specializzata di terapia chiamata terapia di riabilitazione vestibolare (VRT). Se è necessario un intervento chirurgico per stabilizzare o correggere una condizione, VRT può anche aiutare con il recupero post-operatorio. Con una disfunzione periferica o centrale unilaterale, le VRT possono concentrarsi su assuefazione e la formazione nell'utilizzo della funzione vestibolare rimanente; tuttavia, con disfunzioni bilaterali, la VRT deve concentrarsi sulla sostituzione della formazione (ad esempio, il ricorso pesante sulle informazioni provenienti dai sistemi sensoriali visivi e somatosensoriali).
La VRT è un programma di esercizi su misura per affrontare il controllo movimenti oculari, acuità visiva dinamica, equilibrio, sviluppo dei riflessi, e le funzioni del movimento del corpo-. Esercizi VRT dovrebbero essere basati su età, gli interessi di un bambino, il livello di comprensione, e risultati dei test. Ad esempio, un adeguato equilibrio o movimenti oculari esercizi per un bambino di età compresa tra 4 maggio comportare disegni a blocchi o in equilibrio su una sfera di terapia. Per un bambino di età compresa tra 7, lo stesso obiettivo può essere realizzato con un labirinto visivo o corso equilibrio ostacoli.
VRT può essere efficace per ridurre o eliminare le vertigini, migliorando il controllo visivo-motoria, migliorare l'equilibrio e la coordinazione, 33 migliorare l'acuità visiva, il 13 e promuovere lo sviluppo normale.
I bambini tipicamente rispondono più rapidamente alle VRT rispetto agli adulti, a causa della loro maggiore plasticità, della capacità dei loro sistemi neurologici di compensare in modo più rapido e adattarsi alle deficit vestibolare. Inoltre, i bambini tendono ad essere meno timorosi dei movimento rispetto agli adulti, in modo da partecipare bene negli aspetti di equilibrio e di movimento di terapia, se il terapeuta mantiene un coinvolgimento divertente ed interessante.
RIABILITAZIONE
L'efficacia del programma di trattamento VRT di un bambino dipende in parte dalla cooperazione, la pazienza e la comprensione dei genitori e tutori nel sostenere la conformità e il progresso. I genitori dovrebbero essere dotati di un programma specifico di casa-esercizio per rafforzare i movimenti VRT e le attività svolte presso la clinica.
Gli insegnanti e terapisti occupazionali e fisici possono anche aiutare a integrare la formazione vestibolare nelle attività a scuola. Essi devono lavorare a stretto contatto con i genitori per identificare le tolleranze del bambino per la terapia vestibolare e di sviluppare e modificare il programma di terapia individualizzata di conseguenza. Attività Calming dovrebbero essere inclusi come parte del programma, al fine di aiutare il bambino evitare di diventare eccessivamente stimolati, malato, spaventati o stressati. Un programma di VRT ben strutturato può fare una differenza significativa in funzione di un bambino, le capacità, lo sviluppo, l'equilibrio e fiducia in se stessi di apprendimento.
TRATTAMENTO
Il trattamento delle vertigini in età pediatrica è strettamente dipendente dall'identificazio¬ne dell'eziologia e deve essere attentamente ponderato. TI primo provvedimento da attuare è eliminare eventuali fattori scatenanti i sintomi (come problemi oculari, affaticamento, stress), l'assicurare genitori e bambino sulla trascurabile probabilità di patologie gravi all'origine dei disturbi, illustrare chiaramente quale sarà l'approccio diagnostico, formulare prescrizioni farmacologiche mirate e solo se strettamente indispensabili, suggerire da subito l'attuazione
di un idoneo atteggiamento comportamentale riabilitativo.
Trattamento farmacologico
L'utilizzo di farmaci in età pediatrica per il trattamento di disturbi dell'equilibrio -mente indispensabile, al fine di ridurre al minimo effetti collaterali, come sonnolenza, deficit dell'attenzione e dell'apprendimento, depressione, manifestazioni allergiche, ecc.. In Tabella VI sono indicati i principali principi attivi che possono essere utilizzati in ambito pediatrico, che sono simili a quelli utilizzati nell'adulto, con opportune variazioni posologiche in rapporto al peso e all'età.22,2433,42
FARMACI AD AZIONE SEDATIVA E/0 ANTIEMETICA:
Ciproeptadina; Dimenidrinato; Scopolamina transdermica; Metoclopramide; Levo-Sulpiride; Domperidone
FARMACI AD AZIONE MISTA:
Betaistina; Cinnarizina, Flunarizina (secondo età); Triptofano; Gingko biloba-fitosoma-Riboflavina-Coenzima Q10
ANTI-DOLORIFICI:
Ibuprofene; Paracetamolo
Tabella VI. Trattamento farmacologico della vertigine infantile
Trattamento riabilitativo
In considerazione dell'età e del grado di sviluppo psico-fisico del bimbo, non appena for¬mulata un'ipotesi diagnostica, è indispensabile una precoce mobilizzazione, secondo criteri applicati anche per il paziente adulto, anche facendo utilizzo di semplici tecniche "diversive", come l'attività Indica con amici e coetanei, la "pet-therapy",. Cherniak EP, Cherniak AR. 2014, la "hyppo-theray" Zandikar M, Kastrin A 2011.Le passeggiate in compagnia di familiari e amici o il "nordic walking".', Cherniak EP, Cherniak AR. 2014;Reuter Et Al.2011;Zandikar M, Kastrin A 2011. Alcuni esercizi possono essere personalizzati e proposti in modalità ludica mediante esecuzione ripetuta e controllata di movimenti, assunzione di posizioni e riproposizione dí situazioni in grado di evocare vertigini (ad esempio utilizzando una palla). Nell'adulto è risaputo come il compenso vestibolare richieda 2-3 mesi Lacour M, Bernar-Demanze L.2015. Nei bambini probabilmente questo processo è più rapido, per merito di una maggiore neuroplasticità . Medeíros et al.2005.
Un vero e proprio protocollo di rieducazione vestibolare si impone in caso di persistenza dei sintomi vertiginosi nonostante i provvedimenti comportamentali sopra esposti. Come. ogni programma riabilitativo in ambito vestibolare e posturale occorre mirare l'intervento all'abitudine, all'adattamento e alla sostituzione sensoriale, partendo dal riferimento dei dati anamnestici, clinici e strumentali dei test eseguiti. L'unico aspetto differente rispetto al paziente adulto consiste nella necessità di mantenere attivo l'interesse e la cooperazione de piccolo paziente, motivandolo continuamente. Tutte le attività proposte devono essere diver¬tenti e appropriate per età e sviluppo psico-fisico. Si possono effettuare giochi e utilizzare giocattoli o altri strumenti che facilitino i processi di stabilizzazione visiva e coordinazione psico-motoria Rine RM, Wiener-Vacher S.,2013.
Come per i pazienti adulti, il trattamento riabilitativo della VPP consiste nell'esecuzione di manovre di riposizionamento otolitico, non oggetto di trattazione specifica in questa sezione.
I disturbi dell'equilibrio che richiedono talora un intervento riabilitativo mirato sono costituiti dal deficit vestibolare (mono- e bilaterale) e dai disordini di natura centrale. Gli esercizi sono somministrati col fine di implementare i meccanismi di sostituzione e abitudine sotto la guida di un terapista qualificato, a garantire un miglioramento dello sviluppo psicomotorio del piccolo paziente Rosengren et al2010. I fini del trattamento riabilitativo vestibolare sono i medesimi di quelli dell'adulto Lacour M, Bernar-Demanze L.2015; Naber et al.,2011.Poiché il sistema vestibolare maturo contribuisce al mantenimento della stabilizzazione visiva, cervicale e posturale, è necessario un ripristino precoce delle abilità motorie del bambino, attraverso la stimolazione dei 3 riflessi vestibolo-motori: riflesso vestibolo-oculare, vestibolo-collico e vestibolo-spinale. La riabilitazione vestibolare prevede pertanto esercizi che includono movimenti degli occhi, del collo e del corpo al fine di stimolare in modo personalizzato tutti i sottosistemi coinvolti nel mantenimento dell'equilibrio e allo svolgimento di movimenti armonici. È di fondamentale importanza sensibilizzare e istruire i genitori o le figure che supporteranno l'azione del terapista con esercizi domiciliari mirati e riadattati dopo ogni controllo 16. Fernandes et al.,2015; Redfern et al.,2001;Srivastavaet al.,2011.
Al paziente viene richiesto di inseguire una: mira in movimento, muovere il capo fissando un punto fermo, sia sul piano orizzontale che verticale, dapprima in posizione seduta, quindi in piedi stando fermo, infine in serie successive durante una marcia sul posto. Parallelamente la stimolazione posturale viene effettuata mediante esercizi dapprima statici, poi dinamici, effettuati in piedi con appoggio podalico stabile o instabile (tappeto morbido), con o senza stimolazione visiva e cervicale, con e senza supporto stabilometrico statico o dinamico.2›'' La durata di ogni singola seduta, il numero di sedute settimanali e la durata complessiva del trattamento riabilitativo viene stabilita dal terapista in base al tipo e grado di deficit e alla velocità con cui si instaura il compenso vestibolare che, come abbiamo già accennato, in età pediatrica è facilitato da efficaci meccanismi di plasticità neuronale Horak FB.,2009.
I disordini vestibolari di origine centrale sono di raro riscontro. Tuttavia in presenza di difficoltà di apprendimento occorre sempre sospettare anche un deficit sensitivo-motorio o dell'equilibrio. Un deficit del controllo posturale è decisamente evidente in caso di paralisi cerebrale infantile e possibile in caso di sordità congenita 17. Gioacchini et al.,2014;. 37. Rajendran et al.,2013; Rine et al.,2013; Zandikar M, Kastrin A.,2011. In questi casi, come in presenza di deficit del SNC, autismo e nascita prematura, la stimolazione vestibolare migliora le abilità visive e motorie Rajendran et al.,2013. Gli esercizi devono essere adattati in modo da facilitare l'uso e l'integrazione dei sistemi ancora intatti ma non utilizzati e attivare in questo modo i meccanismi di compenso funzionale. Il programma riabilitativo prevede infatti esercizi per migliorare l'effetto stabilizzante della vista, esercizi di destabilizzazione posturale durante la fissazione visiva ed esercizi di allenamento della stabilità con contrasto multisensoriale ambientale.
È dibattuta la potenziale compromissione dell'equilibrio e la necessità di un intervento terapeutico farmacologico/riabilitativo in bambini affetti da ipoacusia neurosensoriale sot-toposti ad impianto cocleare mono- o bilaterale Jacot et al.,2009. È assodato come bambini con sordità congenita possano manifestare una compromissione della funzionalità vestibolare, tuttavia si innescano precocemente meccanismi di compenso posturale e di controllo del guadagno sul canale visivo. L'efficace plasticità del SNC in età pediatrica consente l'innesco di strategie di recupero funzionale e sostituzione sensoriale tali da non compromettere i normali movimenti della vita quotidiana, come camminare, correre, giocare, svolgere sport. I processi di sostitu¬zione sensoriale infatti, soprattutto l'apparato visivo e quello somatosensoriale, garantiscono un controllo posturale sufficiente ad impedire l'insorgenza di disturbi dell'equilibrio anche in caso di riabilitazione uditiva mediante impianto cocleare mono- o bilaterale Ciorba et al.2012; . Rajendran et al., 2013; Suarez et al.,2007.
L'area di pediatrico di valutazione vestibolare è altamente interessante, in cui sono necessari ulteriori lavori clinici e di ricerca. E 'importante studiare ulteriormente disturbi vestibolari e gli aspetti del loro co-morbidità con una miriade di altri disturbi. Molti medici ritengono che una casistica vestibolare è uno degli strumenti più preziosi utilizzati con un paziente di qualsiasi età che dimostra un disturbo vestibolare. Più efficiente e conveniente protocolli case history e strumenti di screening dovrebbero essere sviluppati per i pazienti pediatrici, oltre a un maggior grado di collaborazione tra le discipline. È importante considerare attentamente ingresso di tutti i membri della squadra e tutti i componenti della batteria diagnostica, come clinici modificano tecniche di valutazione adulti per uso con i bambini. Sono necessarie ulteriori ricerche per quanto riguarda la massima sicurezza di batteria di test e la validità, oltre a strumenti di valutazione e le prove secondarie che non sono ancora stati studiati. Come si sviluppano le procedure, è fondamentale anche per la raccolta dei dati normativi pediatrici in modo che i risultati pediatrici non sono confrontati con i dati normativi adulti e in modo tale erronea interpretazione non avviene. Tecniche di test possono essere modificati per non udenti e gli altri bambini a rischio che possono dimostrare una elevata incidenza di risultati vestibolari anomale. Molti dovrebbero essere testati il più presto possibile. Per quanto riguarda il trattamento, è importante raccogliere prove, applicare le migliori pratiche verso la gestione del bambino e della sua / suo disturbo vestibolare, e impiegare un approccio di squadra, come con la valutazione. I medici non dovrebbero presumere che la maturazione o risarcimento sarà preclude automaticamente la necessità di trattamento. Come nel caso di perdita di udito, i medici devono cercare modi per identificare in epoche precedenti e ad avviare un intervento precoce quando e se giustificato.
Nelle vertigini del bambino, bisogna dunque sempre effettuare un esame clinico otologico, neurologico e vestibolare (comprendente in particolare il test di Halmagyi di rotazione rapida della testa e la ricerca di un nistagmo spontaneo e provocato sotto occhiali di Frenzel o da videoscopia) prima di precipitarsi su esami complementari eccessivi e costosi. I primi esami diagnostici da richiedere in priorità sono un esame vestibolare (che comprende almeno un test calorico e dei PEOM) e un esame oftalmologico per escludere un disturbo della rifrazione e un disturbo della vergenza od oculomotorio. Quando ricorrere alla diagnostica per immagini? Certamente non di prima intenzione, tranne il caso in cui l'esame neurologico mostri delle anomalie che possono fare sospettare un processo espansivo endocranico o se un contesto di trauma cranico si associa a segni che evocano la possibilità di una frattura della rocca. La TC sarà allora il primo esame da richiedere in quanto più rapida (meno di 1 min di immobilizzazione richiesta con le nuove tecniche di TC elicoidale). La RM potrà essere realizzata per precisare la natura delle immagini individuate alla TC. Nel bambino giovane un esame diagnostico (RM o TC) richiederà una premedicazione, o anche un'anestesia generale, e questi esami rappresentano dunque un rischio non trascurabile; inoltre sono molto costosi. Non è dunque giustificato prescrivere questi esami di fronte a una vertigine nel bambino prima di aver effettuato un esame clinico oto-neuro-vestibolare completo, una valutazione audiovestibolare e una visita oftalmologica.
References
Akagi H, Yuen K, Maeda Y,
Fukushima K, Kariya S, Orita Y, Kataoka Y, Ogawa T, Nishizald Ménière's disease
in childbood, Int J Pediatr Otorhinolaryngol. 2001;61:259-64.Akin FW,
& Murnane, OD . Vestibular evoked myogenic potentials: preliminary report. Journal of the American
Academy of Audiology, 2000;12 (9), 445-52.
Abadie V., Wiener-Vacher S.R., Morisseau-Durand M.P., Poree C., Amiel J., Amanou L., e al. Vestibular anomalies in CHARGE syndrome: investigations and consequences for postural development Eur. J. Pediatr. 2000 ; 159 : 165-171
Agrup C. Immune-mediated audio-vestibular disorders in the pediatric population: a review. Int J Aud. 2008; 47:56–565.
Alghadir AH, Iqbal ZA, Whitney SL. An update on vestibular pbysical therapy. J Chienese Med Ass 2013;76;1-8.
Amanou L., Morisseau-Durand M.P., Wiener-Vacher S.R.,
Marianovski R., Abadie V., Manac'h Y. L'oreille interne dans l'association
CHARGE Ann. Otolaryngol. Chir. Cervicofac. 2000 ; 117 : 161-167
Andrieu-Guitrancourt,
JA, Peron, JM, Dehesdin, D., Aubet, J., & Courtin, P. (1981). Normal vestibular responses to
air caloric tests in children. , 245-250.
Angeli S. Value of vestibular testing in young children with sensorineural hearing loss. Arch Otolaryngol Head Neck Surg. 2003; 129(4):478–482.
Anoh-Tanon M.J., Bremond-Gignac D., Wiener-Vacher S.R. Vertigo is an underestimated symptom of ocular disorders: dizzy children do not always need MRI Pediatr. Neurol. 2000 ; 23 : 49-53 [cross-ref]
Aust G, Novotn5i M. IV Méniére's disease and various types of vertigo in children. Int Tinnitus 2005;11:66-8.
Bacher E, Wright C, Karmody C. The incidence and distribution of cupular deposit in the pediatric vestibular labyrinth. Laryngoscope. 2002; 112:147–151.
Balatsouras DG, Kaberos A, Assimakopoulos D, Katotomichelakis M, Economou Korres SG. Etiology of vertigo in cbildren. Int J Pediatr Otorhinolaryngol. 2007;71:487-94
Balzanellí C, Carlassara L, Redaelli De Zinis LO. La vertigine in età pediatrica. Atti. del 1015 Congresso Nazionale SIO. Catania 2014.
Balzanelli C, Gioia E L'espressione grafica della vertigine in età pediatrica. Atti del Congresso Nazionale VIS. Modena 2014
Balkany T, Finkel R. The dizzy child. Ear Hear. 1986; 7(3):138–142.
Batson G. Benign paroxysmal vertigo of childhood: a review of the literature. Ped Child Health. 2004; 9:31–34.
Bauer F, Westhofen M. Vestibulotoxic effects of the cytostatic drug carboplatin in patient with head and neck tumors. HNO. 1992; 40:19–24.
Biel L. Raising a sensory smart child. Penguin Books. 2009.
Braswell J, Rine R. Evidence that vestibular
hypo¬function affects reading acuity in children. Int J Pediat
Otorhinolaryngol. 2006; 70(11):1957–1965.
Brookhouser, PE, Cyr, DB, & Beauchaine, KA (1982). Vestibular
findings in the deaf and hard of hearing. Otolaryngology:
Head and Neck Surgery, 90 , 773-777.
Bucci M.P., Kapoula Z., Yang Q., Wiener-Vacher S., Bremond-Gignac D. Saccades, vergence and combined movements in a young subject with Congenital Central Hypoventilation Syndrome (CCHS) Strabismus 2003 ; 11 : 95-107 [cross-ref]
Bucci M.P., Kapoula Z., Yang Q., Wiener-Vacher S., Bremond-Gignac D. Abnormalities of vergence latency in children with vertigo J. Neurol. 2004 ; 251 : 204-213 [cross-ref]
Bucci M.P., Kapoula Z., Yang Q., Bremond-Gignac D., Wiener-Vacher S. Speed-accuracy of saccades, vergence and combined movements in children with vertigo Exp. Brain Res. 2004 ; 157 : 286-295.
Casselbrant M, Villardo R, Mandel E. Balance and otitis media with effusion. Int J Audiol. 2008; 47(9):584–589.
Chang C, Young Y. Caloric and vestibular evoked myogenic potential tests in evaluating children with benign paroxysmal vertigo. Int J Pediatr Otorhinolaryngol. 2007;71(3):495–499.
Cherniak EP, Cherniak AR. The benefit of pets and animal-assisted therapy. Curr Gerontol Geriatr Res. 2014;2014:623203. doi: 10.1155/2014/623203.
Church M, Gerkin K. Hearing disorders in children with
fetal alcohol syndrome: findings from case reports. Pediatrics. 1988;
82:147–154.
Ciorba A, Bovo R, Trevisi P, Rosignoli M, Airnoní C,
Castiglione A, Martini A. Postoperative complications in cocblear implants: a
retrospettive analysis of 438 consecutive cases. Eur Arch Otorhinolaryngol.
2012;269;1599-603.
Colebatch, JG, &
Halmagyi, GM (1992). Vestibular evoked potentials in human neck
muscles before and after unilateral vestibular deafferentation. Neurology, 42 , 1635-1636.
Cumberworth VL, Patel NN, Rogers W, Kenyon GS. The
maturation of balance in cbildren J Laryngol Otol. 2007;121:449-54.
Curthoys IS, Manzari L, Smulders YE, Burgess AM. A review of the scientific basis and practical application of a new test of utricular function ocular vestibular-evoked myogenic potentials to bone-conducted vibration, Acta Otorhinolaryngol Ital. 2009;29:179-86.
Cyr, DG (1980). Vestibular testing in children. Annals of Otology, Rhinology and
Laryngology, 89 , 63-69.
Cyr, DG (1983). The vestibular
system: pediatric considerations. Seminars in Hearing, 4 (1), 33-45.
Cyr, DG, Moore GF, & Moller, CG (1988). Clinical
application of computerized dynamic posturography. Entechnology,
September , 36-47.
Di Fabio RP & Foudriat PA (1995). Responsiveness
and reliability of a pediatric strategy score for balance. Physiology
Research International, 1 (3), 180-194.
D'Agostin R, Tarantino V, Melagrana A, Taborelli G.
Otoneurologic evaluation of cbild vertigo. Int J Pediatr Otorhinolaryngol. 1997;40:133-9.
Dispenza F, De Stefano A. Vertigo in cbildhood: a methodological approacb. Bratisl Lek Listy, 2012;113:256-9.
Donat, JFG, Donat, JR, & Swe Lay, K. (1980). Changing response to caloric stimulation with gestational age in infants. Neurology, 30 , 776-778.
Düwel P, Westhofen IVI. Vestibular diagnostics in cbildhood methods and assessment Laryngorhinootologie. 2002;81:263-7.
Enbom H, Magnusson M, Pyykko I. Postural compensation in children with congenital or early acquired bilateral vestibular loss. Ann Otol Rhinol Laryngol. 1991; 100(6): 472–478.
Erbek SH, Erbek SS, Ydmaz I, Topal O, Ozgirgin N,
Ozluoglu LN, Alehan E Vertigo cbildhood: a clinical experience. Int
J Pediatr Otorhinolaryngol. 2006;70:1547-54.
Eviatar, L., Eviatar, A., & Naray, I. (1974). Maturation
of neurovestibular responses in infants. Developmental Medical Child Neurology, 16 , 435-446.
Eviatar, L., Miranda, S., Eviatar, A.,
Freeman, K., & Borkowski, M. (1978). Development of nystagmus in response to
vestibular stimulation in infants. Annals of Neurology, 5 , 508-514.
Fernandes R, Hariprasad S, Kumar VK. Physical therapy
management for balance deficits in children with bearing impairments: A
systematic review. J Ped Child Health. 2015:1-6. doi:10.1111/jpc.12867.
Fife, TD, Tusa, RJ, Furman, JM, Zee, DS, Frohman, E., Baloh, RW, Hain, T., Goebel, J., Demer, J., & Eviatar, L. (2000). Assessment: vestibular testing techniques in adults and children. Neurology, 55 , 1431-1441.
Gagnon I, Swaine B, Friedman D, et al. Children show decreased dynamic balance after mild traumatic brain injury. Arch Phys Med Rehabil. 2004; 85(3):444–452.
Gioacchini FM, Alicandri-Ciuffeli M, kaleci S, Magliulo G. Prevalence and diagnosis of
vestibular disorders in children: A review. Int J Pediatr Otorhinol. 2014;78:718-724.
Gruber M, Cohen-Kerem R, Kaminer M, Shupak A. Vertigo in children and adolescents: characteristics and outcome. Scientific World Journal. 2012;2012:109624.
Halmagyi, GM, &
Colebatch, JG (1995). Vestibular evoked myogenic potentials in the
sternocleidomastoid muscle are not of lateral canal origin. Acta Otolarngologica Supplement, 520 (1), 1-3.
Hirabayashi, S. & Iwasaki, Y. (1995). Developmental
perspective of sensory organization on postural control. Brain
Development, 17 (2), 111-113.
Horak FB. Postural compensatíon for vestibular loss. Ann N Y Acad Sci. 2009;1164;76-81
Humphriss RL, Hall AJ. Dizziness in 10 year old children: an epidemiological study. Int J Pediatr Otorhinolaryngol. 2011;75:395-400.
Jacot E, Van Den Abbdeele T, Debre HR, Wiener-Vacher SR. Vestibular impairments pre¬ and post-cochlear implant children. Int J Ped Otorhinolaryngol. 2009;73:209-17.
Jahn K, Langhagen T, Heinen E Vertigo and dizziness in children. Curr Opin Neurol. 2015;28:78-82.
Jahn K. Vertigo and balance in children-diagnostic approach and insights from imaging. Eur J Paediatr Neurol. 2011;15:289-94.
Jahn K. Vertigo in children. Clinical presentation, course and treatment. Nervenarzt. 2009;80:900-8.
Jinkowic T, Gelo J, Astley S. Children and youth with fetal alcohol spectrum disorders: summary of intervention and recommendations after clinical diagnosing. Intellect Dev Disabil. 2010; 48:330–344.
Keating, N. A comparison of duration of nystagmus as
measured by the Southern California Post-rotary Nystagmus Test and
electronystagmography. Amer J Occ Ther. 1979; 33:92–96.
Kelsch, TA, Schaefer, LA, & Esquivel, CR (2006). Vestibular
evoked myogenic potentials in young children: test parameters and normative
data. Laryngoscope, 116 (6), 895-900.
Kenyon, GS (1988). Neuro-otological
findings in normal children. Journal of the Royal Society of Medicine, 81 , 645-648.
Krejcova, H., Filipova, M., & Krejci, L. (1975). Vestibulometric
evaluation of the caloric reaction in children and in adults. Electrophysiology
Clinical Neurophysiology, 39 (4), 441.
Levens, SL (1988). Electronystagmography
in normal children. British Journal of Audiology, 22 , 51-56.
Lacour M, Bernar-Demanze L. Interaction between vestibular compensatíon mechanism and vestibular rehabilitation therapy: 10 recornmendations for optimal functional recovery, Frontiers Neurotol. 2015;5:1-14.
Langhagen T, Schroeder AS, Rettinger N, Borggraefe I, Jahn K. Migraine-related vertigo and somatoform vertigo frequently occur in children and are often associated. Neuropediatrics. 2013 ;44:55-8.
Lernpert T, Olesen J, Waterston J, Seemungal B, Carey J, Bisdorff A, Versino M, Evers S, Newman-Toker D. Vestibular migraine: diagnostic criteria. J Vestib Res. 2012;22:167-72,
MacDougall HG, Weber KP, McGarvie LA, Halmagyi GM, Curthoys IS. The video head impulse test: diagnostic accuracy in peripheral vestibulopathy. Neurology. 2009;73:1134-41.
Manzarí L, Burgess AM, Macdougall HG, Curthoys IS. Objective measures of vestibular function during can acute vertigo attack in a very young child. Eur Arch Otorhinolaryngol. 2012;269:2589-92.
Marcelli V, Piazza F, Pisani F, Marciano E.
Neuro-ontological features of benign paroxysmal vertigo and benign paroxysmal
positioning vertigo in children. :
a follow-up study. Brain Devel. 2006; 28:80–84.
McCaslin DL, Jacobson GP, Gruenwald JM. The predominant
forms of vertigo in children and their associated findings on balance function
testing. Otolaryngol Clin North 2011;44:291-307.
Medeíros 1IRT, Bittar RSN, Pedalini MEB, Lorenzi MC, Formigoni LG, Bento RE Vestibular Rehabilitation Therapy in Children. Otol Neurotol. 2005;26;699-703.
Mulch, G. & Peterman, W. (1979). Influence of age on results of vestibular function tests: review of literature and presentation of caloric test results. Annals of Otology, Rhinology, and Laryngology, 88 , 1-17.
Naber CM, Water-Schmeder O, Bohrer PM, Matonak K, Bernstein AL, Merchant MA. Interdisciplinary treatment for vestibular dysfunction: the effectiveness of mindfulness, cognitive-behavioral techniques and vestibular rehabilitation. Otolayngol Head Neck Surg. 2011;145;117-24.
Ndiaye I.C., Rassi S.J., Wiener-Vacher S.R. Cochleovestibular impairment in pediatric Cogan's syndrome Pediatrics 2002 ; 109 : E38
Niemensivu R, Kentala E, Wiener-Vacher S, Pyykko I. Evaluation
of vertiginous children. Eur Arch Otorhinolaryngol. 2007; 264(10):1129–1135.
O'Reilly R, Grindle C, Zwicky EF, Morlet T. Development
of the vestibular system and bal-ance function: differential diagnosis in the
pedíatric population. Otolaryngol Clin North Am. 2011;44:251-71.
Ornitz, EM, Atwell, CW, Walter, DO, Hartmann, EE, & Kaplan, AR (1979). The maturation of vestibular nystagmus in infancy and childhood. Acta Otolaryngologica, 88 , 244-256.
Pagnini P, Verrecchía L, Giannoni B, Vannucchi P. Migraine-related Vertigo (MV). Acta Otorhinolaryngol Ital. 2003;23(5 Suppl 75):19-27.
Rajendran V, Ray FG, Jeevanantham D. Effect of exercise on vestibular related impairments in hearing-impaired children. Alexandria j Med. 2013;49:7-12.
Redfern MS, Yardley L, Bronstein AM, Visual influences on balance. j Anxiety Disorders 2001;15:81-94,
Reuter I, Mehnert S, Leone P, Kaps M, Oechsner M, Engelhardt M. Effects of a flexibility and relaxation program, walking and nordic walking. j Aging Res. 2011;2011:232473. doi: 10.4061/2011/232473.
Riina N, Ilmari P, Kentala E. Vertigo and imbalance in children: a retrospective study in a Helsinki University otorhinolaryngology clinic. Arch Otolaryngol Head Neck Surg. 2005;131:996-1000.
Rine R, Rubish K, Feeney C. Measurement of sensory
system effectiveness and maturational changes in postural control in young
children. Ped Phys Ther. 1998;10:16–22.
Rine, RM, Cornwal,l G., Gan, K., LoCascio, C., O-Hare,
T., Robinson, E., & Rice, M. (2000). Evidence of
progressive delay of motor development in children with sensorineural hearing
loss and concurrent vestibular dysfunction. Perceptual
Motor Skills, 90 , 1101-1112.
Rine R, Braswell J. A clinical test of dynamic visual acuity for children. Int J Ped Otorhinolaryngol. 2003; 67(11):1195–1201.
Rine R, Braswell J, Fisher D, et al. Improvement of motor development and postural control following intervention in children with sensorineural hearing loss and vestibular impairment. Int J Ped Otorhinolaryngol. 2004; 68(9):1141–1148.
Rine RM. Growing evidence for balance and vestibular problems in children. Audiol Med. 2009; 7(3):138–142
Rine RM, Wiener-Vacher S. Evaluation and treatment of vestibular disfunction in children. NeuroRehabilitation. 2013;32:507 -18.
Rodgers GK, Telischi FF. Meniere's disease in children. Otolaryngol Clin North Arn 1997;30:1101-4.
Rosengren SM, Welgarnpola MS, Colebatch JG. Vestibular
evoked myogenic potentials: past, present and future. Clin Neurophysiol.
2010;121:636-51.
Saka N, Imaí T, Seo T, Ohta S, Fujimori K, Masumura C,
Inohara H, Sakagami M. Analysis of benign paroxysmal positional nystagmus in
children. Int J Pediatr Otorhinolaryngol. 2013;77:233-6.
Sheykholeslami, K., Megerian, CA, Arnold, JE, & Kaga, K. (2005). Vestibular evoked myogenic potentials in infancy and early childhood. Laryngoscope, 115 (8), 1440-1444.
Shimizu, K., Asai, M., Takata, S., & Watanabe, Y. (1994). The development of equilibrium function in childhood. In: K. Taguchi, M. Igarashi, & S. Mori, (Eds.), Vestibular and Neural Front (pp. 183-186). New York, NY: Elsevier Science BV
Srivastava M, Gupta A, Talukdar U, Kaira BP, Lahan V. Effect of parental training in manag-ing the bebavioral problem of early childhood. Indian 3- Pediatr, 2011;78:973-8.
Suarez H, Angeli S, Suarez A, et al. Balance sensory
organization in children with profound hearing loss and cochlear implants. Int
J Pediatr Otorhinolaryngol. 2007; 71(4):629–637.
Staller, SJ, Goin, DW, & Hildebrandt, M. (1986). Pediatric
vestibular evaluation with harmonic acceleration. Otolaryngology
Head & Neck Surgery, 95 (4), 471-476.
Strupp M, Versino M, Brandi T. Vestibular Migraine. Handb Clin Neurol. 2010;97:755-71.
Szírmaí A. Vestibular disorders in childhood and adolescent. Eur Arch Otorhinolaryngol 2010;267:1801-4.
Tusa RJ, Saada AA jr, Niparko JK. Dizziness in cbildhood. J Child Neurol. 1994;9:261-74.
Weisleder P, Fife TD. Dízziness and headacher a common
association in children and adolescent. J Child Neurol. 2001;16:727-30.
Uneri A, Turkdogan D. Evaluation of vestibular functions in children with
vertigo attacks. Arch Dis Child. 2003; 68:510–511.
Valente, M. (2007). Maturational effects of the vestibular system: a study of rotary chair, computerized dynamic posturography and vestibular evoked myogenic potentials with children. Journal of the American Academy of Audiology, June 18 (6), 461-481.
Viccaro M, Mancini P, La Gamma R, et al. Positional vertigo and cochlear implantation. Otol Neurotol. 2007; 28:764–767.
Waldron M, Matthews J, Johnson I. The effect of otitis
media with effusions on balance in children. Clin Otolaryngol Allied Sci. 2004;
29:318–320.
Van der Laan, FL, & Oosterveld, WJ (1974). Age and
vestibular function. Aero Medicine, 45 (5), 540-547. –
Weiss A, Phillips J. Congenital and compensated vestibular dysfunction in childhood: An overlooked entity. J Child Neurol.2006; 21(7):572–579.
Wiener-Vacher S.R., Toupet F. Quelle est la place de l'appareil vestibulaire dans les troubles de l'équilibre de l'enfant? Évol Psychomotrices 1997 ; 9 : 212-215
Wiener-Vacher S.R., Toupet F., François M., Van Den Abbeele T., Viala P., e al. Conséquences des déficits vestibulaires sur le développement du contrôle postural chez l'enfant Journées parisiennes de pédiatrie Paris: Flammarion (1998). 283-287
Wiener-Vacher S.R. Conséquences posturo-locomotrices de déficits vestibulaires chez l'enfant. Posture et équilibre Marseille: Solal (2001). p. 87–94.
Wiener-Vacher S.R., Bril B., Ledebt A. Changes in otolithic function in infants learning to walk observed with off vertical axis rotation Neuroscience 1994 ; 20 : 1108[abstract].
Wiener-Vacher S.R., Toupet F., Narcy P. Canal and otolith vestibulo-ocular reflexes to vertical and off vertical axis rotation in children learning to walk Acta Otolaryngol. 1996 ; 116 : 657-665
Wiener-Vacher S.R., Ledebt A., Bril B. Changes in otolith VOR to Off vertical axis rotation in infants learning to walk: preliminary results of a longitudinal study Ann. N. Y. Acad. Sci. 1996 ; 781 : 709-712 [cross-ref]
Wiener-Vacher S.R., Toupet F., Elmaleh M., Narcy P. Pathologie cochléo-vestibulaire post-traumatique chez l'enfant Lettre ORL Chir. Cervicofac 1998 ; 236 : 21-23
Wiener-Vacher S.R. What is useful in vestibular testing Otorhinolaryngol Nova 2001 ; 11 : 95-98 [cross-ref]
Wiener-Vacher S.R. Clinical application of the Off Vertical Axis Rotation test (OVAR) Adv. Otorhinolaryngol. 2001 ; 58 : 88-97
Wiener-Vacher SR, Vestibular disorders in children, Int J Audíol. 2008;47:578-83
Worden B, Blevins N. Pediatric vestibulopathy and pseudovestibulopathy: differential diagnosis and management. Curr Opin Otolaryngol Head Neck Surg. 2007; 15(5):304–309.
Yukawa K, Hagiwara A, Ogawa Y, et al. Bilateral progressive hearing loss and vestibular dysfunction with inner ear antibodies. Auris Nasus Larynx. 2010; 37:223–228.
Zandikar M, Kastrin A. Effects of hyppotherapy and therapeutic horseback riding on postural control or balance in children cerebral palsy: a meta-analysis, Dev Med Child Neur. 2011; 53:684-91.
Esempi di malattie genetiche
Sindrome branchiootorenale BOR, Sindrome BOR, Displasia branchiootorenale, Branchio-Otorenale Displasia,Branchio-Otorenale Syndrome, Sindrome Branchio-Oto-Renale, Sindrome di Melnick-Fraser
- trasmissione autosomica dominante Fig.1
- espressività variabile
- sordità neurosensoriale. mista, trasmissiva Fig.2
- boffoni preauricolari Fig.3
- cisti-fistole del collo (branchiali) Fig.4
- malformazione del padiglione auricolare Fig.5
- malformazioni renali (agenesia-ipoplasia)Fig.6
|
|
|
|
|
Fig.1
|
Fig.2 |
Fig. 3 |
|
|
|
|
|
Fig.4 |
Fig.5 |
Fig.6 |
Che cosa è la sindrome Branchio-Oto-Renale?
LA Sindrome Branchio-Oto-Renale (BOR) è una condizione genetica, nota anche come sindrome di Melnick-Fraser, è caratterizzata da un'associazione di: 1) fistole brachiale o cisti lungo i lati del collo corrispondenti alla posizione delle fessure branchiali embriologiche; 2) malformazioni dell'orecchio, che possono includere l'orecchio interno, medio ed esterno; 3) malformazioni renali, che possono variare in gravità da ipoplasia renale alla agenesia con conseguente insufficienza renale. I segni ed i sintomi di questa condizione , tuttavia, possono variare.
"Branchio-" si riferisce al secondo arco branchiale, che è una struttura che negli embrioni dà origine ai tessuti nella parte anteriore e laterale del collo. Nelle persone con sindrome branchiootorenale , sviluppo anormale del secondo arco branchiale possono causare la formazione delle masse al collo chiamato cisti branchiale leporino. In alcune persone, connessioni anormali chiamati modulo fistole passaggi tra queste cisti e la superficie del collo. Fistole può anche svilupparsi tra la pelle del collo e della gola, vicino alle tonsille. Cisti schisi branchiali e fistole possono causare problemi di salute se diventano infette.
"Oto-" si riferisce all'orecchio; la maggior parte delle persone con sindrome branchiootorenale hanno perdite e altre anomalie dell'orecchio dell'udito. La perdita dell'udito è conosciuta come la sordità neurosensoriale se è causato da cambiamenti nella parte interna dell'orecchio e sordità conduttiva se è causato da cambiamenti dell'orecchio medio. La sindrome Branchio-Oto-Renale può anche comportare la perdita che deriva da cambiamenti sia l'orecchio interno e l'orecchio medio, che si chiama perdita uditiva mista dell'udito. Altre anomalie dell'orecchio associate alla sindrome di Branchio-Oto-Renale comprendono malformazioni dell'orecchio interno o l'orecchio medio e orecchio esterno di forma anomala (padiglioni auricolari). Alcune persone colpite hanno anche piccoli fori nella pelle (pit preauricolari) o piccoli lembi di pelle (tag preauricolari) proprio di fronte l'orecchio.
"Renale" si riferisce ai reni; La sindrome Branchio-Oto-Renale provoca alterazioni della struttura e della funzione renale. Queste anomalie vanno da lievi a gravi e possono interessare uno o entrambi i reni. In alcuni casi, la malattia renale allo stadio terminale (ESRD) si sviluppa più tardi nella vita. Questa grave condizione si verifica quando i reni diventano incapaci di filtrare efficacemente i liquidi ei prodotti di scarto dal corpo.
Manifestazioni generali
La displasia renale è riportato in oltre due terzi dei pazienti e varia da pali rastremati superiori (duplicazione del sistema di raccolta) alla marcata agenesia del rene. La sindrome può includere sequenza Potter.
Ereditata in modo autosomico dominante, ogni bambino di un genitore con la sindrome di BOR ha una probabilità del 50% di presentare con la malattia. Si pensa che il 90% dei casi di sindrome BOR sono dovuti a eredità, mentre il rimanente 10% dei casi sono dovuti a mutazioni acquisite. BOR mostra espressività variabile, che rappresentano le differenze nella gravità dei sintomi tra i membri della famiglia. Penetranza, tuttavia, è 100%. Attesa (propensione per le generazioni successive di presentare con la malattia in età più giovane) non si verifica.
Storia
• Nel 1864 Heusinger è stato il primo a riconoscere un'associazione tra branchiale fistole leporino, pozzi preauricolari, e compromissione dell'udito.
• Nel 1975, Melnick et al. e Fraser et al. descritto sindrome BOR come entità specifica con un pattern di ereditarietà autosomica dominante.
Epidemiologia, Quanto è diffusa la sindrome Branchio-Oto-Renale ?
I ricercatori stimano che la sindrome Branchio-Oto-Renale colpisce circa 1 su 40.000 persone.
Quali geni sono legati alla sindrome Branchio-Oto-Renale ?
Le mutazioni in tre geni, EYA1, SIX1 e SIX5, sono noti per causare la sindrome Branchio-Oto-Renale . Circa il 40 per cento delle persone con questa condizione hanno una mutazione nel gene EYA1. Eredità autosomica dominante indica che il gene difettoso responsabile di una malattia si trova in una autosoma , e solo una copia del gene è sufficiente a causare la malattia, quando ereditato da un genitore che ha il disturbo. Mutazioni SIX1 eSIX5 sono cause molto meno comuni della malattia.
Le proteine prodotte dal EYA1, SIX1, ei geni SIX5 svolgono un ruolo importante nello sviluppo prima della nascita. La proteina EYA1 interagisce con diverse altre proteine, tra cui SIX1 e SIX5, per regolare l'attività dei geni coinvolti in molti aspetti dello sviluppo embrionale. La ricerca suggerisce che queste interazioni proteine sono essenziali per la normale formazione di molti organi e tessuti, tra cui il secondo arco branchiale, orecchie e reni. Mutazioni nel EYA1, SIX1, o gene SIX5 spesso interrompono la capacità delle proteine 'di interagire uno con l'altro e regolare l'attività dei geni. Le conseguenti variazioni genetiche influenzano lo sviluppo di organi e tessuti prima della nascita, che porta gli elementi caratteristici della sindrome Branchio-Oto-Renale .
Mutazioni Eya1 e SIX1 sono stati trovati anche in alcune persone con una condizione nota come branchio-oto (BO) sindrome. Questa condizione include molte delle stesse caratteristiche come la sindrome branchiootorenale, ma individui affetti non hanno renali (renale) anomalie. Le due condizioni sono altrimenti così simili che i ricercatori spesso li considerano insieme (BOR / sindrome BO). Non è chiaro il motivo per cui alcune mutazioni Eya1 e SIX1 sono associati ad anomalie renali e altri non lo sono.
Alcune persone con la sindrome di Branchio-Oto-Renale non hanno una mutazione identificata nel EYA1, SIX1,o gene SIX5. In questi casi, la causa della condizione è sconosciuta.
Per saperne di più sul EYA1 , SIX1 , e SIX5 geni.
Come i pazienti ereditano la sindrome Branchio-Oto-Renale ?
Questa condizione è ereditata come carattere autosomico dominante, il che significa una sola copia del gene alterato in ogni cella è sufficiente a causare il disturbo. In circa il 90 per cento dei casi, una persona affetta eredita la mutazione da un genitore affetto. I casi rimanenti derivano da nuove mutazioni nel gene, e si verificano in persone senza storia di malattia nella loro famiglia.
Manifestazioni otorinolaringoiatriche
Le malformazioni auricolari comprendono pozzi preauricolari , che sono ciechi depressioni capocchia di spillo nella parte superiore del padiglione auricolare dell'orecchio. Essi si osservano in 75-85% dei pazienti. Altre malformazioni dell'orecchio esterno (40-60%) possono includere tag preauricolari, lop o pipistrello orecchie e microtia. I canali uditivi esterni possono essere atresici.
Anomalie dell'orecchio medio comprendono anomalie del ossicini, il nervo facciale, ei canali di Falloppio. La tomografia computerizzata delle ossa temporali può dimostrare coclea ipoplasico e canali semicircolari assenti o ipoplasia. È stata inoltre segnalata Mondini displasia. La perdita dell'udito (75-90%) di solito è stabile e può essere conduttiva, neurosensoriale o mista. Si stima che il 2% dei bambini con sordità profonda hanno la sindrome BOR.
Descritta per la prima nel 1975, da M. Melnick, e nel 1978 da FC Fraser. La sindrome di BOR (nota anche come sindrome di Melnick-Fraser) è l'associazione di malformazioni auricolari, fistole branchiali(63%) della sindrome BOR sono solitamente bilaterale e nella parte inferiore del collo con aperture esterne sul bordo mediale del muscolo sternocleidomastoideo, sordità e anomalie renali. La prevalenza è stimata in 1 caso ogni 40.000 popolazione generale.tole branchiali. Altre manifestazioni associate comprendono l'aplasia o stenosi dei dotti lacrimali (8-9%), palato alto arcuato o spacco, morso profondo, e anomalie del nervo facciale. Alcuni autori considerano la microsomia emifacciale (HFM) per essere una forma grave. Vedere emifacciale microsomia, nella sezione Sindrome di Goldenhar. La sindrome branchio-oto-renale (BOR) associa sordità, fistole branchiali multiple e una malformazione renale. La sua prevalenza è stimata a 1/ 40.000(Fraser F.C.). Le malformazioni renali possono essere notevoli (agenesie oppure ipoplasie maggiori) e portano a volte a un'interruzione della gravidanza. Le malformazioni meno importanti saranno diagnosticate con un'ecografia renale che deve essere richiesta di fronte a una sordità suggestiva di BOR: la sordità si accompagna a malformazioni dell'orecchio esterno (malformazioni del padiglione, aplasia dell'orecchio, encondromi, stenosi dei condotti uditivi) (Fig. 4 ), dell'orecchio medio (esiste una componente di trasmissione all'audiogramma) e dell'orecchio interno (varie malformazioni cocleovestibolari) (Fig. 5 ). Si ritrovano in generale delle fistole preauricolari bilaterali e possibilità di apertura di fistole della seconda fessura branchiale con residui cartilaginei associati suggestivi (Fig. 6 ) In presenza di questi segni. un’ecografia renale può confermare questa sindrome.. In pratica, in presenza di una sordità di percezione o mista associata a una fistola branchiale oppure a malformazioni dell'orecchio esterno, è consigliabile eseguire un'ecografia renale. Tre geni sono stati localizzati e due identificati, EYA1 e SIX1(Abdelhak S., Ruf R.G.). Il gene EYA1 può anche essere responsabile di una sindrome branchio-otologica, molto simile alla BOR ma senza interessamento renale(Vincent C.).
· EYA1 (situato sul cromosoma 8 , [8q13.3]), più di 100 tipi di mutazioni responsabili di BOR, le mutazioni sono divisi in tre gruppi principali (isoforma A, B e C) (presente nel 38% -40,5% dei pazienti)
· Six1 (situato sul cromosoma 14 , [14q23.1]), almeno quattro tipi di mutazioni responsabili della BOR (rilevato in 5% dei pazienti),
· SIX5 (situato sul cromosoma 19 , [19q13.32]), almeno quattro tipi di mutazioni responsabili della BOR (rilevato in più dell'1% dei pazienti).
Eziologia e la patogenesi
La sindrome BOR viene ereditata come carattere autosomico dominante con elevata penetranza ed espressione variabile. La patogenesi si presume essere una carenza nella differenziazione del primo e secondo arco branchiale. Le anomalie del sistema renale sono il risultato dell'interazione anomala tra la gemma ureterale e il blastema metanefrico. L'orecchio interno (stria vascularis) ed i glomeruli renali condividono un antigene comune, e più di un gruppo di studio ha descritto i cambiamenti istopatologici su esami dell'osso temporale.
|
|
|
|
Fig. 4 : Orecchie a trombetta ed encondromi. |
Un bambino di 13-mesi con sintomi di BOR. L'orecchio sinistro appositamente sviluppato; all'interno l'orecchio destro, il canale uditivo e atresia lobo impropriamente sviluppati. |
|
|
|
|
Fig. 5 : Micrococlea in una sindrome branchio-oto-renale (BOR). |
|
|
|
|
|
Fig. 6 : Residuo branchiale cervicale |
Ragazza con la sindrome di BOR, fistola carotidea bilaterale |
Una storia familiare positiva per brachiale, otologica, e le malformazioni renali è suggestivo di sindrome di BOR.
Se nessuna storia familiare di malattia è noto, criteri clinici possono essere utilizzate per fare la diagnosi per pazienti con almeno tre criteri principali. In alternativa, la diagnosi può essere fatta per i pazienti che dimostrano due criteri principali e due criteri minori.
Criteri principali
1. Malformazione dei padiglioni auricolari
2. Perdita dell'udito
3. Encondromi preauricolari
4. Anomalie renali
5. Anomalie secondarie dell’arco branchiale
6. Stenosi del canale uditivo esterno
Criteri minori
1. Appendici preauricolari
2. Aplasia del dotto lacrimale
3. Anomalie dell'orecchio medio
4. Anomalie dell'orecchio interno
5. Malformazioni del palato o asimmetria facciale
6. Gozzo eutiroideo
Giudizio fenotipiche
Otologico
Le manifestazioni otologiche della BOR sono i sintomi più comuni, con oltre il 90% delle persone in almeno uno dei seguenti:
1. La sordità può presentarsi come trasmissiva, neurosensoriale o mista. La gravità della sordità è variabile, che vanno dalla perdita dell'udito da lieve a profonda. Inoltre, l'entità della perdita dell'udito può essere stabile o progressiva. La perdita dell'udito è ormai consolidata come il tratto singolo più comune tra quelli con la sindrome BOR, stimata in 89% degli individui in uno studio di Fraser et al. Tra quelli con perdita dell'udito, il 50% presentava ipoacusia mista, 30% trasmissiva de il 20% neurosensoriale. E 'stato inoltre stimato che il 2% dei bambini con sordità profonda hanno BOR.
2. Deformità del padiglione .
3. Bozzi preauricolari.
4. Appendici preauricolari.
5 Stenosi del condotto uditivo esterno:
6. Malformazioni degli ossicini dell'orecchio medio, quali ipoplasia o spostamento
7 Orecchio interno: coclea ipoplasica, canali semicircolari laterali displasici, l'allargamento degli acquedotti vestibolari o cocleari.
Anomalie Arco Branchiale
1. Cisti branchiali leporine.
2. Brancial tratto del seno leporino.
3. Branchiale fistole leporino.
Malformazioni renali
1. Uno spettro di malformazioni renali è possibile, da ipoplasia al agenesia.
2.Cisti caliceale.
3. Uretero-pelvica ostruzione del giunto.
4. Reflusso vescico-ureterale
Altri risultati associati
1. Prolasso della valvola mitrale
2. Palatoschisi
3. Aplasia del dotto lacrimale
4. Paralisi del nervo facciale
5. Retrognazia
Studi Gene
Attualmente, vi sono tre mutazioni genetiche conosciuti che provocano sindrome BOR. Se viene effettuata una diagnosi clinica di sindrome di BOR, la conferma dovrebbe essere tentato attraverso l'analisi di sequenza per EYA1. Se una mutazione EYA1 non viene trovato con l'analisi di sequenza, si dovrebbe utilizzare l'analisi duplicazione / cancellazione per EYA1 e analisi di sequenza di SIX 1 e SIX 5.
Mutazione EYA1
· Circa il 40% delle persone con sindrome di BOR avrà una mutazione EYA1.
· EYA1 codifica per un cofattore trascrizione che si esprime nel mesenchima metanefrico durante lo sviluppo dei reni.
SIX1 mutazione
· La mutazione SIX1 è stimata essere trovato 2% dei casi di sindrome BOR.
· Codifica fattori di trascrizione che controllano l'espressione di GDNF e PAX2.
· La maggior parte dei pazienti con questa mutazione non dimostrano malformazione renale.
SIX5 mutazione
· La mutazione SIX5 è presente in circa il 2,5% dei casi di sindrome di BOR.
· Udienza può essere normale in questi pazienti.
Gestione
Valutazione Otologic
· Le prove devono comprendere ABR, audiometria tonale, e la prova di emissione.
· Imaging delle ossa temporali con una TAC è giustificata.
· Una valutazione annuale uditivo dovrebbe essere suggerito.
Valutazione dell’Arco Branchiale
· L'esame fisico seguita dalla tomografia computerizzata (TC), fistologramma, o risonanza magnetica (MRI) se le masse sono palpate .
Valutazione renale
· Ecografia renale
· BUN e creatinina
· I pazienti devono seguire un follow-up annualmente con la nefrologia e urologia.
La consulenza genetica
· È importante che i pazienti affetti da BOR tengano conto conto che c'è una probabilità del 50% di trasmissione per ogni bambino a causa autosomica dominante.
· Test prenatale per BOR è disponibile per quelli con una storia familiare positiva.
Trattamento
Anomalie otologici
· Rilevare eventuale ipoacusia, utilizzare il trattamento acustico appropriato come indicato dalla gravità della perdita, come la protesi o l'impianto cocleare dell'udito.
· Se l'orecchio medio è intatto, con stenosi del canale uditivo esterno, si può prendere in considerazione una canaloplastica.
· Considerate le procedure di chirurgia plastica per la deformità della Pinna.
Anomalie branchiali
· Asportazione di cisti, fistole, o del seno, con dissezione per tutta la lunghezza del tratto e la tonsillectomia.
Anomalie renali
· Il trattamento dipende dalla gravità delle complicanze renali, ma sia la gestione chirurgica e medica dovrebbe essere utilizzato.
· Il trapianto renale può essere considerato se la malattia renale allo stadio terminale si sviluppa.
Manifestazioni generali
La displasia renale è riportato in oltre due terzi dei pazienti e varia da pali rastremati superiori (duplicazione del sistema di raccolta) alla marcata agenesia del rene. La sindrome può includere sequenza Potter.
Dove posso trovare ulteriori informazioni sulla sindrome branchiootorenale?
Si possono trovare le seguenti risorse sulla sindrome branchiootorenal utili. Questi materiali sono scritti per il pubblico in generale.
• MedlinePlus - Informazioni sanitarie (4 collegamenti)
• Malattie Genetiche e Rare Information Center - Informazioni sulle malattie genetiche e le malattie rare
• Ulteriori NIH Risorse - National Institutes of Health
National Institute on Deafness e altri disturbi della comunicazione (NIDCD)
• Risorse educative - Pagine di informazioni (5 collegamenti)
• Supporto paziente - Per i pazienti e le famiglie (3 collegamenti)
Potreste essere interessati a queste risorse, che sono progettati per gli operatori sanitari e ricercatori.
• Gene Recensioni - Sintesi clinica
• Test genetici Registry - archivio di informazioni test genetico (2 collegamenti)
• PubMed - La letteratura recente
• OMIM - Catalogo Malattia genetica (2 collegamenti)
Quali altri nomi la gente usa per la sindrome branchiootorenale?
• BOR
• Sindrome BOR
• Displasia Branchiootorenale
• Branchio-Otorenale Displasia
• Branchio-Otorenale Syndrome
• Sindrome Branchio-Oto-Renale
• Sindrome di Melnick-Fraser
Per ulteriori informazioni sulla denominazione condizioni genetiche, vedere la Genetics Home Reference Condizione Linee guida di denominazione e di come sono condizioni genetiche e geni denominati? nel manuale.
Cosa succede se ho ancora domande specifiche sulla sindrome branchiootorenal?
Chiedi alla Genetica e Malattie Rare Information Center .
References/Suggested Reading
Abdelhak S, Kalatzis V, Heilig R, Compain S, Samson D, Vincent C, Weil D, Cruaud C, Sahly I, Leibovici M,
Amer I, Falzon A, Choudhury N, Ghufoor K. Branchiootic syndrome-a clinic case report and review of the literature. J Pediatr Surg . 2012;47:1604-1606.
Bitner-Glindzicz M, Francis M, Lacombe D, Vigneron J, Charachon R, Boven K, Bedbeder P, Van Regemorter N, Weissenbach J, Petit C. A human homologue of the Drosophila eyes absent gene underlies branchio-oto-renal (BOR) syndrome and identifies a novel gene family. Nat Genet1997;15:157–64.[CrossRef][Medline][Web of Science]
Blanck C, Kohlhase J, Engels S, Burfeind P, Engel W, Bottani A, Patel MS, Kroes HY, Cobben JM. Three novel SALL1 mutations extend the mutational spectrum in Townes-Brocks syndrome: clinical and genetic implications. Am J Hum Genet2000;66:1715–20.[CrossRef][Medline][Web of Science]
Borsani G, DeGrandi A, Ballabio A, Bulfone A, Bernard L, Banfi S, Gattuso C, Mariani M, Dixon M, Donnai D, Metcalfe K, Winter R, Robertson M, Axton R, Brown A, Van Heyningen V, Hanson I. EYA4, a novel vertebrate gene related to Drosophila eyes absent. Hum Mol Genet1999;8:11–23.[Abstract/FREE Full text]
Buck A, Kispert A, Kohlhase J. Embryonic expression of the murine homologue of SALL1, the gene mutated in Townes-Brocks syndrome. Mech Dev2001;104:143–6.[CrossRef][Medline][Web of Science]
Chen A, Francis M, Ni L, Cremers C, Kimberling W, Sato Y, Phelps P, Bellman S, Wagner M, Pembrey M, Smith RJ. Phenotypic manifestations of branchiootorenal syndrome. Am J Med Genet . 1995;58:365-370.
Chang EH, Menezes M, Meyer NC, Cucci
RA, Vervoot VS, Schwartz CE, Smith RJ. Branchio-oto-renal syndrome: the
mutation spectrum in EYA1 and its phenotypic consequences. Hum Mutat .
2004;23:582-9. PubMed
citation ![]()
Correa-Cerro LS, Kennerknecht I, Just W, Vogel W, Müller D. The gene for branchio-oculo-facial syndrome does not colocalize to the EYA1-4 genes. J Med Genet2000;37:620–3.[FREE Full text]
Engels S, Kohlhase J, McGaughran J. A SALL1 mutation causes a branchio-oto-renal syndrome-like phenotype. J Med Genet2000;37:458–60.[FREE Full text]
Fraser FC, Sproule JR, Halal F. Frequency of the branchio-oto-renal (BOR) syndrome in children with profound hearing loss. Am J Med Genet . 1980;7:341-349.
Fujimoto A, Lipson M, Lacro RV, Shinno NW, Boelter WD, Jones KL, Wilson MG. New autosomal dominant branchio-oculo-facial syndrome. Am J Med Genet1987;27:943–51.[CrossRef][Medline][Web of Science]
Gene Review: Branchiootorenal Spectrum
Disorders This link leads to a site outside Genetics Home Reference. Kochhar
A, Fischer SM, Kimberling WJ, et al. Branchio-oto-renal syndrome. Am
J Med Genet. 2007;15(143A(14)):1671-8, Review. PubMed
citation ![]()
Kumar S, Kimberling WJ, Weston MD, Schaefer BG, Berg MA, Marres HA, Cremers CW. Identification of three novel mutations in human EYA1 protein associated with branchio-oto-renal syndrome. Hum Mutat1998;11:443–9.[CrossRef][Medline][Web of Science]
Kumar S, Deffenbacher K, Marres HAM, Cremers CWRJ, Kimberling WJ. Genomewide search and genetic localization of a second gene associated with autosomal dominant branchio-oto-renal J Hum Genet2000;67(suppl 2):401.
Legius E, Fryns JP, Van den Berghe H. Dominant branchial cleft syndrome with characteristics of both branchio-oto-renal and branchio-oculo-facial syndrome. Clin Genet1990;37:347–50.[Medline]
Kumar S, Marres HAM, Cremers CWRJ, Kimberling WJ. Mutation analysis of EYA1 gene associated with
branchio-oto-renal syndrome and refining the BOR2 region on chromosome 1q. Am syndrome. J Med Genet2000;37:303–7.[FREE Full text]
Lin AE, Doherty R, Lea D. Branchio-oculo-facial and branchio-oto-renal syndromes are distinct entities. Clin Genet1992;41:221–3.[Medline]
Lin AE, Gorlin RJ, Lurie IW, Brunner HG, Van der Burgt I, Naumchik IV, Rumyantseva NV, Stengel Rutkowski S, Rosenbaum K, Meinecke P, Müller D. Further delineation of the branchio-oculo-facial syndrome. Am J Med Genet1995;56:42–59.[CrossRef][Medline][Web of Science]
Lin AE, Semina EV, Daack-Hirsch S, Roeder ER, Curry CJ, Rosenbaum K, Weaver DD, Murray JC. Exclusion of the branchio-oto-renal syndrome locus (EYA1) from patients with branchio-oculo-facial syndrome. Am J Med Genet2000;91:387–90.[CrossRef][Medline]
McKusick VA. Mendelian inheritance in man. Catalogs of human genes and genetic disorders. 12th ed. Baltimore: Johns Hopkins University Press, 1998.
Mishima N, Tomarev S. Chicken eyes absent 2 gene: isolation and expression pattern during development. Int J Dev Biol1998;42:1109–15.[Medline][Web of Science]
Ruf RG, Xu PX, Silvius D, Otto EA,
Beekmann F, Muerb UT, Kumar S, Neuhaus TJ, Kemper MJ, Raymond RM Jr, Brophy
PD, Berkman J, Gattas M, Hyland V, Ruf EM, Schwartz C, Chang EH, Smith RJ,
Stratakis CA, Weil D, Petit C, Hildebrandt F. SIX1 mutations cause
branchio-oto-renal syndrome by disruption of EYA1-SIX1-DNA complexes. Proc Natl Acad Sci US A. 2004 May
25;101(21):8090-5. Epub 2004 May 12. PubMed citation ![]()
Sahly I, Andermann P, Petit C. The zebrafish eya1 gene and its expression pattern during embryogenesis. Dev Genes Evol1999;209:399–410.[CrossRef][Medline][Web of Science]
Sambrook J, Fritsch EF, Maniatis
T. Molecular cloning. A laboratory manual. 2nd ed. Cold Spring
Harbor, NY: Cold Spring Harbor Laboratory Press, 1989. Sanggaard KM, Rendtorff ND, Kjaer KW,
Eiberg H, Johnsen T, Gimsing S, Dyrmose J, Nielsen KO, Lage K, Tranebjaerg L.
Branchio-oto-renal syndrome: detection of EYA1 and SIX1 mutations in five out
of six Danish families by combining linkage, MLPA and sequencing analyses. Eur J Hum Genet.2007 Nov;15(11):1121-31. Epub 2007 Jul 18. PubMed citation ![]()
Sobel E, Lange K. Descent graphs in pedigree analysis: applications to haplotyping, location scores, and marker-sharing statistics. Am J Hum Genet1996;58:1323–37.[Medline][Web of Science]
Vincent C, Kalatzis V, Abdelhak S, Chaib H, Compain S, Helias J, Vaneecloo FM, Petit C. BOR and BO syndromes are allelic defects of EYA1. Eur J Hum Genet1997;5:242–6.[Medline][Web of Science]
Xu PX, Cheng J, Epstein JA, Maas RL. Mouse Eya genes are expressed during limb tendon development and encode a transcriptional activation function. Proc Natl Acad Sci USA1997;94:11974–79.[Abstract/FREE Full text]
Wang Y, Treat K, Schroer RJ O'Brien JE, Stevenson RE, Schwartz CE (giugno 1994). "Localizzazione di (BOR) sindrome Branchio-oto-renale a una regione del cromosoma 3 Mb 8q". Am. J. Med.. Genet. 51 (2):. 169-75
Klein, sindrome di Waardenburg II e sindrome di Vogt) è una rara malattia genetica più spesso caratterizzato da diversi gradi di sordità , difetti minori nelle strutture derivanti dalla cresta neurale , e anomalie della pigmentazione. Disagi Nella miogenesi , in particolare mutazioni in Pax3, possono causare la sindrome di Waardenburg I e III.E 'stata descritta per la prima nel 1951.

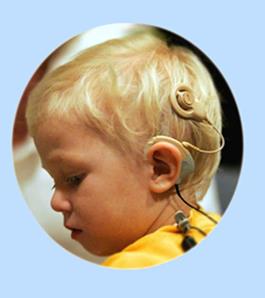 Che cosa
è la sindrome di Waardenburg?
Che cosa
è la sindrome di Waardenburg?
Le cause della sindrome di Waardenburg,
Fisiopatologia,
Epidemiologia,
Diagnosi e valutazione audiologica,
Che cosa è la sindrome di Waardenburg?
Waardenburg sindrome è una malattia rara caratterizzata da sordità in associazione con anomalie della pigmentazione e difetti dei tessuti cresta di derivazione neurale.
Sindrome è una parola che descrive un gruppo di caratteristiche fisiche che si verificano insieme. Le persone che hanno WS di solito hanno un aspetto unico. Questa unicità è causato da cambiamenti nel loro corredo genetico.
Sindrome di Waardenburg è una condizione genetica che causa una persona di essere nato con le caratteristiche facciali inusuali e perdita dell'udito. Questi problemi fisici possono comparire nel corso della vita della persona. Non tutti con WS avrà tutte le caratteristiche della sindrome, e non tutti avranno una perdita uditiva, ma vi è una maggiore probabilità che lo faranno.
Hammerschlag, nel 1907, e Urbantschitsch, nel 1910, entrambi citano eterocromia dell’iride, albinismo parziale con complicanze di sordomutismo Nel 1916, van der Hoeve descrive una distopia angoli palpebrali mediale lateroversa in una coppia di gemelle monozigoti con Sordomutismo La Sindrome di Waardenburg è stato identificato nel 1951 da Petrus Johannes Waardenburg(1886-1979), un oculista olandese che ha notato che molti dei suoi pazienti avevano caratteristiche facciali uniche, occhi di colore diverso avevano pure, spesso, la perdita dell'udito. In effetti, una caratteristica primaria di Waardenburg è perdita di udito - insieme con gli occhi blu/ marroni o due brillanti occhi azzurri. Un'altra caratteristica facilmente riconoscibile è capelli bianchi sulla testa. Da allora, sono stati descritti quattro tipi specifici di WS. La condizione ha descritto è ora classificato come WS1.
ha definito la sindrome con le seguenti 6 principali caratteristiche
· Spostamento laterale della angoli palpebrali mediali combinata con distopia del punto lacrimale e blefarofimosi
· Aspetto di Eyes Wide-set a causa di una prominente, larga radice del naso(distopia dei canti ),associata in particolare con il tipo I),nota anche come telecanto ;
· Ipertricosi della parte mediale delle sopracciglia che toccano nel mezzo
· Un ciuffo di capelli bianchi ( poliosi ), o ingrigimento precoce dei capelli;
· Occhi molto chiari o azzurri brillanti, occhi di due colori diversi (eterocromia completa ), o gli occhi con un’iride con due colori diversi (eterocromia settoriale);
· Sordità da moderata a profonda (frequenza più alta associata al tipo II);
L’oculista svizzero David Klein, nel 1947, ha anche fatto contributi per la comprensione della sindrome,Klein ha riportato il caso di una ragazza di 10 anni con deafmutism, albinismo parziale della pelle e dei capelli, iridis ipocromia, blefarofimosi con ipertelorismo e l'assenza dell'angolo nasofrontal, ipertricosi delle sopracciglia, e molteplici anomalie associate (mio -osteo-Articulare displasia).
WS2 è stato identificato nel 1971, per descrivere i casi di " distopia dei canti "non era presente. [4] WS2 è ora diviso in sottotipi, basato sul gene responsabile.
Sono stati identificati altri tipi, ma sono meno comuni.
Mutazioni nel EDN3, EDNRB, MITF, PAX3, SNAI2, e SOX10 sono i geni che sono affetti dalla sindrome di Waardenburg. Alcuni di questi geni sono coinvolti nella realizzazione dei melanociti, che rende il pigmento melanina. La melanina è un pigmento importante nello sviluppo di capelli, il colore degli occhi, della pelle, e le funzioni dell'orecchio interno. Così la mutazione di questi geni può portare a pigmentazione anomala e la perdita dell'udito. [5] PAX3 e MTIF mutazione del gene avviene in tipo I e II (WS1 e WS2). Tipo III (WS3) mostra mutazioni del gene PAX3 anche. Mutazioni del gene SOX10, EDN3, o EDNRB si verificano in tipo IV.Tipo IV (WS4) può anche interessare porzioni di sviluppo delle cellule nervose che potenzialmente possono portare a problemi intestinali.
Le cause della sindrome di Waardenburg
Questa condizione è solitamente ereditata come autosomica dominante modello, il che significa una copia del gene alterato è sufficiente a causare il disturbo. Nella maggior parte dei casi, una persona affetta ha un genitore con la condizione. Una piccola percentuale di casi derivano da nuove mutazioni nel gene; questi casi si verificano in persone senza storia di malattia nella loro famiglia.
Alcuni casi di tipo II e sindrome tipo IV Waardenburg sembrano avere un autosomica recessiva modello di ereditarietà, il che significa due copie del gene devono essere modificati per una persona di essere colpiti dalla malattia. Molto spesso, i genitori di un bambino con una malattia autosomica recessiva non sono interessati, ma sono portatori di una sola copia del gene alterato.
Waardenburg sindrome è solitamente ereditata come modello autosomico dominante .
Tipi II e sindrome IV Waardenburg possono talvolta avere un modello di ereditarietà autosomico recessivo .
I geni sono responsabili per dirigere la crescita e lo sviluppo degli esseri umani. Quando i geni sono mutati, o diverso dal normale, possono causare cambiamenti nella normale crescita e sviluppo. In WS, i geni mutati sono responsabili di distribuzione del pigmento nel corpo di sviluppo embrionale e fetale. Questi geni possono causare pigmento da distribuire in modo anomalo. Quando questo accade, alcune zone del corpo possono avere troppo o troppo poco pigmento, o nessun pigmento affatto. Alterazioni della pigmentazione possono produrre occhio inusuale, la pelle, o il colore dei capelli così come la sordità. Gli scienziati non hanno ancora capito esattamente che cosa causa le mutazioni genetiche che producono WS, anche se sono stati identificati i geni stessi.
Fisiopatologia
La sindrome Waardenburg è una malattia rara con una modalità autosomica dominante. Diverse ipotesi sono state avanzate per spiegare tutte le caratteristiche cliniche della sindrome.
· La teoria della cresta neurale carente, suggerisce una anomalia dello sviluppo della cresta neurale come causa di malattia: L'associazione della sindrome di Waardenburg e megacolon congenito aganglionico supporta questa ipotesi.
· La sindrome di Waardenburg come una parte della sindrome del primo arco
· Un rapporto della sindrome di Waardenburg con lo status dysraphicus
· La teoria della necrosi intrauterina
Nessuna di queste possibilità spiega tutte le caratteristiche della sindrome di Waardenburg. Cause ereditarie rappresentano circa il 50% degli individui osservati per l'infanzia (prelinguale) perdita di udito, di cui il 70% sono dovuti a mutazioni in numerosi geni singoli che compromettono la funzione uditiva solo (non sindromica). Il resto sono associate ad altre anomalie dello sviluppo chiamati sordità sindromica.
I Geni responsabili di forme sindromiche di perdita dell'udito nella sindrome di Waardenburg includono PAX3 sulla banda 2q37, osservata nei tipi I e III, e MITFmappato su 3p12-p 14,1 per il tipo II(Tachibana M.,1997; Zhang H et al., 2012; Wildhardt G et al 2013 . La sindrome di Waardenburg è autosomica dominante per la maggior parte delle persone con tipo I, II, e III. La sindrome di Waardenburg di tipo IV è autosomica recessiva con penetranza variabile ed è causa di mutazioni del gene SOX10 o del recettore dell'endotelina-B ( EDNRB ), che sembrano correlare con l'intestinale e / o sintomi neurologici manifesta nei pazienti(Morell R, et al.1998;DeStefano AL, et al.,1998;Bondurand N, et al.,2000; Dundar M, et al.,2001;Chan KK, et al.,2003; Sznajer et al.,2008; Oshimo T, et al.,2012;Jung HJ, et al.,2013;hanno descritto un sito di splice mutazione SOX10 (c.698-2A> C), che ha provocato una sindrome di Waardenburg grave di tipo 4 senza malattia di Hirschsprung . Il bambino presentava vivaci occhi blu, ritardo mentale, sinofria, sordità, canali completi bilaterali semicircolari, e neuropatia periferica.
Epidemiologia
Quanto rara è la sindrome di Waardenburg?
La frequenza della sindrome Waardenburg è stimato a 1 caso ogni 212.000 persone nella popolazione generale dei Paesi Bassi, ma a causa di una bassa penetranza di circa il 20%, la frequenza dell'intero sindrome (con o senza sordità) è probabilmente di circa 1 caso per ogni 42.000 persone. In Kenya, Secondo il National Institutes of Health, un individuo su 10.000 a 20.000 avrà la sindrome di Waardenburg. Inoltre, dal momento che i primi due tipi (tipo I e II) sono più comuni e sono associati con la perdita dell'udito, si può presumere che la maggior parte degli individui con Waardenburg avrà la perdita dell'udito.
La sindrome è stata osservata in 0,9-2,8% delle persone con sordomutismo.
Mortalità / morbilità
I bambini con sindrome di Waardenburg hanno una aspettativa di vita normale. La morbilità è legato alla sordità e difetti dei tessuti cresta di derivazione neurale, tra cui ritardo mentale, convulsioni, disturbi psichiatrici, anomalie scheletriche, e disturbi oculari (cataratta comprese).
Razze
Waardenburg sindrome colpisce persone di tutte le razze di tutto il mondo.
Sesso
La malattia colpisce ugualmente entrambi i sessi. Non sono stati trovati differenze sessuali tra persone con sordomutismo congenito.
Età
Come una malattia ereditaria, la sindrome di Waardenburg può essere riconosciuto immediatamente o subito dopo la nascita. Alcune caratteristiche dermatologiche (ad esempio, poliosi) cambiano con l'età.
Si stima che circa 1 su 4000 individui nascono con WS. WS si verifica in tutte le razze, e si verifica in modo uguale in maschi e femmine. Nella maggior parte dei tipi di WS, c'è una probabilità del 50% che un bambino nato da una madre con un gene normale e un genitore con il gene WS avrà WS. Chiunque può nascere con WS come risultato di una nuova mutazione genetica.
Il trattamento dipende dal fenotipo dell'individuo con Sindrome di Waardenburg. È possibile ottenere un trattamento per uno dei seguenti segni fenotipiche:
1) Sordità da moderata a profonda (frequenza più alta associata al tipo II);
2) La malattia di Hirschsprung (HD)
3) problemi estetici
4) palatoschisi
5) Mano e contratture delle dita
Il trattamento per queste caratteristiche comporta la consulenza genetica e / o rinvio di appropriarsi medici professionisti come un audiologo, logopedista, fisioterapista e chirurgo plastico.
Diagnosis and Audiological Evaluation Diagnosi e valutazione audiologica
Educational Opportunities Opportunità educative
Americans with Disabilities Act (ADA) Americans with Disabilities Act (ADA)
Literature and Multimedia Letteratura e Multimedia
Diagnosi
La perdita dell'udito può essere trattata, l'udito deve essere controllato da un audiologo. Lui o lei determinerà il grado e il tipo di perdita uditiva. Ecco un elenco di alcuni dei test che un audiologo può somministrare. Non tutti hanno bisogno di tutti questi test. Il medico o l'audiologo può raccomandare quelli necessari, in base alla storia familiare ei sintomi della perdita dell'udito.
Valutazione audiologica
1. Otoscopia
 L’Otoscopia è un
esame fisico del vostro orecchio esterno, condotto uditivo, e timpano. Un audiologo userà un otoscopio per cercare
eventuali perforazioni del timpano, arrossamento del timpano, cerume o segni di
infezione.
L’Otoscopia è un
esame fisico del vostro orecchio esterno, condotto uditivo, e timpano. Un audiologo userà un otoscopio per cercare
eventuali perforazioni del timpano, arrossamento del timpano, cerume o segni di
infezione.
2. Timpanometria
 La timpanometria è una misura della rigidità del
timpano e ci dice come gli ossicini dell'orecchio medio funzionano. Questo test consente di rilevare liquido
nell'orecchio medio, rottura o eventuali lussazioni degli ossicini ,che si
trovano nell'orecchio medio, un perforazione nel timpano, e una malattia
dell'orecchio medio chiamato otosclerosi. L'audiologo metterà una sonda morbida nel
canale uditivo e una macchina rilascia una piccola quantità di pressione. Il
movimento strumento misura le risposte del timpano alle variazioni di pressione
e registra il risultato su un grafico.
La timpanometria è una misura della rigidità del
timpano e ci dice come gli ossicini dell'orecchio medio funzionano. Questo test consente di rilevare liquido
nell'orecchio medio, rottura o eventuali lussazioni degli ossicini ,che si
trovano nell'orecchio medio, un perforazione nel timpano, e una malattia
dell'orecchio medio chiamato otosclerosi. L'audiologo metterà una sonda morbida nel
canale uditivo e una macchina rilascia una piccola quantità di pressione. Il
movimento strumento misura le risposte del timpano alle variazioni di pressione
e registra il risultato su un grafico.
3. Audiometria Tonale ai Toni Puri
 Il test ai toni
puri è il tipo più comune di valutazione dell’udito. L'audiologo può utilizzare cuffie o
inserire gli auricolari, che sono come tappi per le orecchie, per la
valutazione della conduzione per via aerea. Durante il test, si sentono toni a
diverse frequenza ed intensità, e l’esaminato deve alzare la mano quando sente
il suono. L'audiologo registra le
soglie per ogni frequenza su un grafico chiamato audiogramma. La soglia è il livello più basso di intensità a cui si
possono sentire i toni puri. Il test ai toni puri comprende anche
il test di conduzione per via ossea. Durante questo tipo di test, si indossa una fascia sulla
testa con vibratore appoggiato sulla mastoide , mentre sono presentati i toni. È possibile ascoltare i suoni che vengono condotti all’orecchio
interno attraverso il cranio. Un audiologo poi confrontare i risultati dei toni
puri condotti per via aerea ,con quelli trasmessi per via ossea e
determinare quale parte dell’orecchio è responsabile di qualsiasi perdita
uditiva.
Il test ai toni
puri è il tipo più comune di valutazione dell’udito. L'audiologo può utilizzare cuffie o
inserire gli auricolari, che sono come tappi per le orecchie, per la
valutazione della conduzione per via aerea. Durante il test, si sentono toni a
diverse frequenza ed intensità, e l’esaminato deve alzare la mano quando sente
il suono. L'audiologo registra le
soglie per ogni frequenza su un grafico chiamato audiogramma. La soglia è il livello più basso di intensità a cui si
possono sentire i toni puri. Il test ai toni puri comprende anche
il test di conduzione per via ossea. Durante questo tipo di test, si indossa una fascia sulla
testa con vibratore appoggiato sulla mastoide , mentre sono presentati i toni. È possibile ascoltare i suoni che vengono condotti all’orecchio
interno attraverso il cranio. Un audiologo poi confrontare i risultati dei toni
puri condotti per via aerea ,con quelli trasmessi per via ossea e
determinare quale parte dell’orecchio è responsabile di qualsiasi perdita
uditiva.
4. Emissioni Otoacoustiche (OAE)
La coclea è la parte dell'orecchio che riceve informazioni dai suoni in entrata e invia i suoni al cervello. La coclea contiene molte terminazioni nervose chiamate "cellule ciliate". Quando questi terminazioni nervose lavorano correttamente, i suoni vengono inviati al cervello in maniera accurata ed il cervello interpreta questi suoni come la musica, la parola, o il rumore. Le coclee normali hanno le cellule ciliate esterne che producono rumore. Il test’s OAE registra i suoni che l'orecchio produce e aiuta l'audiologo a determinare se il vostro orecchio interno trasmette il suono al cervello.
5. Auditory Brainstem Response (ABR)
Il test ABR è uno strumento diagnostico non invasivo che misura le onde cerebrali in risposta ad uno stimolo uditivo. Esso misura l'attività della via uditiva che si trova nel vostro tronco encefaloo Per ulteriori informazioni sui test ABR, andare a questi siti.:
www.med.umich.edu www.med.umich.edu
www.hearingcenter.com www.hearingcenter.com
Le prove di cui sopra sono solo alcuni dei possibili modi in cui gli audiologi determinano se l'udito è normale. Per saperne di più sulla diagnosi della perdita dell'udito, visitare i seguenti siti web:
American Speech and Hearing Association American Speech and Hearing Association
Children's Hopsital Boston Bambini Hopsital Boston
Le opzioni per il trattamento WS variano a seconda delle particolari caratteristiche WS. Parte di udito trattamento di perdita è l'intervento di un consulente genetico. Il trattamento può includere uno o una combinazione delle seguenti opzioni. Ricordate che il trattamento (s) scelto da una persona con WS, non può essere adatto per voi o il vostro bambino.
Genetic Testing & Counseling 1. Genetic Testing & Counseling
2. Opzioni per il trattamento di perdita di udito includono:
· Apparecchi acustici o Amplification
· Impianti cocleari
· Sign Language
· Logoterapia
Voi o il vostro bambino può scegliere tra una varietà di scuole per sentire gli individui con problemi. Considerate le esigenze specifiche del vostro bambino e il grado di perdita di udito quando si sceglie una scuola. Molte scuole specializzate in formazione per le persone con problemi di udito. Alcune scuole si affidano completamente sulla lingua dei segni americana, alcuni includono una combinazione del linguaggio parlato e segni orale, e altri usano il discorso solo orale. Oltre alle scuole di specializzazione, si può scegliere di inviare il vostro bambino a una scuola pubblica all'interno della vostra comunità. Individuals with Disabilities Education Act (IDEA) 'Gli Stati Uniti individui con disabilità Education Act (IDEA) afferma che "ogni bambino ha diritto a una istruzione gratuita e adeguata nel contesto meno restrittivo." In altre parole, il bambino deve essere dotato delle risorse adeguate in una scuola vicino te.
Caratteristiche fisiche
Caratteristiche fisiche dei WS sono classificati come maggiore o minore. Per essere diagnosticati con WS una persona deve dimostrare due caratteristiche principali, o una maggiore e due minori caratteristiche della sindrome. Non tutti coloro che hanno WS avrà tutte queste caratteristiche, e non tutte le caratteristiche della sindrome sarà presente alla nascita. Alcune caratteristiche si sviluppano più tardi nella vita, e alcuni diventano più pronunciati con l'età.
Le principali caratteristiche sono elencate di seguito. Le descrizioni di ciascuna si trovano qui .
• Eterocromia Iridis
• luminosi occhi azzurri
• Distopia dei canti (spostamento laterale angoli interni palpebrali )
• Broad, radice del naso prominente
• Piccolo mid-face
• capelli prematuramente grigi
• sordità neurosensoriale congenita
• WS Tipo 4 & Malattia di Hirschsprung
Eterocromia Iridis
|
|
|
Occhi molto chiari o brillanti azzurri, occhi di due colori diversi (eterocromia completa), o gli occhi con un’ iride con due colori diversi (eterocromia settoriale);"Eterocromia Iridis" significa che qualcuno, o un animale, ha gli occhi di due colori diversi, come fa il gatto nella foto a destra. Può anche significare due colori nella stessa dell'occhio, come nella foto a sinistra. Questa persona è nata con gli occhi azzurri, e sviluppato macchie di marrone durante l'adolescenza.
Eterocromia rende occhi sguardo insolito, ma non influenza la visione della persona. WS solito non causare problemi di visione.
È interessante notare che gli animali, tra cui cavalli, cani, topi e gatti possono avere WS. Animali sordi fanno i buoni animali domestici, ma sono spesso distrutti nella convinzione che essi non possono essere addestrati. Animali sordi possono fare buoni animali domestici, se sono tenuti in un ambiente protetto.
|
|
|
Le persone con WS hanno spesso occhi blu brillanti belli, in combinazione con una o più delle altre caratteristiche di WS. Occhi azzurri e prematuramente capelli grigi si verificano spesso in combinazione, come fanno nella foto a sinistra. Qualsiasi persona con gli occhi azzurri può avvertire fotofobia, difficoltà di vedere alla luce del sole, perché le persone con gli occhi azzurri non hanno lo strato sovrastante di pigmento scuro che le persone con marrone, nocciola, o gli occhi verdi fanno. This additional pigment protects the eyes from strong light. Questo pigmento aggiuntivo protegge gli occhi dalla luce forte. Le persone con gli occhi azzurri anche spesso hanno scarsa visione notturna. Gli occhi azzurri da soli non sono diagnostici di WS; tuttavia, gli occhi azzurri in combinazione con i capelli precocemente grigi, aree di pelle depigmentazione, perdita dell'udito suggeriscono WS.
Back to Top Distopia dei canti
|
|
"Distopia dei canti" descrive l'aspetto degli occhi della persona e ponte nasale. Le persone con distopia dei canti hanno ampie, ponti nasali piatte, con pieghe di pelle che copre angoli interni degli occhi. Queste pieghe della pelle danno un aspetto asiatico agli occhi di persone con WS. Persone asiatici come quello nella foto a destra, hanno pieghe cutanee copre gli angoli interni degli occhi chiamato epicanto. Queste pieghe sono una caratteristica del viso normale causata dai ponti nasali pianeggianti tipici di persone asiatiche. Dystopia dei canti, come mostrato nella foto a fianco, non è una condizione normale per persone di ogni razza. I medici utilizzano una formula denominata "W Index" per calcolare la distanza tra gli occhi per stabilire se qualcuno ha distopia dei canti.
Back to Top Broad Nasal Root
Broad nasale Root
 importanti radici
nasali si trovano spesso nelle persone con WS.
La radice nasale è l'area tra gli occhi del ponte della occhiali poggia. Le persone
con importanti radici nasali sembrano avere piani, facce larghe, ei loro occhi
possono apparire da impostare ampiamente a parte. La persona nella foto ha anche le
brillanti occhi azzurri, volumi bruciati sopracciglia, piccolo alae nasale, e
caratteristici nevi di WS.
importanti radici
nasali si trovano spesso nelle persone con WS.
La radice nasale è l'area tra gli occhi del ponte della occhiali poggia. Le persone
con importanti radici nasali sembrano avere piani, facce larghe, ei loro occhi
possono apparire da impostare ampiamente a parte. La persona nella foto ha anche le
brillanti occhi azzurri, volumi bruciati sopracciglia, piccolo alae nasale, e
caratteristici nevi di WS.
Piccola Mid-Face
Le persone con WS possono avere ossa facciali che sono più piccoli del normale. Queste ossa sono le ossa nasali, guancia ossa, e alcune ossa che formano le occhiaie. Quando ossa metà viso sono più piccolo del previsto, il viso della persona può apparire piatta nel profilo. Ossa nasali appiattite possono causare gli occhi della persona a comparire ampiamente impostare e "orientale-looking", anche se la persona non è asiatico.
Quest'uomo ha piccole ossa della faccia media, eterocromia dell’iridis e capelli precocemente grigi - tutte le caratteristiche di WS.
Capelli Grigi Prematuramente
 Capelli
prematuramente grigi, o macchie di capelli grigi nei capelli di colore più
scuro sono anche segni di WS. Molte
persone con WS hanno una striscia bianca di capelli al centro della loro
fronte. Altri possono avere i capelli che si è
interamente grigio quando erano adolescenti. Alcune persone con WS
hanno ciglia e sopracciglia bianche. I capelli
grigi si verifica spesso in combinazione con gli occhi blu e la perdita dell'udito.
Persone i cui capelli sono diventati grigi prematuramente possono
scegliere di tingersi i capelli, quindi questa funzione non è sempre visibile
in qualcuno con WS. L'uomo nella
foto (in alto a destra) ha i capelli che sono diventati grigi quando era
adolescente.
Capelli
prematuramente grigi, o macchie di capelli grigi nei capelli di colore più
scuro sono anche segni di WS. Molte
persone con WS hanno una striscia bianca di capelli al centro della loro
fronte. Altri possono avere i capelli che si è
interamente grigio quando erano adolescenti. Alcune persone con WS
hanno ciglia e sopracciglia bianche. I capelli
grigi si verifica spesso in combinazione con gli occhi blu e la perdita dell'udito.
Persone i cui capelli sono diventati grigi prematuramente possono
scegliere di tingersi i capelli, quindi questa funzione non è sempre visibile
in qualcuno con WS. L'uomo nella
foto (in alto a destra) ha i capelli che sono diventati grigi quando era
adolescente.
Sordità neurosensoriale
 hearing
loss Ipoacusia neurosensoriale può
essere presente alla nascita (congenita), o può apparire più tardi nella vita.
Nei casi più gravi soggetti con WS sono nati sordi.
Alcuni individui hanno la perdita dell'udito in un solo orecchio, e alcuni
individui hanno perdite uditive molto lievi, che non interferiscono con la
parola o lo sviluppo del linguaggio. Poiché la
perdita dell'udito non è una caratteristica visibile, le persone che hanno
alcune delle altre caratteristiche di WS devono sempre ricevere una valutazione
dell'udito. Un ragazzo con un impianto cocleare è raffigurato qui
sotto.
hearing
loss Ipoacusia neurosensoriale può
essere presente alla nascita (congenita), o può apparire più tardi nella vita.
Nei casi più gravi soggetti con WS sono nati sordi.
Alcuni individui hanno la perdita dell'udito in un solo orecchio, e alcuni
individui hanno perdite uditive molto lievi, che non interferiscono con la
parola o lo sviluppo del linguaggio. Poiché la
perdita dell'udito non è una caratteristica visibile, le persone che hanno
alcune delle altre caratteristiche di WS devono sempre ricevere una valutazione
dell'udito. Un ragazzo con un impianto cocleare è raffigurato qui
sotto.
Caratteristiche di minore importanza sono i seguenti, con le descrizioni disponibili qui :
•
leucoderma congenita
• Diverse nevi (moli)
• anomalie sopracciglio
• ipoplasico nasale alae
• Sindattilia
• mento sfuggente
• labio-palatoschisi
• Spina bifida
• Disturbi della comunicazione
• Camptodattilia
• caratteristiche rare
Sindrome di Usher La sindrome Graefe-Usher La sindrome sordità-retinite pigmentosa La sindrome Hallgren
- trasmissione autosomica recessiva
- sordità neurosensoriale congenita (raramente progressiva)
- retinite pigmentosa (RP)
- eterogeneità genetica - Tipi I, Il, III
Che cos'è la sindrome di Usher? Fig. 1
La sindrome di Usher è una condizione genetica che comporta la perdita dell'udito neurosensoriale e retinite pigmentosa (RP). Sebbene sia considerata una malattia rara, è la causa più frequente di sordo-cecità negli esseri umani. Una sindrome è una malattia o un disturbo che ha più di una caratteristica o sintomo. Quando la perdita dell'udito è accompagnata da altri riscontri clinici, è spesso classificato come una sindrome, e ci sono più di 400 tali sindromi descritte da Gorlin, Torell, e Cohen (1995). la sindrome di Usher è una condizione caratterizzata da perdita progressiva dell'udito o sordità e perdita della vista da retinite pigmentosa (RP). La condizione prende il nome da un oculista britannico, CH Usher, che in un articolo nel 1914 descrisse diversi casi in cui si è sottolineato il legame tra sordità congenita e RP. Tuttavia, nel lontano 1860 lavoratori, come von Graef Lo screening uditivo neonatale ha ridotto l'età di identificazione dei bambini con perdita uditiva 12-18 mesi a 6 mesi o meno (Harrison & Rousch, 1996), ma la diagnosi di sindrome di Usher, con la sua devastante perdita della vista, tipicamente ritardi 5-10 anni dietro l'identificazione della perdita dell'udito (Kimberling & Lindenmuth, 2007). Così, mentre i genitori imparano di perdita uditiva del loro bambino relativamente presto, senza diagnosi differenziale si procede con le decisioni critiche relative all'intervento, comunicazione e opzioni educative ignari che il loro bambino finirà per essere cieco. A causa dello screening uditivo neonatale, audiologi sono spesso contatto primario della famiglia. Pertanto, audiologi sono in grado di migliorare i risultati di diagnosi differenziali per i bambini con sindrome di Usher. Questo articolo è rivolto ad accrescere la comprensione audiologi 'della presentazione audiologico e visivo, criteri diagnostici e strategie di intervento coinvolti con la sindrome di Usher.
Storia
La sindrome di Usher è chiamato dopo l'oculista scozzese Charles Usher , che ha esaminato la patologia e la trasmissione di questa malattia nel 1914 sulla base di 69 casi. Tuttavia, è stato descritto nel 1858 da Albrecht von Gräfe , (un pioniere della moderna oftalmologia) e Liebreich a Berlino erano a conoscenza del legame tra sordità congenita e RP, soprattutto nei matrimoni consanguinei.. Egli ha riferito il caso di un paziente sordo con retinite pigmentosa , che aveva due fratelli con gli stessi sintomi. Tre anni più tardi(1861), uno dei suoi studenti, Richard Liebreich , ha esaminato la popolazione di Berlino che avevano sordità con retinite pigmentosa. Liebreich ha notato che la sindrome di Usher era di tipo recessivo, dal momento che i casi di combinazioni cieco sordità si sono verificati in particolare nei fratelli dei matrimoni consanguinei o in famiglie con pazienti in diverse generazioni. Le sue osservazioni hanno fornito le prime prove per la trasmissione accoppiata di cecità e sordità, dal momento che non potrebbe essere trovati casi isolati delle due patologie negli alberi genealogici.
La perdita della vista è causata da una malattia dell'occhio chiamata retinite pigmentosa (RP), che colpisce lo strato di tessuto sensibile alla luce nella parte posteriore dell'occhio (retina). Perdita della vista si verifica in quanto le cellule della retina che rilevano la luce si deteriorano gradualmente. Di solito, i bastoncelli della retina sono i primi ad essere interessati, con conseguente precoce cecità notturna e la graduale perdita di visione periferica. In altri casi, si verifica, la degenerazione precoce dei coni della macula, portando ad una perdita di acuità centrale. In alcuni casi, è risparmiata la visione foveale, portando ad una "visione a ciambella"; visione centrale e periferica sono intatti, ma un anello esiste intorno alla regione centrale in cui visione è compromessa . Inizia prima la perdita della visione notturna, cecità notturna, questo disturbo può anche essere accoppiato alla difficoltà ad adattarsi alla luce intensa od a rapidi cambiamenti delle condizioni di luce, seguita da punti ciechi che si sviluppano nella visione laterale (periferica). Nel corso del tempo, questi punti ciechi si ingrandiscono e si fondono per produrre una visione a tunnel. In alcuni casi di sindrome di Usher, la visione è ulteriormente compromessa dalla opacità del cristallino dell'occhio (cataratta). Molte persone con retinite pigmentosa mantiene una certa visione centrale per tutta la vita, però.
Quanto è diffusa la sindrome di Usher?
Si pensa che la sindrome di Usher possa essere responsabile dal 3 per cento, al 6 per cento di tutta la sordità infantile e circa del 50 per cento dei casi di sordità-cecità negli adulti. Si stima che la sindrome Usher di I tipo colpisce almeno 4 individui ogni 100.000 persone. Negli Stati Uniti, i tipi 1 e 2 sono i tipi più comuni. Insieme, essi rappresentano circa il 90 al 95 per cento di tutti i casi di bambini che hanno la sindrome di Usher. Può essere ancora più comune in alcune popolazioni etniche, come nelle etnie di ascendenza ebraica Ashkenazi (dell'Europa centrale e orientale) e nella popolazione Acadian in Louisiana. Si pensa che la sindrome di Usher di II Tipo sia la forma più comune, anche se la frequenza di questo tipo è sconosciuto. Nella maggior parte delle popolazioni la sindrome di Usher di Tipo III rappresenta solo una piccola percentuale di tutti i casi di sindrome di Usher. Questa forma della malattia ,tuttavia, è più comune nella popolazione finlandese, dove rappresenta circa il 40 per cento di tutti i casi.
I ricercatori hanno individuato tre principali tipi di sindrome di Usher, designati come tipo I, II, e III. Questi tipi si distinguono per la loro gravità e l'età in cui i segni ei sintomi compaiono. Il tipo I è ulteriormente suddivisa in sette distinti sottotipi, indicati come tipi IA/IG. La sindrome di Usher di tipo II ha almeno tre sottotipi descritti, designati come tipi IIA, IIB e IIC.
|
|
|
Fig. 1:Fotografia della retina di un paziente con la sindrome di Usher (a sinistra) rispetto ad una retina normale (a destra). Il nervo ottico (freccia) sembra molto chiaro, i vasi (stelle) sono molto sottili e non vi è pigmento caratteristico, chiamato spicole ossee (doppie frecce).
|
|
|
|
Le malattie genetiche possono essere causate da un cambiamento (s) in un gene. Ogni individuo ha due copie dello stesso gene. Malattie genetiche vengono ereditate in modi diversi. La sindrome di Usher è una malattia recessiva.Fig.2a/b Mezzi Recessiva: · una persona deve ereditare un cambiamento nello stesso gene da ciascun genitore per avere il disturbo · una persona con un gene mutato non ha il disturbo, ma può passare sia il mutato o il gene invariata al suo bambino Un individuo con la sindrome di Usher solito: · ha ereditato un cambiamento nello stesso gene da ciascun genitore Un individuo che ha una cambiata Usher gene sindrome è chiamato un vettore. Quando due portatori dello stesso gene sindrome di Usher hanno un figlio insieme, con ogni nascita c'è un: · 1-in-possibilità su 4 di avere un bambino con la sindrome di Usher · 2-in-possibilità su 4 di avere un bambino che è un vettore · 1-in-possibilità su 4 di avere un bambino che non ha né la sindrome di Usher non è un vettore
|
Che cosa provoca la sindrome di Usher?
Sindrome di Usher è ereditata, il che significa che si passa dai genitori ai figli attraverso i geni. Geni sono localizzati in quasi ogni cellula del corpo. I geni contengono le istruzioni che dicono le cellule cosa fare. Ogni persona eredita due copie di ogni gene, uno da ciascun genitore. A volte i geni sono alterati o mutati. Geni mutati possono indurre le cellule a agire in modo diverso rispetto al previsto.
La sindrome di Usher è ereditata come carattere autosomico recessivo. Il termine autosomica significa che il gene mutato non è situato su uno dei cromosomi che determinano il sesso di una persona; in altre parole, maschi e femmine possono avere la malattia e può passarlo insieme ad un bambino. La parola recessiva significa che, per avere la sindrome di Usher, una persona deve ricevere una forma mutata del gene sindrome di Usher da ciascun genitore. Se un bambino ha una mutazione in un gene (sindrome Usher), ma l'altro gene è normale, si prevede che avrà un udito ed una visione normale '. Le persone con una mutazione in un gene che può causare una malattia autosomica recessiva sono chiamati vettori, perché "portano" il gene con una mutazione, ma non mostrano sintomi del disturbo. Se entrambi i genitori sono portatori di un gene mutato per la sindrome di Usher, avranno una probabilità su quattro di avere un figlio con la sindrome di Usher con ogni nascita.
Di solito, i genitori che hanno un udito normale e la visione non sanno se sono portatori di una mutazione del gene (sindrome di Usher). Attualmente, non è possibile determinare se una persona che non ha una storia familiare di sindrome di Usher è un vettore.
Quali sono le caratteristiche dei tre tipi di sindrome di Usher?
Tipo 1
I bambini con diabete di tipo 1, e sindrome di Usher nascono completamente sordi ( Fig. 3a) o perdono gran parte della loro udito entro il primo anno di vita ed hanno gravi problemi di equilibrio. La perdita progressiva della vista ,causata dalla retinite pigmentosa, si manifesta durante l'infanzia. Questo tipo di sindrome di Usher comprende anche problemi dell'orecchio interno che influenzano l'equilibrio. I genitori dovrebbero consultare il proprio medico e altri professionisti della salute dell'udito il più presto possibile per determinare il miglior metodo di comunicazione per il loro bambino. L'intervento dovrebbe essere introdotto presto, durante i primi anni di vita, in modo che il bambino può approfittare della finestra unica di tempo durante il quale il cervello è più ricettivo per l'apprendimento delle lingue, sia parlato o firmato. Se un bambino viene diagnosticato con il tipo 1, sindrome di Usher presto, prima che lui o lei perde la capacità di vedere, quel bambino ha maggiori probabilità di beneficiare di tutta la gamma di strategie di intervento che possono aiutare lui o lei di partecipare più pienamente nelle attività della vita.
La funzionalità vestibolare è caratterizzata da areflessia nella sindrome di Usher Tipo I ,a causa dei problemi di equilibrio associati alla sindrome di Usher di tipo 1, i bambini con questo disturbo di solito associato a areflessia vestibolare e ritardo nelle tappe dello sviluppo, come nel controllo del capo e nell'acquisizione della stazione seduta e della deambulazione autonoma, sono lenti a sedersi senza supporto e di solito non camminano autonomamente prima dei 18 mesi di età(Moller, Kimberling, Davenport, Priluck, & White, 1989). Questi bambini di solito iniziano a sviluppare problemi di visione nella prima infanzia, quasi sempre dal momento in cui raggiungono 10 anni. Questa forma richiede una diagnosi precoce, entro i 2-3 anni, perché un impianto cocleare può ridurre di molto le difficoltà comunicative dovute al sommarsi di difetto uditivo e visivo
Problemi di visione più spesso iniziano con difficoltà a vedere di notte, Cecità notturna è tipicamente appare a 10 anni, quindi questi bambini possono avere paura del buio e sono spesso descritti come goffi perché urtano, o inciampare. Il deterioramento significativo del campo visivo e l'acutezza inizia tra la seconda e la terza decade di vita, con la cataratta essendo una complicanza comune (Edwards, Fishman, Anderson, Boschetto, e Derlackie, 1998; Piazza, Fishman, Sugata, Derlacki, e Anderson, 1986; A. Sadeghi, Eriksson, Kimberling, Sjostrom, e Moller, 2006) ma tendono a progredire rapidamente fino a quando la persona è completamente cieco.
|
|
|
Fig. 2a. Tipici risultati audiometrici nella sindrome di tipo 1 Usher.
|
Tipo 2
La sindrome di Usher di tipo 2 (circa il 60% dei casi), è caratterizzata da perdita dell'udito dalla nascita Fig.2b ,(la sordità è meno grave, stabile, prevalentemente sulle frequenze acute) e progressiva perdita della vista che inizia in adolescenza o in età adulta e solitamente il quadro è meno grave rispetto al 1 tipo, non associata a alterazioni vestibolari,. La perdita di udito associata a questa forma di sindrome di Usher varia da una forma lieve ad una grave e colpisce soprattutto i toni alti. I bambini affetti hanno problemi di udito, suoni del linguaggio morbido elevate, come quelle delle lettere S e t. Il grado di perdita dell'udito varia all'interno e tra le famiglie con questa condizione. A differenza di altre forme di sindrome di Usher, le persone con diabete di tipo II non hanno problemi di equilibrio causata da problemi dell'orecchio interno.
|
|
|
Figura 2b. Tipici risultati audiometrici di tipo II sindrome di Usher.
|
Tipo 3
I bambini con sindrome di Usher tipo 3 (<3% dei casi, diffusa soprattutto nelle popolazioni Finlandesi e negli Ebrei Ashkenaziti), hanno un udito normale alla nascita, che progredisce durante l'adolescenza ,dopo lo sviluppo del linguaggio, richiedono apparecchi acustici con l'età adulta, la sordità è progressiva, l’ipoacusia è simile a quella descritta per il tipo II ,ma compare attorno ai 3-5 anni e presenta una progressività nel corso degli anni (Kumar et al.. 1984).la perdita dell'udito e perdita della vista sono progressivi a partire dai primi decenni di vita a differenza delle altre forme di sindrome di Usher. Sebbene la maggior parte dei bambini con il disturbo hanno un equilibrio normale o quasi normale, alcuni possono sviluppare problemi di equilibrio in seguito, la disfunzione vestibolare si ha nella metà dei casi, i pazienti presentano un quadro variabile caratterizzato da progressivo peggioramento (Fishman. 1979: Fishman et al.. 1983). Con la mezza età, gli individui più colpiti sono sordi. Anche la perdita della vista causata dalla retinite pigmentosa si sviluppa nella tarda infanzia o nell'adolescenza. Le persone con sindrome di Usher di tipo III possono anche avere difficoltà con l'equilibrio a causa di problemi dell'orecchio interno. Questi problemi variano tra gli individui affetti, Nella s di Usher tipo III i bambini hanno un udito normale alla nascita, mentre i sintomi vestibolari e la retinite pigmentosa insorgono in età variabili
|
Quali geni sono legati alla sindrome di Usher?
Mutazioni nel CDH23, CLRN1, GPR98, MYO7A, PCDH15, USH1C, USH1G, ei geni USH2A causano la sindrome di Usher.
I geni legati alla sindrome di Usher forniscono istruzioni per fare proteine che svolgono ruoli importanti nella udito normale, equilibrio, e la visione. Funzionano nello sviluppo e nel mantenimento delle cellule ciliate, che sono cellule sensoriali dell'orecchio interno che aiutano a trasmettere segnali di movimento del suono e al cervello. Nella retina, questi geni sono coinvolti nel determinare la struttura e la funzione delle cellule sensibili alla luce bastoncelli e coni. In alcuni casi, l'esatto ruolo di questi geni in ascolto e visione è sconosciuta. La maggior parte delle mutazioni responsabili della sindrome Usher portare ad una perdita di cellule ciliate nell'orecchio interno e una graduale perdita di coni e bastoncelli della retina. La degenerazione di queste cellule sensoriali provoca perdita di udito, problemi di equilibrio, e la perdita di visione caratteristica di questa condizione.
Usher sindrome tipo che posso derivare da mutazioni nel CDH23, MYO7A, PCDH15, USH1C, o geneUSH1G. Almeno altri due geni identificati anche causare questa forma di sindrome di Usher.
La sindrome di Usher di tipo II è causata da mutazioni in almeno quattro geni. Solo due di questi geni,USH2A e GPR98 (chiamato anche VLGR1), sono stati identificati.
Le mutazioni in almeno due geni sono responsabili della sindrome di Usher tipo III; tuttavia, CLRN1 è l'unico gene che è stato identificato.
Per saperne di più sul CDH23 , CLRN1 , GPR98 , MYO7A , PCDH15 , USH1C , USH1G , e USH2Ageni.
Nella sindrome di Usher tipo I sono stati identificati 7 sedi di linkage e 4 geni (MYO7A. USH1C. CDH23. PCDH15) a carico dei quali sono state osservate varie mutazioni, con sordità congenita profonda, areflessia vestibolare bilaterale responsabile di un ritardo della deambulazione (deambulazione dopo 18 mesi) e retinite che si sviluppa durante l'infanzia. I primi segni visivi sono dei disturbi della visione in penombra, spesso verso l'inizio del secondo decennio di vita, ma l'esame sistematico del fondo dell'occhio può consentire la diagnosi molto prima di questa età, fin dai 3-4 anni. L'esame più precoce è l'elettroretinogramma, patologico prima dei primi segni nel fondo dell'occhio. La sindrome di Usher di tipo I è un'indicazione all'impianto cocleare precoce per ottenere una comprensione del linguaggio senza lettura labiale in questi bambini che, in età adulta, avranno una rilevante compromissione visiva. Porre la diagnosi attraverso l'esame del fondo dell'occhio a 4 anni è quindi già una situazione tardiva. In linea di principio l'esame oftalmologico esteso al fondo dell'occhio deve essere sistematico e ripetuto nel bambino e nell'adulto sordi, e ogni sordità profonda congenita con ritardo della deambulazione senza eziologia evidente deve fare eseguire un elettroretinogramma, anche se il fondo dell'occhio è normale La funzionalità vestibolare è caratterizzata da areflessia nella sindrome di Usher Tipo I ,da normoreflessia nella sindrome di Usher Tipo II e da risposte che vanno progressivamente peggiorando nella sindrome di Usher Tipo III (Kumar et al. 1984: Möller et al.. 1989)
Nella sindrome di Usher tipo II sono state osservate varie mutazioni a carico dii gene (USH2A); tuttavia è verosimile che vi sia una eterogeneità genetica dal momento che sono state identificate 2 ulteriori sedi di linkage, la sordità è in media grave, non progressiva, predominante sulle frequenze acute, la retinite un poco più tardiva e i segni vestibolari assenti. Nella Usher tipo III è stato recentemente individuato 1 gene (USH3) a carico del quale sono state osservate varie mutazioni (Tab. III). la sordità è progressiva, i segni vestibolari e l'età di inizio della retinite sono variabili (per una rassegna, vedi [Grøndahl J (1987). 8]).
A tutt'oggi sono stati localizzati 12 geni diversi responsabili di queste forme Geni e le proteine che codificano sono stati identificati per 7 dei 12 loci., cinque per la sindrome di Usher tipo I, due per il tipo II e uno per il tipo III (Tabella II/III). MYO7A e CDH23 rappresentano rispettivamente il 30 e 29% dei casi di Usher tipo I e USH2A il 40% dei tipi II(Ouyang X.) La diagnosi molecolare non è eseguita di routine e la diagnosi è essenzialmente clinica.
I geni che causano la sindrome di Usher sono MY07A, USH1C, CDH23, PCDH15,e SANS, che causa USH1, USH2A (che causa USH2 ), e USH3A (che provoca USH3 ). Una mutazione, denominata R245X, del PCDH15 gene può rappresentare una grande percentuale di USH1 casi in Ashkenazi popolazione ebraica di oggi La maggior parte delle s. di Usher sono causate da mutazioni dei geni MYO7A, CDH23, USH2A che codificano per proteine importanti per la costituzione delle cellule cigliate e della matrice extracellulare della coclea.
|
|
|
|
|
|
Tab, II. Genetica della s, di Usher.
|
Locus |
|
Gene |
Marker
|
Most lmportant Reference |
OMIM
|
|
USH1A |
14q32 |
Unknown |
D14S250, D14S260, D14S292, D14S78 |
Kaplan et al., 1992 |
276900 |
|
USH1B |
11q135 |
MYO7A |
Di 1S906, Dl 1S911, D11S52, OMP-CA |
Weil et al,1995 |
276903 |
|
USH1C |
hp15.1 |
USH1C |
D11S902,D11S921, D11S899,D11S861 |
Smith
et al,, 1992 |
276904 |
|
USH1D |
10q |
CDH23 |
D10S529, D10S202, D10S573 |
Wayne
et al,, 1996 |
601067 |
|
USH1E |
21q |
Unknown |
D21S1884,
|
Chaib et al, 1997 |
602097 |
|
USH1F |
10q2122 |
PCDH15 |
D10S199, D10S578, D10S596 |
Ahmed
et aL, 2001 |
602083 |
|
USH1G |
17q24-25 |
Unknown |
|
Mustapha et al.., 2002 |
|
|
USH2A |
1q41 |
USH2A |
D1S229, D1S490, D1S237, D1S474 |
Kimberling
et al, |
276901 |
|
USH2B |
3p2324..2, |
Unknown |
D3S1578, D3S3647, D3S3658 |
Hmani et al,, 1999 |
276905 |
|
USH2C |
5q14.3-q21.3 |
Unknown
|
D5S428, D5S421 |
Pieke-Dahl et al., 2000 |
605472 |
|
USH 3 |
3q21-q25 |
USH3 |
D3S1299, D3S1555, D3S1280, D3S1 279 |
Sankila et al, 1995 Joensuu et al., 2001 |
276902
|
Geni associati con la sindrome di Usher Tab, III.
|
Tabella 1: geni collegati alla sindrome di Usher |
||||||||
|
Tipo |
Freq [ 16 ] |
Gene locus |
Gene |
Proteina |
Funzione |
Dimensioni (AA) |
UniProt |
|
|
USH1B |
39-55% |
11q 13.5 |
Myosin VIIA |
2215 |
||||
|
USH1C |
6-7% |
11p 15.1-p14 |
552 |
|||||
|
USH1D |
19-35% |
10q 21-q22 |
3354 |
|||||
|
USH1E |
raro |
21q 21 |
? |
? |
? |
? |
? |
|
|
USH1F |
11-19% |
10q 11.2-Q21 |
1955 |
|||||
|
USH1G |
7% |
17q 24-q25 |
SANS |
461 |
||||
|
USH2A |
80% |
1q 41 |
Usherin |
Transmembrane linkage |
5202 |
|||
|
USH2C |
15% |
5q 14.3-q21.1 |
VLGR1b |
Molto grande GPCR |
6307 |
|||
|
USH2D |
5% |
9q 32-q34 |
Whirlin |
907 |
||||
|
USH3A |
100% |
3q 21-q25 |
Clarin-1 |
Shaping Synaptic |
232 |
|||
Come viene diagnosticata la sindrome di Usher?
Poiché la sindrome di Usher colpisce l'udito, equilibrio, e la visione, la diagnosi del disturbo di solito include la valutazione di tutti e tre i sensi. Misure comportamentali e oggettive del sistema uditivo sono tecniche familiari per l'audiologo. Proprio come con le misure acustiche, la valutazione della funzione visiva può essere comportamentale (cioè, l'acuità e campo visivo) o oggettiva. Una videoelectronistagmografia (VNG) che misura i movimenti involontari degli occhi potrebbe evidenziare dei problemi di equilibrio. I tests obiettivi comprende l'esame diretto della retina, dove un oculista troverà vasi sanguigni scoloriti, un pallore cereo, e grumi di cellule retiniche morte chiamati spicole ossee (Carr & Noble, 1981). Tuttavia, questi risultati fisici non sono evidenti fino a ben dopo che il paziente è sintomatico. La prova definitiva di RP è un elettroretinogramma (ERG). Come una risposta uditivi del tronco encefalico, l'ERG è una risposta evocata ma dai coni e bastoncelli della retina. Poiché il test richiede l'inserimento di una lente a contatto matrice / elettrodo, anestesia generale è necessaria per i bambini, mentre farmaci topici possono essere utilizzati con gli adulti. Anche se un bambino può avere una visione ancora relativamente buona, l'ERG sarà ridotto o assente quando sindrome RP / Usher è presente. Vi è qualche evidenza che mentre la perdita di ampiezza del ERG è simile tra Usher tipo I e tipo II, il ritardo implicito si può distinguere tra i tipi (Seeliger, Zrenner, Apfelstedt-Sylla, e Jaissle, 2001). Un ERG presenta un vantaggio diagnostico distinto che sarà anormale molto prima dei segni fisici di morte cellulare (spicole ossee) che compaiono sulla retina. Questo spiega perché un oculista spesso non fa la diagnosi con un giovane paziente, in quanto il bambino si esibirà bene nel test dell'acuità visiva e le sue retine sotto esame diretto appariranno normali.
Valutazione degli occhi può includere un test del campo visivo per misurare la visione di una persona periferica, un elettroretinogramma (ERG) per misurare la risposta elettrica delle cellule fotosensibili dell'occhio, e un esame della retina per osservare la retina e altre strutture nella parte posteriore l'occhio. La diagnosi precoce della sindrome di Usher è molto importante. Prima che i genitori sanno che il loro bambino ha la sindrome di Usher, prima il bambino potrà iniziare programmi di formazione educativa speciali per gestire la perdita di udito e della vista.
Come le persone ereditano la sindrome di Usher? APPROFONDIMENTO
Questa condizione è ereditata come carattere autosomico recessivo, il che significa che entrambe le copie del gene in ogni cellula hanno mutazioni. I genitori di una persona con una malattia autosomica recessiva portano ciascuno una copia del gene mutato, ma in genere non mostrano segni e sintomi della malattia.
Dove posso trovare informazioni circa la diagnosi o la gestione della sindrome di Usher?
Tali risorse riguardano la diagnosi o il trattamento della sindrome di Usher e possono includere fornitori di trattamento.
·
Gene Recensione: Sindrome di Usher di tipo 1 ![]()
·
Gene Recensione: Sindrome di Usher di tipo 1 ![]()
·
Gene Recensione: Sindrome di Usher di tipo 2 ![]()
·
Gene Recensione: Sindrome di Usher di tipo 2 ![]()
·
Genetica Registro Test: Retinite
pigmentosa Sindrome-sordità ![]()
·
Genetica Registro Test: La sindrome di Usher, tipo 1 ![]()
·
Genetica Registro Test: La sindrome di Usher, tipo 1C ![]()
·
Genetica Registro Test: sindrome di Usher, tipo 1D ![]()
·
Genetica Registro Test: La sindrome di Usher, tipo 1E ![]()
·
Genetica Registro Test: La sindrome di Usher, tipo 1F ![]()
·
Genetica Registro Test: La sindrome di Usher, tipo 1G ![]()
·
Genetica Registro Test: La sindrome di Usher, tipo 2A ![]()
·
Genetica Registro Test: La sindrome di Usher, tipo 2C ![]()
·
Genetica Registro Test: La sindrome di Usher, tipo 3 ![]()
·
Genetica Registro Test: Usher sindrome tipo ID / F,
CDH23/PCDH15, digenica ![]()
·
MedlinePlus Enciclopedia: Retinite pigmentosa ![]()
È disponibile un test genetico per la sindrome di Usher?
Finora, sono stati trovati 11 loci genetici (un segmento del cromosoma in cui si trova un certo gene) per causare la sindrome Usher, e sono stati individuati nove geni che causano la malattia. Sono:
· Tipo 1 La sindrome di Usher: MY07A, USH1C, CDH23, PCDH15, SANS
· Tipo 2 La sindrome di Usher: USH2A, VLGR1, whrn
· Tipo 3 sindrome di Usher: USH3A
Con così tanti possibili geni coinvolti nella sindrome di Usher,i test genetici per la malattia non possono sono effettuati in modo capillare. La diagnosi di sindrome di Usher è di solito effettuata attraverso i tests dell'udito, dell'equilibrio, e della visione. Il test genetico per alcuni dei geni identificati è clinicamente disponibile. Per conoscere i laboratori che effettuano test clinici, visitare il sito Web www.GeneTests.org e cercare la directory laboratorio digitando il termine "sindrome di Usher". Il test genetico per ulteriori geni sindrome di Usher potrebbe essere disponibile attraverso studi di ricerca clinica. Per informazioni sulle sperimentazioni cliniche che includono il test genetico per la sindrome di Usher, visitare il sito Web www.clinicaltrials.gov e digitare il termine di ricerca "sindrome di Usher" o "test genetici Usher".
Condotta da tenere
L'esame oftalmologico esteso al fondo dell'occhio deve essere sistematico e ripetuto nel bambino e nell'adulto sordi e ogni sordità profonda congenita con ritardo della deambulazione senza eziologia evidente deve fare eseguire un elettroretinogramma, anche se il fondo dell'occhio è normale. La diagnosi precoce è molto importante al fine del programma terapeutico-riabilitativo. La prognosi infatti è caratterizzata dalla comparsa di una cecità attorno ai 3 0-40 anni di età che andrà a sommarsi al deficit uditivo. compromettendo notevolmente il grado di autonomia del soggetto
Che trattamento è disponibile per la sindrome di Usher?
Attualmente non esiste un trattamento medico per prevenire, rallentare la progressione della, o inibire la trasmissione di sindrome di Usher. Impianto cocleare è una valida opzione provata per le persone con sindrome di Usher. Gli individui con tipo I sono candidati dalla nascita, mentre quelli con tipo II o III può diventare candidati nel corso del tempo. Qualità significativo di miglioramento della vita sono state dimostrate per i bambini con sordità congenita che ricevono impianti cocleari (Schorr, Roth, e Fox, 2009), e l'impianto è stato dimostrato come benefico per i bambini sordi con una varietà di disabilità associate (Berrettini et al., 2008). Perché la perdita dell'udito nella sindrome di Usher è cocleare in natura, l'impianto cocleare è una raccomandazione ragionevole e ha, di fatto, dimostrato di beneficiare funzionamento uditiva e sociale dei bambini con sindrome di Usher tipo I (Damon, Pennings, Snik, e Mylanus 2006 ; Liu et al, 2008)..
Ad oggi non esiste alcun trattamento per la RP. Molti individui mantengono un piccolo campo visivo utilizzabile anche in quinta o sesta decade di vita. Vi sono prove preliminari che i fattori ambientali e dietetici possono aumentare la longevità di visione utilizzabile. Questi includono proteggere la retina dalla luce ultravioletta indossando 100% UVA / UVB occhiali da sole e mantenere la salute globale ottimale. L'esercizio fisico e la dieta, come ad esempio a base di pesce ricco di omega-3, sono stati anche suggeriti (Berson, 2000). Gli studi sulla vitamina A e acido docosaesaenoico (DHA) trattamenti hanno creato qualche polemica (Massof & Finkelstein, 1993) e fino ad oggi sono stati solo condotti su persone con RP non sindromica e alcuni Usher di tipo II pazienti (Berson et al sentite., 1993, 2004a , 2004b). I pazienti devono essere avvertiti concernente una supplementazione di vitamina perché consumano troppo può causare ipervitaminosi conseguente cecità, mancanza di crescita, e anche la morte. Le donne e le donne incinte che possono diventare incinte non dovrebbero utilizzare integratori come la vitamina A, perché possono causare difetti alla nascita nel feto.
Implicazioni psicosociali della sindrome di Usher
La perdita sensoriale duale, in particolare la perdita progressiva della vista, presenta molteplici sfide per le persone con sindrome di Usher e le loro famiglie. In genere la perdita dell'udito è stata affrontata e le decisioni sono state fatte sulla metodologia di comunicazione. Una cultura identità Deaf può essere stata stabilita prima conoscenza della perdita della vista imminente. I genitori sono spesso sopraffatti dalla seconda diagnosi e credono che dovrebbero proteggere i loro figli da questa informazione fino a tardi. Nel frattempo, il bambino può sospettare qualcosa ed avere ancora più paura perché lui o lei non capisce. Condivisione di informazioni adeguate all'età con i bambini è il miglior approcio. Non hanno bisogno di sentirsi dire che stanno "diventando ciechi", ma hanno bisogno di sapere che vedono in modo diverso e che ci sono strategie che li aiuteranno a navigare nel loro mondo. Può essere giustificata l'aiuto di UNA consulenza professionale. Vivere con la sindrome di Usher richiede adattamenti per tutta la vita a cambiare lo stato di visione (Miner, 1995) e, in alcuni casi, cambiare le capacità uditive. Come audiologi, non possiamo supporre ci sono professionisti che hanno familiarità con l'impatto della perdita sensoriale duale. La maggior parte degli specialisti della vista non conoscono la perdita dell'udito e di fatto dipendono dall’audito per aiutare i loro pazienti non vedenti. Gli individui con sindrome di Usher sono sempre sordi o con problemi di udito prima che siano ipovedenti o non vedenti.
Il ruolo dell’ audiologo
La diagnosi di una significativa perdita di udito in un bambino può così dominare la nostra attenzione come audiologi che possiamo trascurare le altre condizioni invalidanti. I genitori si affidano a audiologi per informazioni e supporto nel lavoro con i loro bambini che hanno la perdita dell'udito. Infatti, Steinberg e colleghi (2007) hanno identificato le interazioni dei genitori con l'audiologo come tema importante nel loro esame dei racconti dei genitori in materia di test genetici per la perdita dell'udito. Gli autori hanno indicato che le aspettative dei genitori con gli audiologi includono le informazioni riguardanti le risorse, sostegno e orientamento con i rinvii e test, e permettendo ai genitori di adattarsi alle loro nuovi ruoli. In sintesi, "audiologi sono spesso tenuti a consigliare, guidare e aiutare i genitori attraverso le loro decisioni e le scelte" (Steinberg et al., 2007, p. 64). Inoltre, l'American Speech-Language-Hearing Association (ASHA) Linee guida per la valutazione Audiologic dei bambini dalla nascita ai 5 anni di età consiglia di audiologi dovrebbero ", come opportuno, discutere valutazioni speciali aggiuntivi (ad esempio, la genetica, oculistica, sviluppo infantile) con i genitori / tutori ei neonati primario fornitore di cure "(ASHA, 2004, p. 19). Ciò richiede che l'audiologo avere familiarità con l'epidemiologia genetica della sordità e delle risorse di rinvio e di informazione.
Altre forme di ipoacusia associate a perdita della vista
Secondo la Gallaudet Research Institute (2008), il 40% di tutti i bambini con perdita dell'udito neurosensoriale sono noti per avere una o più condizioni invalidanti supplementari. In questo gruppo, il 10% ha problemi di vista non correggibile. Differenziazione tra i bambini ipovedenti e coloro che sono sordo-ciechi è irto di difficoltà dovute alla variabilità dell’udito residuo e della funzione visiva. Perdita della vista, come la perdita dell'udito, varia notevolmente in gravità e può essere misurata come acuità visiva da vicino e lontano, campo visivo periferico, sensibilità al contrasto, visione dei colori, sensibilità all'abbagliamento, e / o la visione notturna. Così come non si può veramente prevedere la competenza comunicativa di un paziente da un audiogramma per i toni- puri, un singolo parametro visivo non predice il funzionamento visivo.
Mentre Usher è la sindrome più frequentemente associato con RP, ci sono altre condizioni che il clinico deve conoscere. La Sindrome di Alport si manifesta con perdita dell’ udito, nefrite progressiva, e chiazze maculari che possono essere fraintesi come RP, mentre la malattia di Refsum si presenta con anosmia, sordità, e vero RP (Hamel, 2006). Altre condizioni come la sindrome di CHARGE, citomegalovirus, toxoplasmosi, e la meningite può causare contemporaneamente perdita dell’udito e della vista. 2008 Conte Child Nazionale dei bambini e dei giovani che sono sordo-ciechi riporta 10.766 bambini di età compresa nascita attraverso 21 anni sono stati identificati come (Consorzio Nazionale sulla sordocecità, 2008) sordo-ciechi. Indipendentemente dalla eziologia, un audiologo deve essere sensibile alla visione e le strategie suggerite qui per lavorare con i pazienti con sindrome di Usher è applicabile a molti altri pazienti con compromesse delle capacità visive.
Casi individuali da wikipendia
Casi individuali [ modifica ]
Una donna di 31 anni, con la sindrome di Usher, Rebecca Alexander, è stato profilato in Marie Claire nel novembre 2007. [21] Dopo la laurea presso la University of Michigan con ottimi voti, Alexander ha continuato alla Columbia University , dove ha conseguito due gradi di master nella sanità pubblica e clinico sociale. Rebecca è un membro attivo della sua comunità, collaborando con diverse associazioni di beneficenza a New York. La dedizione di Rebecca come membro attivo della sua comunità è stata in particolare riconosciuta quando è stata selezionata come una "Comunità Hero" per correre con la torcia olimpica per i Giochi di Atlanta olimpici del 1996 in onore del suo lavoro di volontariato per il progetto Open Hand, un'organizzazione no-profit consegna pasti per le persone che vivono con l'HIV / AIDS nella zona di San Francisco Bay. Rebecca ha ricevuto la sua formazione psicoterapia psicodinamica attraverso l'American Institute di Psicoanalisi. Attualmente lavora in uno studio privato specializzato nel trattamento dei disturbi dell'umore e d'ansia, disturbi alimentari, dipendenze, disabilità, e traumi. Mentre attualmente facilita seminari di gruppo per la Foundation Fighting Blindness durante le conferenze nazionali, Rebecca è anche in procinto di lanciare l'iniziativa Usher III, un'organizzazione no profit dedicata alla scienza e alla ricerca che cerca di trovare una cura per Usher III. Rebecca insegna ciclismo / spin nelle classi interne con un forte seguito in alcune palestre di New York City. È stata descritta sulla Today Show della NBC il 20 marzo 2009, che è stato nominato per un premio Emmy nel settembre 2010. Lei è la sorella di NBC News Nazionale Corrispondente Peter Alexander.
Christine "Coco" Roschaert [22] è una persona conosciuta con la sindrome di Usher. Ha pubblicato un video blog su YouTube, [23] e recentemente è stato l'altoparlante kick-off per la Settimana della prevenzione della sordità presso l' Università del Vermont . [24]Nel 2006, si è laureata con una laurea in Scienze della Comunicazione alla Gallaudet University ; lì, lei ha fatto lo sciopero della fame come segno di protesta 2006 organizzata dalla Gallaudet Stati Ora Movimento . [25] Roschaert è ora in Nigeria per la fondazione del programma prima sordociechi .
Una web-community, UsherLife , delle persone con sindrome di Usher è stata fondata il 1 ° febbraio 2005 da Nick Sturley. Anche se centrata sulla Gran Bretagna , che offre risorse per tutte le persone con sindrome di Usher. L'organizzazione sta ospitando regolarmente ritrovi in Inghilterra, come il Usher Hood Pub a Nottingham [26] e un viaggio a Brighton Pier. [27] Altre persone con sindrome di Usher hanno inviato video sulla loro vita e le condizioni su YouTube , in particolare . Ginny Paja-Nyholm[28] Nell'ottobre 2007, Candice, una mamma che vive in Texas, ha iniziato a bloggare sulle sue due figlie, Jasmine e Rebecca;Rebecca che hanno la sindrome di Usher I. [29]
Catherine Fischer ha scritto un'autobiografia ben accolta di “crescere con la sindrome di Usher in Louisiana”, intitolato Orchidea del Bayou. [30] Allo stesso modo, Vendon Wright ha scritto due libri che descrivono la sua vita con la sindrome di Usher, ero cieco, ma ora vedo [31] e attraverso i miei occhi. [32] Louise Boardman ha anche scritto un breve libro intitolato Mio figlio ha la sindrome di Usher. [33]
Christian Markovic, un artista che vive con la sindrome di Usher, gestisce una società, Fuzzy disegni wuzzy. [34]
Spencer Tracy figlio s 'Giovanni era una persona ben conosciuta con la sindrome di Usher, che ha vissuto una vita piena. [35] IlJohn Tracy Clinic è stata fondata nel 1942 da sua madre Louise per offrire assistenza gratuita ai genitori dei bambini udenti e bambini in età prescolare . [1]
Jacob Desormeaux, figlio del fantino di ippica Kent Desormeaux , ha la sindrome di Usher. Jacob è nato sordo e sta progressivamente diventando cieco. Kent ha dedicato la sua corsa nelle Belmont Stakes , che lui e il suo cavallo darebbero Big Brown la Triple Crown, a suo figlio Giacobbe. La famiglia ha avviato un'organizzazione per raccogliere fondi e la consapevolezza della malattia. La sindrome di Usher è sproporzionatamente comune tra i cajun della Louisiana a sud, come Desormeaux e Fischer, a causa di una mutazione genetica tra i primi francesi Acadian coloni in Nova Scotia .
Elica del DNA co-scopritore e premio Nobel James D. Watson ha pubblicato[36] USH1B mutazioni omozigoti, secondo il suo genoma. Non è chiaro il motivo per cui egli non ha sviluppato la sindrome. Questa mancanza di penetranza genetica sostiene che l'espressione del fenotipo della sindrome di Usher può essere più complessa di quanto inizialmente ipotizzato.
Il "Nalaga'at" israeliano (fare touch) sordo-ciechi Acting Ensemble è composto da 11 attori sordo-cieco, molti dei quali sono diagnosticati con sindrome di Usher. Il gruppo teatrale ha messo su diverse produzioni ed è apparso sia localmente che in Israele e all'estero a Londra e Broadway. [37]
References
Alexander R, Grossman AJ (November 2007). "out of sight, out of sound". Marie Claire 14 (11): 191–193.American Speech-Language-Hearing Association. (2004). Guidelines for the audiologic assessment of children from birth to 5 years of age. Available from www.asha.org/policy .
Bell J (1933). Retinitis Pigmentosa and Allied Diseases (2nd ed.). London: Cambridge University Press.
Berrettini, S., Forli, F., Genovese, E., Santarello, R., Arslan, E., Chilosi, A., & Cipriani, P. (2008). Cochlear implantation in deaf children with associated disabilities: Challenges and outcomes. International Journal of Audiology, 47, 199–208.
Berson, E. (2000). Nutrition and retinal degeneration. International Ophthalmology Clinics , 40 (4), 93–111.
Berson, E., Rosner, B., Sandberg, M., Hayes, K., Nicholson, B., Weigel-DiFranco, C., & Willett, W. (1993). A randomized trial of vitamin A and vitamin E supplementation for retinitis pigmentosa. Archives of Ophthalmology, 111 , 761–772.
Berson, E., Rosner, B., Sandberg, M., Weigel-DiFranco, C., Moser, A., Brockhurst, R., et al. (2004a). Clinical trial of docosahexaenoic acid in patients with retinitis pigmentosa receiving vitamin A treatment. Archives of Ophthalmology, 122 , 1297–1305.
Berson, E., Rosner, B., Sandberg, M., Weigel-DiFranco, C., Moser, A., Brockhurst, R., et al. (2004b). Further evaluation of docosahexaenoic acid in patients with retinitis pigmentosa receiving vitamin A treatment: Subgroup analyses. Archives of Ophthalmology, 122, 1306–1314.
Boughman, J., Vernon, M., & Shaver, K. (1983). Usher syndrome: Definition and estimate of prevalence from two high-risk populations. Journal of Chronic Diseases, 36, 595–603.
Carr, R., & Noble, K. (1981). Retinitis pigmentosa. Ophthalmology, 88 (2), 169–172.
Chen, D. (2004). Young children who are deaf-blind: Implications for professional in deaf and hard of hearing services. Volta Review, 104 (4), 273–284.
Cohen, M., Bitner-Glindziez, M., & Luxon, L. (2007). The changing face of Usher syndrome: Clinical implications. International Journal of Audiology, 46, 82–93.
Damon, G., Pennings, R., Snik, A., & Mylanus, E. (2006). Quality of life and cochlear implantation in Usher syndrome type I. Laryngoscope, 116, 723–728.
Davenport S, Omenn G (1977). The Heterogeneity of Usher Syndrome (volume 426 ed.). Amsterdam: Excerpta Medica Foundation.
Edwards, A., Fishman, G., Anderson, R., Grove, S., & Derlackie, D. (1998). Visual acuity and visual field impairment in Usher syndrome. Archives of Ophthalmology, 116 , 165–168.
Fishman GA, Kumar A, Joseph ME, Torok N, and Andersonj RJ (1983). "Usher's syndrome". Archives of Ophthalmology 101 (9): 1367–1374.
Gallaudet Research Institute. (2008). Regional and national summary report of data from the 2007–08 annual survey of deaf and hard of hearing children and youth. Washington, DC: Author.
Gerber, S; Bonneau, D; Gilbert, B; Munnich, A; Dufier, JL; Rozet, JM; Kaplan, J (2006). "USH1A: chronicle of a slow death". American Journal of Human Genetics 78 (2): 357–9.
Gorlin R, Tilsner T, Feinstein S, Duvall AJ (1979). "Usher syndrome type III". Arch. Otolaryngol. 105 (6): 353–354.
Grøndahl J (1987). "Estimation of prognosis and prevalence of retinitis pigmentosa and Usher syndrome in Norway". Clin. Genet. 31 (4): 255–264.
Gorlin, R., Torella, H., & Cohen, M. (1995). Hereditary hearing loss and its syndromes. Oxford, England: Oxford University Press
Hallgren B (1959). "Retinitis pigmentosa combined with congenital deafness with vestibulo-cerebellar ataxia and mental abnormality in a proportion of cases: Clinical and geneto-statistical survey". Acta Psychiatrica Scandinavica Suppl. 34 (138): 9–101.
Hamel, C. (2006). Retinitis pigmentosa. Orphanet Journal of Rare Diseases, 1 :(40, 1 – 12).
Hammerschlag V (1907). "Zur Kenntnis der hereditaer-degenerativen Taubstummen und ihre differential diagnostische Bedeutung". Z. Ohrenheilk. 54: 18–36.
Harrison, S., & Rousch, J. (1996). Age of suspicion, identification, and intervention for infants and young children with hearing loss: A national study. Ear and Hearing, 17, 55–62.
Hashimoto T, Gibbs D, Lillo C, Azarian SM, Legacki E, Zhang XM, Yang XJ, Williams DS (2007). "Lentiviral gene replacement therapy of retinas in a mouse model for Usher syndrome type 1B". Gene Therapy 14 (7): 584–594
Hicks, W., & Hicks, D. (1981). The Usher's syndrome adolescent: Programming implications for school administrators, teachers, and residential advisors. American Annals of the Deaf, 26 , 422–431.
Hope CI, Bundey S, Proops D, Fielder AR (1997). "Usher syndrome in the city of Birmingham — prevalence and clinical classification". British Journal of Ophthalmology 81 (1): 46–53.
Innaccone, A., Kritchevsky, S., Ciccarelli, M., Tedesco, S., Macahuso, C., Kimberling, W., & Somes, G. (2004). Kinetics of visual field loss in Usher syndrome type II. Investigative Ophthalmology & Visual Science, 45 , 784–792.
Keats, B. (2002). Genes and syndromic hearing loss. Journal of Communication Disorders, 33, 355–366.
Kimberling, W., & Lindenmuth, A. (2007). Genetics, hereditary hearing loss, and ethics. Seminars in Hearing, 28 (3), 216–225.
Liebreich R (1861). "Abkunft aus Ehen unter Blutsverwandten als Grund von Retinitis pigmentosa". Dtsch. Klin. 13: 53.
Liu, X., Angeli, S., Rajput, K., Yan, D., Hodges, A., Eshraghi, A., et al. (2008). Cochlear implantation in individuals with Usher type 1 syndrome. International Journal of Pediatric Otorhinolaryngology, 72, 841–847.
Massof, R., & Finkelstein, D. (1993). Supplemental vitamin A retards loss of ERG amplitude in retinitis pigmentosa. Archives of Ophthalmology, 111, 751–754.
Merin S, Auerbach E (1976). "Retinitis pigmentosa". Surv. Ophthalmol. 20 (5): 303–345. doi:10.1016/S0039-6257(96)90001-6
Mets MB, Young NM, Pass A, Lasky JB (2000)."Early diagnosis of Usher syndrome in children".Transactions of the American Ophthalmological Society 98: 237–45.
Miner, I. (1995). Psychosocial implications of Usher syndrome, type I, throughout the life cycle. Journal of Visual Impairment & Blindness, 89 (3), 287–296.
Moller, C., Kimberling, W., Davenport, S., Priluck, L., & White, V. (1989). Usher syndrome: An otoneurologic study. Laryngoscope, 99, 73–79.
National Consortium on Deaf-Blindness. (2008). National Child Count of Children and Youth Who Are Deaf-Blind . Retrieved December 2, 2009, from www.nationaldb.org/documents/products/2008-Census-Tables.pdf [PDF].
Otterstedde CR, Spandau U, Blankenagel A, Kimberling WJ, Reisser C (2001). "A new clinical classication for Usher's syndrome based on a new subtype of Usher's syndrome type I". Laryngoscope 111 (1): 84–86.
Ouyang XM, Yan D, Du LL, Hejtmancik JF, Jacobson SG, Nance WE, Li AR, Angeli S, Kaiser M, Newton V, Brown SD, Balkany T, Liu XZ (2005). "Characterization of Usher syndrome type I gene mutations in an Usher syndrome patient population". Hum Genet 116 (4): 292–299.
Pakarinen L, Tuppurainen K, Laipapala P, Mäntyjärvi M, Puhakka H (1996). "The ophthalmological course of Usher syndrome type III". International Ophthalmology 19 (5): 307–311.
Petit, C (2001). "Usher syndrome: from genetics to pathogenesis". Annual review of genomics and human genetics 2: 271–97.
Piazza, L., Fishman, G., Farer, M., Derlacki, D., & Anderson, R. (1986). Visual acuity loss in patients with Usher's syndrome. Archives of Ophthalmology, 104 , 1336–1339.
Plantinga, R., Pennings, R., Huygen, P., Sankila, E., Tuppurainen, K., Kleemola, L., et al. (2006). Visual impairment in Finnish Usher syndrome type III. Acta Ophthalmologica Scandinavica, 84 (1), 36–41.
Reiners, J; Nagel-Wolfrum, K; Jürgens, K; Märker, T; Wolfrum, U (2006). "Molecular basis of human Usher syndrome: deciphering the meshes of the Usher protein network provides insights into the pathomechanisms of the Usher disease". Experimental eye research 83 (1): 97–119.
Reisser, C., Kimberling, W., & Otterstedde, C. (2002). Hearing loss in Usher syndrome type II is nonprogressive. Annals of Otology, Rhinology and Laryngology,111, 1108–1111.
Roux AF, Faugere V, Le Guedard S, Pallares-Ruiz N, Vielle A, Chambert S, Marlin S, Hamel C, Gilbert B, Malcolm S, Claustres M (2006). "Survey of the frequency of USH1 gene mutations in a cohort of Usher patients shows the importance of cadherin 23 and protocadherin 15 genes and establishes a detection rate of above 90%". J Med Genet 43 (9): 763–768.
Sadeghi, A., Eriksson, K., Kimberling, W., Sjostrom, A., & Moller, C. (2006). Longterm visual prognosis in Usher syndrome types 1 and 2. Acta Ophthalmologica Scandinavica, 84, 537–544.
Sadeghi, M., Cohn, E., Kelly, W., Kimberling, W., Tranebjarg, L., & Moller, C. (2004). Audiological findings in Usher syndrome types IIa and II (non-IIa). International Journal of Audiology, 43, 136–143.
Sadeghi, M., Cohn, E., Kimberling, W., Tranebjarg, L., & Moller, C. (2005). Audiological and vestibular features in affected subject with USH3: A genotype/phenotype correlation. International Journal of Audiology, 44, 307–316.
Sankila EM, Pakarinen H, Kääriäinen H, Aittomäki K, Karjalainen S, Sistonen P, de la Chapelle A (1995). "Assignment of Usher syndrome type III (USH3) gene to chromosome 3q". Hum. Mol. Genetics 4 (1): 93–98.
Schorr, E., Roth, F., & Fox, N. (2009). Quality of life for children with cochlear implants: Perceived benefits and problems and the perception of single words and emotional sounds . Journal of Speech, Language, and Hearing Research, 52, 141–152.
Seeliger, M., Zrenner, E., Apfelstedt-Sylla, E., & Jaissle, G. (2001). Identification of Usher syndrome subtypes by ERG implicit time. Investigative Ophthalmology and Visual Science, 42, 3066–3071.
Smith RJ, Berlin CI, Hejtmancik JF, Keats BJ, Kimberling WJ, Lewis RA, et al. (1994). "Clinical diagnosis of the Usher syndromes. Usher Syndrome Consortium".American Journal of Medical Genetics 50 (1): 32–38.
Steinberg, A., Kaimal, G., Ewing, R., Soslow, L., Lewis, K., Krantz, I., & Li, Y. (2007). Parental narratives of genetic testing for hearing loss: Audiologic implications for clinical work with children and families. American Journal of Audiology, 16, 57–67.
Usher C (1914). "On the inheritance of Retinitis pigmentosa with notes of cases". Roy. Lond. Ophthalmol. Hosp. Rep. 19: 130–236.Wagenaar, M., Snik, A., Kimberling, W., & Cremers, C. (1996). Carriers of Usher syndrome type IB: Is audiometric identification possible? The American Journal of Otology, 17, 853–858.
Vernon M (1969). "Usher's syndrome — deafness and progressive blindness. Clinical cases, prevention, theory and literature survey". Journal of Chronic Diseases 22 (3): 133–151.
von Gräfe A (1858). "Exceptionelles Verhalten des Gesichtsfeldes bei Pigmententartung der Netzhaut". Archiv für Ophthalmologie 4: 250–253.
Wallber, J. (1995–2005). Annual reports of the Eye & Ear Clinic. Rochester, NY: National Technical Institute for the Deaf at Rochester Institute of Technology.
Williams DS (2007). "Usher syndrome: Animal models, retinal function of Usher proteins, and prospects for gene therapy". Vision Research xx (3): xx–xx.doi:10.1016/j.visres.2007.08.015Web Resources
Boys Town National Research Hospital Usher Syndrome Web page
National Consortium on Deaf-Blindness
National Consortium on Deaf-Blindness, State Deaf-Blind Projects
National Institute on Deafness and Other Communication Disorders Usher Syndrome Web page
National Institutes of Health Usher Syndrome Web page
National Library of Medicine Genetics Home Reference
Second Sight Medical Products, Inc. retinal prosthesis—investigational device
Understanding Usher Syndrome: Information for School Counselors [PDF, 2 MB]