Otite esterna maligna o necrosante
|

|

|
|
Fig 1.:Otite Esterna Necrotizzante
(nota in precedenza come "Otite Esterna Maligna")
|
Fig 2.
|
► Definizione: L’otite esterna maligna OEM) è una rara infezione invasiva necrotizzante del condotto uditivo esterno e dell’osso temporale, della base cranica causata da Pseudomonas aeruginosa (100%), soprattutto in pazienti anziani con diabete mellito e in pazienti con immunodepressione ha prognosi spesso infausta: la mortalità raggiunge infatti il 30% dei casi.
La gravità di questa patologia infettiva del condotto uditivo esterno ha spinto gli autori delle prime pubblicazioni che avevano identificato questa entità ad attribuirle la qualifica di «otite maligna». Questo termine non è in realtà adatto poiché esso riguarda una infezione e non un processo tumorale. È per questo motivo che altri autori hanno introdotto un'altra terminologia: «otite necrotizzante» od «otite invasiva». [Handzel O., 2003 ;] La denominazione di otite esterna nasconde infine la gravità dell'estensione in profondità, con osteite della base del cranio, che rappresenta l'autentica gravità della malattia. [Rubin Grandis J., 2004 [cross-ref] ]
L'otite esterna maligna colpisce principalmente, ma non esclusivamente, i soggetti anziani poiché l'età media va da 60 a 75 anni. Nella maggior parte dei casi viene riscontrato un diabete. La qualità del controllo del diabete non sembra svolgere un ruolo nella comparsa della malattia. Il diabete può essere scoperto in occasione della malattia. L'otite esterna maligna può anche evolvere su tutti i terreni immunodeficienti.

Figura 9 :
Otite esterna maligna. Gemmazione situata sul pavimento del condotto uditivo in una donna diabetica il cui orecchio sinistro è dolente. Questo quadro clinico deve far sospettare subito la diagnosi.
► Storia: Toulmouche è stato probabilmente il primo medico di segnalare un caso di otite esterna maligna (MEO), nel 1838. Nel 1959, Meltzer ha riportato un caso di Pseudomonas con osteomielite dell'osso temporale. Nel 1968, Chandler ha discusso le caratteristiche cliniche di otite esterna maligna (MEO) e definita come una malattia clinica distinta. [1] Egli ha descritto questo come otite esterna maligna perché ha osservato un comportamento aggressivo clinico, povero risultato del trattamento, e un alto tasso di mortalità tariffa per i pazienti affetti da questa malattia.
►Epidemiologia: Il paziente tipico con otite esterna maligna è un diabetico anziano, con gli uomini che superano le donne di due volte .Questo potrebbe essere dovuto alla possibilità che gli uomini sono più inclini a secernere cerume di natura più acida. L’otite esterna maligna è molto rara nei bambini, se presente, verrà associata con l'infezione da HIV o malnutrizione.
|

|

|
|
C'è ulcerazione, necrosi e annerimento del canale uditivo esterno destro e parte del padiglione ( Fig. 3.1 ).
|
Il condotto uditivo esterno è riempito di tessuto molle rossastro e pus verdastro, con tre escare nerastre sul cuoio capelluto ( Fig.. 3.1 ), il collo e la fronte ( Fig. 3.2 ).
|
► Eziopatogenesi. Lo Pseudomonas aeruginosa è responsabile della quasi totalità dei casi anche se sono descritti esempi sporadici secondari ad altri microrganismi (Aspergillus flavus e fumigatus, Staphylococcus aureus, Klebsiella oxytoca).
Lo Pseudomonas elabora enzimi proteolitici in grado di attaccare la parete vascolare sino a produrre una estesa vascolite necrotizzante. Inoltre, sviluppa facilmente resistenza agli antibiotici e riesce ad evitare la fagocitosi proteggendosi con uno strato mucoso. Nel paziente diabetico è verosimile che la microangiopatia. associata alla vascolite necrotizzante prodotta dallo Pseudomonas. favorisca la progressione in profondità dell’infezione. Il disturbo vascolare legato all'età e al diabete rappresenta uno dei fattori di rischio essenziali. Esso favorirebbe l'invasione da Pseudomonas aeruginosa in un tessuto alterato dall'ischemia. La sua aggressività è molto alta quando diviene patogeno, con importante necrosi tissutale nel punto di impianto. Esso prolifera, tanto più che non necessita di molto ossigeno. Si propaga per prossimità, il che spiega l'ampia diffusione settica. La patologia dei tessuti molli del condotto uditivo esterno consegue a un'erosione cutanea che può essere minima e inocula Pseudomonas aeruginosa. L'estensione dell'infezione avviene verso la profondità, all'unione tra condotto osseo e condotto cartilagineo. L'osteite del temporale si estende alla base del cranio, potendo ledere i nervi cranici. In assenza di trattamento, l'infezione si complicherebbe con una meningite.
Diabete (90% dei pazienti)
Diabete è il fattore di rischio più significativo per lo sviluppo di otite esterna maligna (MEO).
Vasculopatia dei piccoli vasi e disfunzione immunitaria associata al diabete sono i principali responsabili di questa predisposizione.
Il cerume dei pazienti con diabete ha un pH più elevato e ridotta concentrazione di lisozima, che può alterare l'attività antibatterica locale.
Nessuna differenza di predisposizione è stata trovata tra diabete tipo I e II.
La predisposizione non è necessariamente in relazione alla gravità di intolleranza al glucosio o ai periodi di iperglicemia.
Immunodeficienze, come malattie linfoproliferative o immunosoppressione farmaco-correlati
AIDS
Otite esterna maligna (OEM) associato all'AIDS può avere una fisiopatologia diverso classico otite esterna maligna (OEM).
I pazienti presentano sintomi simili, ma sono generalmente più giovani e non hanno il diabete.
Tessuto di granulazione può essere assente nel canale uditivo esterno.
Pseudomonas non è necessariamente l'organismo causativo dominante.
Pazienti con AIDS hanno generalmente un risultato più povero di pazienti con diabete.
Lavaggi auricolari: è stato segnalato che (nei pazienti con diabete) il 50% dei casi di otite esterna maligna (OEM) è stato preceduto da lavaggi auricolari traumatici.
►Quadro clinico. Sintomatologia: inizia come una otite esterna banale (pag. 125), quindi compaiono aumento della pressione auricolare, grave dolore specie notturno, dolore in corrispondenza dell’ATM (spontaneo e durante la masticazione). La malattia si presenta come una infiammazione molto dolorosa del condotto uditivo esterno, associata ad otorrea purulenta e polipi di granulazione. L’otalgia rappresenta il sintomo di esordio nel 75% dei casi, è intensa, si accentua nella notte spesso risvegliando il paziente e si associa ad una cefalea occipitale o temporale particolarmente severa, L’otorrea purulenta compare nel corso della malattia con una frequenza che va dal 50 all’80% dei casi: può variare da una modesta secrezione umida ad un essudato verdastro maleodorante e copioso. L'esame otoscopico mostra un'area polipoide o necrotica nel pavimento del condotto, l’impianto delle qranulazioni si riscontra tipicamente sul pavimento del condotto, tra la pars cartilaginea e quella ossea, oppure nell’angolo tra tetto del meato ed anulus timpanico. All’esame istologico il tessuto di granulazione non presenta caratteri peculiari, ma un quadro aspecifico di flogosi con infiltrazione di cellule infiammatorie. iperplasia od ispessimento dell’epitelio squamoso. Bisogna tentare in ogni modo di pervenire alla diagnosi di otite necrotica prima dello stadio di necrosi ossea e di paralisi faciale.
La diagnostica per immagini è indispensabile per confermare la diagnosi allo stadio precoce, precisare il grado della necrosi alla base del cranio, nonché per controllare l'evoluzione, in particolare in caso di assenza di risposta favorevole sotto trattamento medico. Allo stadio precoce, la tomografia (TC) mette in evidenza un'osteolisi dell'anello timpanico, particolarmente sulla parete anteriore e la corticale mastoidea, associata a una tumefazione dei tessuti molli. Ad uno stadio più avanzato, la zona di distruzione ossea può essere riscontrata all'articolazione temporomandibolare, all'osso petroso o alla corticale occipitale. Il controllo TC dopo trattamento non è sistematicamente necessario se la prognosi è favorevole. La TC è l'esame diagnostico di prima intenzione.
La risonanza magnetica (RM) permette di completare la TC, ma non è indispensabile per la valutazione di estensione. Essa svela l'interessamento delle parti molli, ma, grazie alle sequenze pesate T1 e T2, rivela anche le estensioni alla midollare ossea e agli spazi adiposi. Essa valuta meglio l'interessamento dei forami della base del cranio rispetto alla TC. La scintigrafia è stata considerata per molto tempo un esame fondamentale per la diagnosi precoce dell'otite esterna necrotizzante. I suoi risultati sono oggi superati dai dati degli esami TC e RM.
La progressione della malattia è stata suddivisa in stadi clinici riportati in Tabella I (da Davis, 1992).
|
Stadio I: infezione del condono uditivo esterno e tessuti molli contigui con dolore profondo, con o senza paralisi del nervo facciale
|
|
Stadio II: estensione dell’infezione con osteite del temporale e base cranica, o neuropatie multiple dei nervi cranici
|
|
Stadio III: estensione intracranica con meningite, empiema epidurale, empiema subdurale od ascesso cerebrale
|
Tab I Stadi clinico-radiologici dell’otite esterna maligna.
Il primo stadio della OEM è caratterizzato da una cellulite del tessuti molli del condotto uditivo con otorrea profusa e proliferazione di tessuto di granulazione. L’infezione può progredire attraverso le scissure di Santorini sia anteriormente verso l’articolazione temporo-mandibolare. la loggia parotidea ed i muscoli massetere e temporale. sia inferiormente verso il forame stilomastoideo con paralisi del nervo facciale. In questa fase. che può persistere invariata per settimane o mesi, le cavità aeree dell’orecchio medio e delta mastoide si mantengono generalmente deterse.
Nel secondo stadio l’infezione ha determinato una osteomielite che dal condotto si è estesa all’osso temporale e/o alla base cranica. La prima manifestazione clinica della progressione in profondità della malattia è generalmente la comparsa di una paralisi del nervo facciale (di solito a livello del forame stilomastoideo). Col progredire della malattia, i nervi cranici IX, X, XI e possono essere colpiti al forame giugulare, seguito dal XII al canale ipoglosso. Nervi cranici V e VI possono essere influenzate se la malattia si estende fino all'apice petroso. Nel 1977, Chandler riportato una incidenza 32% di paralisi del nervo facciale. [2] L'incidenza di paralisi del nervo facciale appare diminuito con lo sviluppo della terapia medica più efficace come mostrato da Franco-Vidal et al hanno riportato un'incidenza del 20% paralisi del nervo facciale in 46 pazienti trattati. [3] Gli altri nervi cranici sono colpiti meno frequentemente rispetto al settimo nervo cranico. Lo sviluppo della neuropatia cranica in genere è stato pensato in modo da riflettere la malattia in stadio avanzato associato ad una prognosi peggiore. Più recentemente, Corey et al, Soudry et al, e Mani et al hanno suggerito che la presenza di paralisi del nervo facciale non peggiora la prognosi. [4, 5] Il deficit dei nervi cranici compare generalmente dopo più di due mesi dall’esordio della malattia, ma può iniziare anche precocemente. in qualche caso dopo una settimana (Corey.1985). La paralisi del nervo facciale ha un’incidenza che varia dal 24 al 43% in statistiche diverse, mentre le altre neuropatie craniche dal 15 al 35%. La paralisi dei nervi cranici è talora reversibile, in particolare la paralisi del facciale sembra avere una ripresa completa in oltre il 20% dei casi ed una parziale nel 10% circa. Il recupero della funzione del nervo facciale è imprevedibile, e non deve essere usato come un indicatore di successo del trattamento. Gli altri nervi cranici ,che sono affetti, hanno un più alto tasso di recupero.
 |
|
Fig.:4 mostra paziente con otite esterna maligna e paralisi facciale
|
Nel terzo stadio il processo infettivo raggiunge le strutture intracraniche, le logge cervicali ed i grossi vasi del collo. Queste complicazioni si verificano raramente, in assenza di paralisi dei nervi cranici. Possono derivarne: meningite, ascesso cerebrale, e trombosi del seno durale .Neuropatie craniche legate al forame giugulare dovrebbero sollevare preoccupazione per la trombosi del seno sigmoideo. Trombosi del seno cavernoso dovrebbe essere presa in considerazione se i nervi cranici V o VI sono interessati. Complicazioni intracraniche riflettono una malattia grave e sono comunemente fatali. Cause più frequenti di exitus sono infatti meningite. tromboflebite settica o rottura dei grossi vasi, setticemia, polmonite da inalazione per paralisi vagale. accidenti cerebrovascolari
Condizioni di comorbilità: I pazienti con otite esterna maligna (OEM) hanno quasi sempre il diabete, spesso con multipli altri problemi di salute. Durante il corso della terapia, Chandler ha trovato alcuni decessi legati alla polmonite, uremia, infarto del miocardio, ictus, insufficienza epatica. Franco-Vidal ha mostrato che i pazienti con immunodeficienze sistemiche hanno una prognosi peggiore. [3]
Criteri di Levenson per la diagnosi di otite esterna maligna:
-
Otite esterna refrattaria
-
Grave otalgia notturno
-
otorrea purulenta
-
Tessuto di granulazione nel canale esterno
-
La crescita di Pseudomonas aeruginosa dal canale esterno
-
Presenza di diabete e di e di altro stato immunocompromessi
Gli algoritmi dell Imaging in questi pazienti sono:
1. TC99 scan per cercare le prove del coinvolgimento osseo
2. Se questo è positivo TAC e risonanza magnetica è un must per escludere ossa e dei tessuti molli
3. Serial Ga 67 scansioni per valutare l'efficacia delle modalità di trattamento.
Stadiazione e Classificazione:
|
Tappa
|
Ga67
|
TC99
|
Estensione della malattia
|
|
I
|
+
|
-
|
Tessuti molli (Otite necrotizzante)
|
|
II
|
+
|
+
|
Orecchio e mastoide
(osteomielite della base cranica)
|
|
III
|
+
|
+
|
ampia base di osteomielite del cranio
|
► Complicazioni: diffusione alla parotide (attraverso le incisure di Santorini), al forame stilomastoideo (paresi del facciale) e / o giugulare (deficit del IX, X e XI paio), base cranica; trombosi del seno sigmoideo/cavernoso, sepsi. Meningite. Ascesso epidurale. Possibile l’esito letale!
Diagnostica
► Indispensabile:
• Ispezione: pericondrite, otorrea, evtl. granulazioni al limite tra parte cartilaginea e parte ossea del condotto.
• Palpazione: con un uncino da orecchio smusso tastare con cautela il condotto uditivo sotto controllo microscopico (l’osso messo a nudo o ruvido depone per un’osteomielite iniziale o conclamata). Palpazione della parotide (dolore)?
• Valutazione ORL.
• Otomicroscopia: secrezione fetida (dall’odore dolciastro), condotto uditivo
ripieno di granulazioni parzialmente in necrosi, facilmente sanguinanti.
• Esame della funzione uditiva: prove con diapason, audiogramma.
• Esame della funzione vestibolare: occhiali di Frenzel (nistagmo spontaneo o latente, nistagmo di posizione o di posizionamento
• Esame della funzione dei nervi facciale e trigemino.
• Ecografia: parotide, collo.
• Tampone auricolare: Pseudomonas aeruginosa.
• TC dei temporali e della base del cranio (l’indagine migliore per definire l’estensione della malattia e per valutare l’integrità dell’osso corticale) , eventualmente seguiti da scintigrafia ossea.
• Esami di laboratorio: emocromo con formula (leucocitosi con spostamento a sinistra), PCR, VES (sovente> 8Omm/hr), glicemia (curva glicemica da carico) La VES è inoltre un indicatore dell’attività della malattia ed è utile per monitorare il decorso della terapia e l’efficacia della cura con antibiotici.
• Valutazione multidisciplinare: internista.
• TC dei temporali e della base del cranio (l’indagine migliore per definire l’estensione della malattia e per valutare l’integrità dell’osso corticale) , eventualmente seguiti da scintigrafia ossea. La scintigrafia ossea al tecnezio ed all’indio possono essere di aiuto nella diagnosi precoce, mentre quella a radiogallio sarebbe di maggior utilità come monitoraggio durante e dopo la terapia. Nella scintigrafia al tecnezio il radionuclide si concentra nelle zone di lisi ossea dovuta al processo infettivo, ed è sufficiente un aumento del 100/o dell’attività osteolitica ed osteoblastica per un chiaro riscontro scintigrafico. Con questa metodica la sensibilità è elevata, mentre la specificità è purtroppo scarsa: qualsiasi processo flogistico od infettivo comprese le forme più gravi di otite esterna comune, fratture, carcinomi e patologie dell’articolazione temporo-mandibolare danno un quadro scintigrafico del tutto sovrapponibile a quello della OEM.
 |
Tomografia assiale computerizzata (TAC) in un paziente di 65 anni, di sesso maschile con diabete mellito che ha avuto una grave otalgia notturna per due mesi. Questo paziente è stata inviato a causa di una paralisi del nervo facciale che ha sviluppato, nonostante il trattamento orale con ofloxacina . La TAC mostra distruzione ossea dell'osso temporale destro. Notare la parete posteriore mancante del condotto uditivo esterno (freccia corta). Celle d'aria mastoide sono secondariamente coinvolti e sono opacizzati (freccia lunga) rispetto al lato sinistro ben aerato.
|
 |
La TAC è utilizzata per determinare la posizione e l'estensione del tessuto malato. L'osso temporale è il primo osso ad essere colpiti, con iniziale interessamento dell'apice petroso e mastoideo.
|
 |
TAC rocca petrosa è utile nella diagnosi di mastoidite e distruzione ossea.
|
► Utile in casi particolari:
• Biopsia: esclusione di tumore maligno.
• Scintigrafia ossea (tecnezio - difosfonato - SPECT): dimostrazione di aree di
 |
 |
|
Una scansione gallio dovrebbe quindi essere fatto. Il gallio citrato 67 mostrerà il focus infetto nell'osso temporale coinvolto legandosi ai granulociti
|
Otite Esterna Necrotizzante(Scan Gallio)
Descrizione: Linea di disegno per la fotografia precedente
|
 |
scintigrafia con Gallio citrato Ga 67 ad un paziente di 74-anni, di sesso maschile con diabete mellito e osteite dell'osso temporale del lato sinistro. Questo paziente è stata inviato per una otalgia persistente e otorrea dopo una terapia prolungata di antibiotici, per via orale e sistemica. Come risultato dell’infezione in corso, l'osso temporale sinistro mostra una aumentata di 67Ga (freccia). captazione
|
• distruzione ossea attiva (infiammatoria).
• Esame degli ultimi nervi cranici (n. glossofaringeo, n. vago, test di Schirmer
riflesso stapediale esame del gusto).
• Elettronistagmografia (ENG): prove rotatorie ecc., niente irrigazione.
Diagnosi differenziale
► Ferite della cute del condotto uditivo, corpi estranei.
► Otite esterna semplice .
► Colesteatoma.
► Carcinoma Epidermoide.
► Tumori Glomici.
► Carcinoma del rinofaringe.
► Cordomi del clivus.
►Granulornatosi di Wègener.
►Malattia di Hand-Schuller-Christian,
►Granuloma Eosinofìlo.
►Arterite temporale e policondrite ricorrente.
► Neoplasie maligne del condotto uditivo esterno.
Terapia
► Terapia medica:
• Trattamento internistico del diabete mellito di base.
• Toilette accurata quotidiana del condotto uditivo, curettage ed asportazione delle granulazioni.
• Trattamento locale:
- Applicare più volte al giorno gocce auricolari attive contro lo Pseudomonas (per es. a base di gentamicina).
- Gocce auricolari contenenti alcool.
• Antibioticoterapia per via parenterale ad alto dosaggio combinata con ossigenoterapia iperbarica.
-
chinolonici di 2a generazione ciprofloxacina 750 mg (p.o.)/die per 6-8 settimane;
-
aminoglicosidici antipseudomonas quali gentamicina. tobramicina, amikacina
-
penicilline antipseudomonas quali ticarcillina (o ticarcillina-clavulanato) piperacillina (o piperacillina-tazobactam)preferibilmente associate agli aminoglicosidici.
d) altri beta-lattamici per via endovenosa quali meropenem di prima scelta, od in alternativa imipenem ed aztreonam..
La terapia antibiotica deve essere protratta da un minimo o di 6-8 settimane sino ai sei mesi. Nelle forme iniziali si utilizza generalmente un fluorchinolonico per os (es. ciprofloxacina alle dosi di 1000 o 1500 mg/die in 2 somministrazioni). La terapia antibiotica viene associata a regolare detersione del condotto uditivo esterno in otomicroscopia. lavaggi medicati ed antibiotico locale.
◙Attenzione: nonostante la possibile ototossicità di alte dosi di antibiotici aminoglicosidici, bisogna ignorare questo aspetto a causa del possibile esito letale della malattia. Sono necessari controlli audiometrici (prima, dopo e ogni secondo giorno durante la terapia), dosaggio serico degli antibiotici aminoglicosidici, esame della funzionalità renale.
◙Attenzione: risultati di ricerche recenti mostrano che gli effetti collaterali oto tossici degli antibiotici aminoglicosidici possono essere largamente diminuiti mediante l’assunzione simultanea di un bioccante del ferro (effetto chelante). Così l’acido acetilsalicilico lega il ferro libero che è corresponsabile dell’effetto tossico dell’antibiotico aminoglicosidico sulle cellule acustiche esterne. Dose raccomandata 3-4 x i g/die. Nessuna perdita di efficacia dell’antibiotico (J. Schacht, Ann Arbor, 2004).
• Ossigenoterapia iperbarica: complementare in caso di osteomielite estesa della rocca.
• Analgesici, ad azione periferica (al bisogno).
► Indicazioni all’intervento chirurgico, principi dell’intervento:
► Formazione di ascessi e sequestri ossei: rimozione del tessuto di granulazione e
dei sequestri ossei e cartilaginei in “tessuto sano”, drenaggio di ascessi.
►Estensione dell’infezione: se, nonostante tutte le misure conservative, l’infezione si estende clinicamente, oppure lo dimostrano la scintigrafia ossea o la TC, in direzione della mastoide, della base cranica e / o della ghiandola parotide (incisure del Santorini): resezione dei distretti ossei colpiti, ad es, mastoidectomia, radicale, petrosectomia laterale (rimozione dell’intero condotto uditivo con parte dell’orecchio medio, eventualmente con parotidectomia)
► Ambulatoriale/con ricovero: sempre con ricovero in caso di diagnosi accertata.
Prognosi
►In caso di trattamento locale ottimale con buona compensazione del diabete, come pure in caso di inizio precoce dell’antibioticoterapia combinata ad alte dosi (minimo per 6 settimane), con contemporanea ossigenoterapia iperbarica, di solito guarigione senza postumi (controlli con scintigrafia ossea). In altri casi è possibile l’esito letale a seguito di sepsi, meningite e ascesso cerebrale.
Prevenzione
È essenziale non dimenticare mai la gravità potenziale di un lavaggio dell'orecchio in un diabetico e considerare come una potenziale otite esterna maligna qualsiasi otite esterna che compare in un soggetto immunodeficiente, anche se si tratta di un bambino.
In un tale contesto, dopo ogni trauma, si deve disinfettare il condotto uditivo esterno con, per esempio, del Solubacter® diluito e applicare una pomata di tipo neomicina/triamcinolone (Kataval®).
Conclusione
Se non vi è alcun dubbio di fronte all'associazione di una otite esterna molto dolorosa e persistente in un diabetico relativamente anziano e una paralisi faciale, occorre non respingere la diagnosi in assenza di paralisi faciale, di diabete o di terreno di immunodeficienza.
Ogni otite esterna acuta che resiste al termine di 1 settimana di trattamento abituale, con persistenza di dolori, soprattutto se la velocità di eritrosedimentazione è elevata, deve essere considerata un'otite esterna necrotizzante. La presenza di Pseudomonas aeruginosa è un elemento cardine supplementare, ricordando la sua presenza abituale in molte otorree persistenti.
Un trattamento iniziato alla fase di cellulite permette una guarigione senza postumi se le modalità terapeutiche sono identiche a quelle di un'otite esterna maligna conclamata. In particolare, occorre non abbreviare la durata del trattamento antibiotico, pena la comparsa di una recidiva nei giorni successivi.
Bibliografia
Amorosa L, Modugno GC, Pirodda A. Malignant external otitis: review and personal experience. Acta Otolaryngol Suppl. 1996;521:3-16. [Medline].
Bae WK, Lee KS, Park JW, et al. A case of malignant otitis externa caused by Candida glabrata in a patient receiving haemodialysis. Scand J Infect Dis. 2007;39(4):370-2. [Medline].
Cahana Z, Gilboa A, Raz R. Changes in susceptibility to ciprofloxacin in a community in northern Israel. Drugs. 1995;49(suppl 2):173–4.
Chandler JR. Malignant external otitis. Laryngoscope. 1968;78:1257–94.
Chandler JR. Pathogenesis and treatment of facial paralysis due to malignant external otitis. Ann Otol Rhinol Laryngol. Oct 1972;81(5):648-58. [Medline].
Chandler JR. Malignant external otitis, further considerations. Ann Otol, Rhinol Laryngol 1977; 86: 417-428. Links ]
Chandler JR. Malignant external otitis and osteomyelitis of the base of the skull. Am J Otol. Mar 1989;10(2):108-10. [Medline].
Cohn AM. Progressive necrotizing otitis. Malignant external otitis. Arch Otolaryngol. 1974;99:136–9.
Cooper MA, Andrews JM, Wise R. Ciprofloxacin resistance developing during treatment of malignant otitis externa. J Antimicrob Chemother. 1993;32:163–4.
Corey JP, Levandowski RA, Panwalker AP. Prognostic implications of therapy for necrotizing external otitis. Am J Otol. Jul 1985;6(4):353-8. [Medline].
Dan NIR, Tsila NIR. Clinical records malignant external otitis in an infant. J Laryngol Otol 1990; 104: 488-490.[ Links ]
Davis JC, Gates GA, Lerner C, Davis MG Jr, Mader JT, Dinesman A. Adjuvant hyperbaric oxygen in malignant external otitis. Arch Otolaryngol Head Neck Surg. 1992;118:89–93. . Chandler JR. Malignant external otitis. Laryngoscope 1968; 78: 1257-1293.[ Links ]
Drew SJ, Himmelfarb R, Sciubba JJ. Invasive (malignant) external otitis progressing to osteomyelitis of the temporomandibular joint: a case report. J Oral Maxillofac Surg. 1993;51:429–31.
Driscoll PV, Ramachandrula A, Drezner DA, Hicks TA, Schaffer SR. Characteristics of cerumen in diabetic patients: a key to understanding malignant external otitis?. Otolaryngol Head Neck Surg. Oct 1993;109(4):676-9. [Medline].
Epstein JS, Ganz WI, Lizak M, Grobman L, Goodwin WJ, Dewanjee MK. Indium 111-labeled leukocyte scintigraphy in evaluating head and neck infections. Ann Otol Rhinol Laryngol. Dec 1992;101(12):961-8. [Medline].
Gehanno P. Ciprofloxacin in the treatment of malignant external otitis. Chemotherapy. 1994;40 Suppl 1:35-40. [Medline].
Gherini SG, Brackmann DE, Bradley WG. Magnetic resonance imaging and computerized tomography in malignant external otitis. Laryngoscope. May 1986;96(5):542-8. [Medline].
Gold S, Som PM, Lucente FE, Lawson W, Mendelson M, Parisier SC. Radiographic findings in progressive necrotizing "malignant" external otitis. Laryngoscope. Mar 1984;94(3):363-6. [Medline].
Grandis JR, Curtin HD, Yu VL. Necrotizing (malignant) external otitis: prospective comparison of CT and MR imaging in diagnosis and follow-up. Radiology. Aug 1995;196(2):499-504. [Medline].
Handzel O., Halperin D. Necrotizing (malignant) external otitis Am Fam Physician 2003 ; 68 : 309-312
Huminer D, Siegman-Igra Y, Morduchowicz G, Pitlik SD. Ecthyma gangrenosum without bacteraemia. Report of six cases and review of the literature. Arch Intern Med 1987; 147: 299-301.[ Links ]
Iannini PB, Claffey T. Bacteraemia pseudomonas pneumonia. JAMA 1974; 230; 558. [ Links ]
Johnson MP, Ramphal R. Malignant external otitis: report on therapy with ceftazidime and review of therapy and prognosis. Rev Infect Dis. Mar-Apr 1990;12(2):173-80. [Medline].
Kimmelman CP, Lucente FE. Use of ceftazidime for malignant external otitis. Ann Otol Rhinol Laryngol. Sep 1989;98(9):721-5. [Medline].
Kraus D.H., Rehm S.J., Kinney S.E. The evolving treatment of necrotizing external otitis Laryngoscope 1988 ; 98 : 934-939
Kraus DH, Rehm SJ, Kinney SE. The evolving treatment of necrotizing external otitis. Laryngoscope. 1988;98:934–9.Handzel O., Halperin D. Necrotizing (malignant) external otitis Am Fam Physician 2003 ; 68 : 309-312
Lang R, Goshen S, Kitzes-Cohen R, Sadé J. Successful treatment of malignant external otitis with oral ciprofloxacin: report of experience with 23 patients. J Infect Dis. Mar 1990;161(3):537-40. [Medline].
Levenson MJ, Parisier SC, Dolitsky J, Bindra G. Ciprofloxacin: drug of choice in the treatment of malignant external otitis (MEO). Laryngoscope. 1991;101:821–4.
Meltzer PE, Kelemen G. Pyocyaneous osteomyelitis of the temporal bone, mandible and zygoma. Laryngoscope. 1959;169:1300–16.
Mendelson DS, Som PM, Mendelson MH, Parisier SC. Malignant external otitis: the role of computed tomography and radionuclides in evaluation. Radiology. Dec 1983;149(3):745-9. [Medline].
Meyers BR, Mendelson MH, Parisier SC, Hirschman SZ. Malignant external otitis. Comparison of monotherapy vs combination therapy. Arch Otolaryngol Head Neck Surg. Sep 1987;113(9):974-8. [Medline].
Mull CC, Scarfone RJ, Conway D. Ecthyma gangrenosum as a manifestation of Pseudomonas sepsis in a previously healthy child. Ann Emerg Med 2000; 36: 383-387. [ Links ]
Nadol JB Jr. Histopathology of Pseudomonas osteomyelitis of the temporal bone starting as malignant external otitis. Am J Otolaryngol. Nov 1980;1(5):359-71. [Medline].
Okpala NC, Siraj QH, Nilssen E, Pringle M. Radiological and radionuclide investigation of malignant otitis externa. J Laryngol Otol. Jan 2005;119(1):71-5. [Medline].
Ophir H, Doron H. Necrotizing (malignant) external otitis. Am Fam Physician 2003; 68: 309-312. [ Links ]
Pacini DL, Trevorrow T, Rao MK, Birck HG, Barson WJ. Malignant external otitis as the presentation of childhood acute lymphocytic leukemia. Pediatr Infect Dis J. 1996;15:1132–4.
Redleaf MI, Angeli SI, McCabe BF. Indium 111-labeled white blood cell scintigraphy as an unreliable indicator of malignant external otitis resolution. Ann Otol Rhinol Laryngol. Jun 1994;103(6):444-8. [Medline].
Ress BD, Luntz M, Telischi FF, Balkany TJ, Whiteman ML. Necrotizing external otitis in patients with AIDS. Laryngoscope. Apr 1997;107(4):456-60. [Medline].
Rubin J, Yu VL. Malignant external otitis: insights into pathogenesis, clinical manifestations, diagnosis, and therapy. Am J Med. Sep 1988;85(3):391-8. [Medline].
Rubin J, Yu VL, Kamerer DB, Wagener M. Aural irrigation with water: a potential pathogenic mechanism for inducing malignant external otitis?. Ann Otol Rhinol Laryngol. 1990;99(2 pt 1):117–9.
Rubin Grandis J, Branstetter BF 4th, Yu VL. The changing face of malignant (necrotising) external otitis: clinical, radiological, and anatomic correlations. Lancet Infect Dis. Jan 2004;4(1):34-9. [Medline].
Rubinstein E, Ostfeld E, Ben-Zaray S, Schiby G. Necrotizing external otitis. Paediatrics 1980; 66: 618-620.[ Links ]
Sander R. Otitis externa: a practical guide to treatment and prevention. Am Fam Physician. 2001;63:927–36,941–2.
Seabold JE, Simonson TM, Weber PC, et al. Cranial osteomyelitis: diagnosis and follow-up with In-111 white blood cell and Tc-99m methylene diphosphonate bone SPECT, CT, and MR imaging. Radiology. Sep 1995;196(3):779-88. [Medline].
Shpitzer T, Stern Y, Cohen O, Levy R, Segal K, Feinmesser R. Malignant external otitis in nondiabetic patients. Ann Otol Rhinol Laryngol. 1993;102:870–2.
Slattery WH 3rd, Brackmann DE. Skull base osteomyelitis. Malignant external otitis. Otolaryngol Clin North Am. Oct 1996;29(5):795-806. [Medline].
Soldati D, Mudry A, Monnier P. Necrotizing otitis externa caused byStaphylococcus epidermidis. Eur Arch Otorhinolaryngol. 1999;256:439–41.
Song WK, Kim YC. Ecthyma gangrenosum without bacteraemia in a leukaemic patient. Clin Exp Dermatol 2001; 26: 395-397. [ Links ]
Stokkel MP, Boot CN, van Eck-Smit BL. SPECT gallium scintigraphy in malignant external otitis: initial staging and follow-up. Case reports. Laryngoscope. Mar 1996;106(3 Pt 1):338-40. [Medline].
Stokkel MP, Takes RP, van Eck-Smit BL, Baatenburg de Jong RJ. The value of quantitative gallium-67 single-photon emission tomography in the clinical management of malignant external otitis. Eur J Nucl Med. Nov 1997;24(11):1429-32. [Medline].
Strauss M, Aber RC, Conner GH, Baum S. Malignant external otitis: long-term (months) antimicrobial therapy. Laryngoscope. Apr 1982;92(4):397-406. [Medline].
Sudhoff H, Linthicum FH Jr. Malignant external otitis: temporal bone histopathology case of the month. Otol Neurotol. Mar 2003;24(2):346-7. [Medline].
Tillotson JR, Lerner AM. Characteristics of non bacteremic pseudomonas pneumonia. Ann Intern Med 1968; 68: 295. [ Links ]
Uri N, Gips S, Front A, Meyer SW, Hardoff R. Quantitative bone and 67Ga scintigraphy in the differentiation of necrotizing external otitis from severe external otitis. Arch Otolaryngol Head Neck Surg. Jun 1991;117(6):623-6. [Medline].


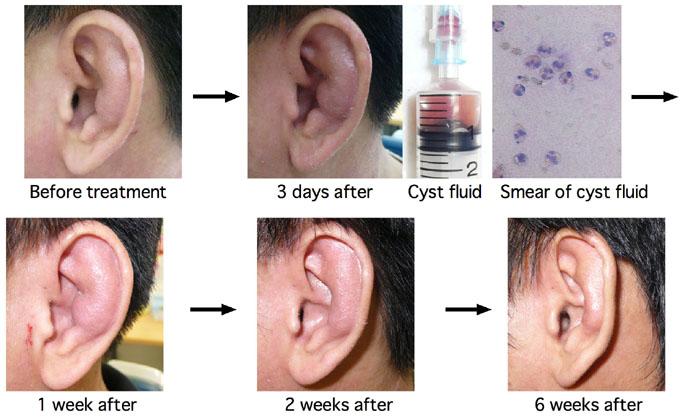






















 5
5 6
6 7
7 8
8