Fisiologia dei fluidi del labirinto
- Categoria: Fisiologia
- Pubblicato: Martedì, 27 Marzo 2012 15:36
- Visite: 63185
- Stampa
I fluidi del labirinto, perilinfa ed endolinfa, hanno un doppio ruolo fisiologico: concorrono all’attivazione delle cellule ciliate cocleari e vestibolari attraverso la trasmissione del segnale meccanico e partecipano alla trasformazione del segnale in un messaggio nervoso attivando fenomeni molecolari tra i liquidi e le cellule ciliate. Grazie alle osservazioni, tanto istologiche quanto terapeutiche, che hanno suggerito l’esistenza di una relazione tra udito e omeostasi dei fluidi dell’orecchio interno, molti studi hanno permesso di precisare i caratteri fisicochimici dei fluidi del labirinto. Alla fine degli anni Cinquanta due scoperte hanno segnato una svolta decisiva nello studio di questi fluidi: la misura di un potenziale di riposo elevato e positivo nell’endolinfa cocleare (+80 mV rispetto al sangue o alla perilinfa) da parte di Von Bekesy e la dimostrazione di concentrazioni elevate di potassio e basse di sodio nell’endolinfa cocleare e vestibolare da parte di Smith et al. Questi risultati hanno guidato le ricerche, in particolare nella coclea, per i trenta anni successivi, ricerche sviluppate a partire da concetti e tecniche elaborati per la fisiologia cellulare e per la fisiologia dei trasporti transmembranari. Nei successivi venti anni sono state applicate le tecniche di biologia cellulare e molecolare allo studio dell’orecchio interno. La tappa seguente è stata superata con l’identificazione di numerose mutazioni coinvolte nella comparsa di sordità sindromiche o non sindromiche. Attualmente, la composizione dei fluidi del labirinto è ben stabilita, sono state precisate le origini rispettive di perilinfa ed endolinfa, sono stati chiariti i meccanismi cellulari implicati nella secrezione di ciascuno di questi liquidi e sono stati identificati alcuni dei sistemi regolatori di tali fluidi. I progressi realizzati nella comprensione dei meccanismi fisiopatologici implicati nel mantenimento dell’omeostasi dei fluidi dell’orecchio interno dovrebbero permettere, in un prossimo futuro, di aprire nuove strade per la terapia delle sordità e delle vertigini legate direttamente o indirettamente alle anomalie di tali fluidi.
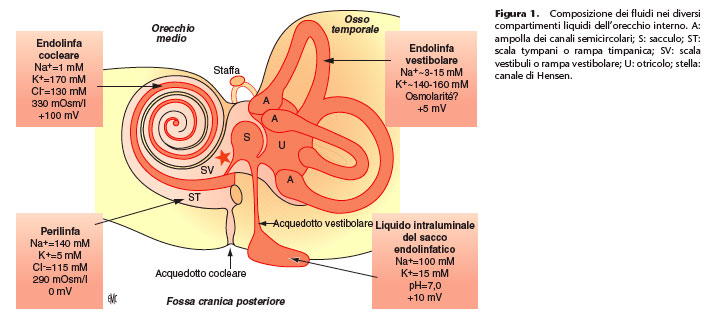
Composizione dei fluidi del labirinto
Nell’orecchio interno il labirinto membranoso, epitelio neurosensoriale eterogeneo e serrato separa due compartimenti ripieni di liquidi extracellulari di composizione chimica molto diversa. Le cavità del labirinto membranoso sono riempite di endolinfa, mentre gli spazi compresi tra i labirinti membranoso e osseo sono pieni di perilinfa. Nella coclea dei mammiferi l’endolinfa è contenuta nella scala media o canale cocleare, la perilinfa nella rampa vestibolare e nella rampa timpanica (Fig. 1). È da notare che la quasi totalità dei dati della letteratura è stata ottenuta negli animali. Sono stati realizzati pochi studi nell’uomo, spesso nel corso della chirurgia dell’otospongiosi, del sacco endolinfatico o dello schwannoma vestibolare. Questi studi, spesso datati, riguardano un piccolo numero di casi e l’interpretazione dei risultati, tenuto conto della patologia sottostante da una parte e della difficoltà a non avere contaminazioni (plasma, liquido cefalorachideo [LCR]) dall’altra, è spesso difficile. Tuttavia, i risultati ottenuti nell’uomo sono del tutto equivalenti a quelli ottenuti nei piccoli mammiferi di laboratorio.
Composizione dell’endolinfa
L’endolinfa ha una composizione del tutto originale: è un liquido ricco di potassio (K+, 150 a 180 mM) e di cloro (Cl-,~150 mM), e povero di sodio (Na+, ~1 mM). Le concentrazioni di Na+ e K+ sono simili nelle diverse parti del sistema endolinfatico, a eccezione del sacco endolinfatico, e questo nei mammiferi come negli uccelli, nei rettili come negli anfibi.
Tra gli altri componenti dell’endolinfa (studiati soprattutto nella coclea), occorre notare che i livelli di calcio (0,02 mM nella coclea, 0,20 mM nel vestibolo), magnesio (0,01 mM nella coclea), proteine (0,6 g/l nella coclea) e glucosio (<0,6 mM nella coclea) sono molto più scarsi nell’endolinfa che nella perilinfa e nel plasma. Al contrario, il pH dell’endolinfa è simile a quello del plasma o della perilinfa.
Altra particolarità di questo liquido, l’endolinfa è iperosmotica (330 mOsm/l) rispetto alla perilinfa e al plasma. Questa osmolarità è legata soprattutto alla concentrazione elevata di
KCl.
Potenziale endolinfatico
Il potenziale transepiteliale o endolinfatico (endococleare nella coclea), misurato mediante l’introduzione di un microelettrodo nelle diverse cavità del sistema endolinfatico, è positivo
in rapporto al sangue o alla perilinfa, ma il suo valore varia secondo la cavità in cui è misurato: da +80 a +110 mV nella coclea dei mammiferi, da +15 a +20 mV nella coclea degli uccelli, da +10 a +20 mV nel sacco endolinfatico dei mammiferi, +5 mV nell’apparato vestibolare dei mammiferi, degli uccelli e nelle diverse cavità endolinfatiche dell’orecchio interno di rettili e anfibi.
In corso di anossia o in caso di somministrazione di vari farmaci (diuretici, uabaina), questo potenziale diminuisce, per poi raggiungere un valore negativo chiamato «potenziale
d’anossia». Questo potenziale negativo corrisponderebbe al trasporto passivo di K+ che esce dall’endolinfa attraverso l’organo del Corti.
Gradienti longitudinali intracocleari
I valori del potenziale endococleare, delle concentrazioni ioniche e dell’osmolarità non sono uniformi da un giro all’altro della coclea dei mammiferi. Il potenziale endococleare e le
concentrazioni di K+ e di Cl-, così come l’osmolarità, si riducono dalla base verso l’apice della coclea. Si deve notare che l’attività dell’Na+,K+-adenosina trifosfatasi (ATPasi), coinvolta nella secrezione di K+ (cfr. infra), si riduce anche dalla base verso l’apice della coclea. Al contrario, le concentrazioni di Na+ e di calcio ionizzato (Ca2+) aumentano dalla base verso l’apice. Il pH dell’endolinfa del giro basale non è invece diverso da quello del
giro medio della coclea.
Liquido intraluminale nel sacco endolinfatico
La composizione dell’endolinfa nel sacco endolinfatico è del tutto diversa da quella contenuta negli altri compartimenti endolinfatico o perilinfatico [3]:
• il rapporto delle concentrazioni Na+ e K+ è inverso a quello del sistema endolinfatico cocleare o vestibolare, con 100 mmol/l di Na+ e 10 a 20 mmol/l di K+;
• la concentrazione di proteine qui è più elevata (~10-30 g/l);
• il potenziale transepiteliale è basso: +10-+20 mV, luce positiva;
• il pH è più acido: 6,0-7,0.
Perilinfa
La perilinfa ha una composizione simile a quella di un liquido extracellulare: il catione principale è il Na+ (140 mM) e l’anione principale il Cl- (120 mM), la concentrazione di
proteine è bassa (~2 g/l). Esistono differenze di composizione tra le perilinfe delle rampe vestibolare e timpanica: le concentrazioni di K+, proteine e glucosio (~4 mM) sono più elevate nella perilinfa vestibolare che nella perilinfa timpanica. Inoltre, questi due liquidi differiscono per la loro composizione in aminoacidi.
Si possono realizzare scambi tra i due liquidi all’apice della coclea attraverso l’elicotrema e in ognuno dei giri della coclea attraverso il legamento spirale. In effetti, la maggior parte degli
studi è stata realizzata nei roditori che hanno un acquedotto cocleare permeabile, cosa che consente scambi tra il LCR e la perilinfa timpanica (Fig. 2). Alcuni lavori hanno dimostrato che la composizione della perilinfa timpanica variava in funzione del volume di liquido prelevato e l’osservazione che la composizione della perilinfa timpanica è diversa da quella della perilinfa vestibolare resta controversa, in particolare per quel che riguarda la concentrazione di K+.
Liquidi a contatto con le cellule sensoriali
Nella coclea è possibile identificare la cortilinfa che occupa gli spazi extracellulari dell’organo del Corti e la linfa sottotectoriale che è contenuta nello spazio compreso tra la membrana tectoria e il piano cuticolare delle cellule ciliate. Con lo studio in vitro dell’organo del Corti con microsonde elettroniche è stato dimostrato che i livelli di Na e K della cortilinfa sono simili a
quelli della perilinfa e che quelli della linfa sottotectoriale sono simili a quelli dell’endolinfa.
Formazione della perilinfa
La perilinfa può derivare da due differenti fonti (Fig. 2): da una parte, il plasma può essere il precursore della perilinfa con le reti vascolari capillari, particolarmente sviluppate nel rivestimento tissutale della rampa vestibolare; dall’altra, la LCR può essere all’origine della perilinfa, dato che gli spazi subaracnoidei e il giro basale della rampa timpanica comunicano mediante l’acquedotto cocleare. Molti studi hanno tentato di precisare, nei roditori, i meccanismi implicati nella formazione della perilinfa e le parti rispettive di plasma e di LCR.
Barriera ematoperilinfatica
Lo studio della penetrazione nella perilinfa di diverse molecole ha dimostrato che il plasma è il liquido precursore della perilinfa vestibolare. Il meccanismo implicato nella formazione della perilinfa non è un’ultrafiltrazione. In effetti, anche se la concentrazione di proteine è scarsa, nessuno degli ioni contenuti nella perilinfa si distribuisce secondo l’equilibrio di Gibbs-Donnan. Inoltre, è stato possibile mettere in evidenza alterazioni della composizione della perilinfa senza modificazioni della composizione plasmatica.
La nozione di «barriera ematoperilinfatica» è stata ipotizzata per la lentezza degli scambi tra il plasma e la perilinfa. Questa barriera, come la barriera ematoencefalica, è localizzata nei
capillari perilinfatici: il loro rivestimento è continuo, con cellule endoteliali unite da giunzioni serrate e il cui contenuto in vescicole di pinocitosi è scarso. I caratteri della barriera ematoperilinfatica studiati fino ad oggi sono:
• l’impermeabilità delle macromolecole;
• la selettività agli elettroliti e alle molecole idrosolubili neutre in funzione del loro peso molecolare;
• la presenza di un trasporto facilitato di D-glucosio. Questo trasportatore sarebbe di tipo GLUT1. È stato localizzato con immunistochimica nelle cellule endoteliali vascolari.
Schematicamente, la permeabilità della barriera ematoperilinfatica alle molecole idrosolubili può essere riassunta come segue: Na ≈K≈ Cl ≈ D-glucose > urée > L-glucose ≈ mannitol ≈ sucrose. Sul piano fisiopatologico questa barriera ematoperilinfatica limita l’ingresso delle molecole che possono avere un effetto tossico sulle cellule sensoriali, come gli aminoglicosidi. Allo stesso modo, però, essa limita l’uscita di queste stesse molecole che sono riuscite a superare una prima volta tale barriera (a causa di una concentrazione elevata in modo duraturo nel plasma, per esempio) e può così concorrere al fenomeno ototossico a motivo
dela lenta eliminazione del tossico dalla perilinfa.
Secrezione della perilinfa
Oltre agli scambi attraverso una barriera, si ipotizza l’esistenza di una secrezione della perilinfa vestibolare per spiegare l’ingresso più rapido di Na+ (molecola caricata) che dell’urea
(molecola neutra) nella perilinfa. Una tale differenza esiste anche nel LCR, liquido la cui composizione risulta allo stesso tempo da scambi attraverso la barriera ematocerebrale e da una secrezione da parte dei plessi corioidei. Questa secrezione potrebbe essere localizzata nella zona vasculoepiteliale del limbus spirale, dove sono state identificate attività elevate di
Na+, K+-ATPasi e di anidrasi carbonica. Anche i fibrociti del legamento spirale potrebbero essere implicati: vi è stata messa in evidenza un’attività Na+,K+-ATPasi. La secrezione epiteliale della perilinfa potrebbe dipendere dall’attività dell’anidrasi carbonica, perché l’ingresso del Cl- nella perilinfa, come quello nel LCR, diminuisce dopo somministrazione di acetazolamide, inibitore specifico di questo enzima.
Differenze tra perilinfa timpanica e perilinfavestibolare: ruolo del liquido cefalorachideo
Sono state messe in evidenza differenze di cinetica di trasporto tra la perilinfa vestibolare e quella timpanica: L’ingresso del mannitolo e del saccarosio è più rapido nella perilinfa vestibolare che nella perilinfa timpanica e nel LCR. Tuttavia, la perilinfa timpanica è di solito prelevata nel giro basale della coclea dei roditori, il che fa intervenire una distorsione
nell’analisi dei risultati. In effetti, la perilinfa timpanica del giro basale è formata in gran parte da un flusso LCR attraverso l’acquedotto cocleare, permeabile nei roditori, mentre il LCR partecipa solo per meno del 10% alla formazione della perilinfa vestibolare. Nell’uomo sono stati realizzati pochi studi. Sembra che l’acquedotto cocleare, permeabile nel bambino, si occluda gradualmente con tessuto connettivo più denso, il che limiterebbe gli scambi, ma permetterebbe l’equilibrio delle pressioni. Il fatto che il LCR partecipi, almeno in parte, alla
formazione della perilinfa timpanica dalla base della coclea non sembra indurre un ruolo fisiologico importante. In effetti, l’ostruzione dell’acquedotto cocleare non modifica l’udito
nell’animale.
Formazione dell’endolinfa
Il liquido precursore dell’endolinfa è la perilinfa e non il plasma. Questo risultato è stato ottenuto con l’analisi delle cinetiche di ingresso nell’endolinfa di traccianti radioattivi del
K+ e del Cl- somministrati per via perilinfatica e per via venosa (per una review cfr. [1, 2]). Gli elettroliti sono trasportati tra la perilinfa e l’endolinfa da meccanismi attivi, poiché nessuno di essi è in equilibrio elettrochimico da una parte all’altra dell’epitelio
labirintico.
Secrezione di K+: ruolo delle diverse strutture che formano l’epitelio labirintico
Schematicamente, l’epitelio cocleare comprende tre strutture:
la membrana di Reissner, la stria vascolare e l’organo del Corti.
Ognuna di queste strutture, in modo indipendente e coordinato, concorre all’omeostasi dell’endolinfa.
Membrana di Reissner
La membrana di Reissner è formata da due tipi di cellule:
mesoteliali sul versante perilinfatico ed epiteliali sul versante endolinfatico, queste ultime unite da giunzioni serrate. Sono state localizzate cariche negative sul versante perilinfaticoche possono rappresentare una barriera all’ingresso delle molecole cariche negativamente, in particolare il Cl-, dalla perilinfa verso l’endolinfa .


Sul versante endolinfatico delle cellule epiteliali sono stati messi in evidenza dei canali non
selettivi, attivati dallo stiramento (stretch-activated) [15]. Questi canali potrebbero partecipare alla riduzione di volume del compartimento endolinfatico nell’idrope endolinfatica, substrato anatomico della malattia di Ménière, favorendo una fuoriuscita di K+ dall’endolinfa verso la perilinfa. In effetti, in un modello sperimentale di idrope indotto nella cavia con la distruzione del sacco endolinfatico e il blocco del dotto vestibolare, si osserva una distensione progressiva della membrana di Reissner, come anche una debole riduzione della concentrazione di K+ e dell’osmolarità dell’endolinfa, nonché una riduzione
molto marcata del potenziale endococleare.
Stria vascolare
È stato stabilito con certezza che la stria vascolare è responsabile della secrezione di K+ nell’endolinfa. La stria vascolare forma un compartimento chiuso grazie alla presenza di giunzioni strette tra le cellule marginali da una parte e le cellule basali dall’altra, isolando così completamente i compartimenti endolinfatico e perilinfatico.
I trasportatori implicati nel trasporto di K+ sono stati per la maggior parte identificati e localizzati nelle diverse cellule che formano la stria vascolare (Fig. 3), e la loro attività è stata
convalidata in modelli di topi in cui alcuni geni sono stati alterati, in particolare i geni KCNJ10 , SLC12A2, KCNE1 e KCNQ1 .
Il K+ presente nel compartimento perilinfatico del legamento spirale entra nei fibrociti con una pompa Na+, K+-ATPasi (inibitore: uabaina) e penetra attraverso giunzioni comunicanti
nelle cellule basali della stria vascolare, poi nelle cellule intermedie. Il K+ è successivamente secreto nello spazio intrastriale. Una parte di questo trasporto si realizza attraverso i canali
Kir 4.1 (KCNJ10). Il K+ entra nel polo basolaterale delle cellule marginali con un Na+,K+-ATPasi di tipo a1, b2 e un cotrasporto Na-K-Cl (SLC12A2 o NKCC1 o BSC2, inibitore: bumetanide, furosemide). Il Cl- è riciclato verso lo spazio intrastriale attraverso i canali CLC-KA e CLC-KB. Mutazioni del gene che codifica per la barttina, una proteina regolatrice associata a questi canali Cl-, sono state riscontrate nella sindrome di Bartter di tipo IV associata a sordità di percezione. Al polo apicale delle cellule marginali, il K+ è secreto da un canale IsK/KvLQT1 (KCNE1/KCNQ1) (inibitori: clofilium; stimolatore: DIDS [4,4'-
diisothiocyano-2,2'-disulfonic acid stilbene]). Perché un tale dotto possa secernere K+ nell’endolinfa, bisogna che il gradiente elettrochimico di K+ sia favorevole alla dismissione del K+ dalla cellula verso l’endolinfa. Una tale ipotesi è resa possibile dall’osservazione di un potenziale di membrana nelle cellule marginali di 10 mV superiore al potenziale endococleare e di una composizione ionica intracellulare simile a quella dell’endolinfa. Nell’uomo, mutazioni di KCNQ1/KCNE1 sono responsabili della sindrome di Romano-Ward, o sindrome
del QT lungo, e sindrome di Jervell/Lange-Nielsen che associa una sindrome del QT lungo a una sordità neurosensoriale. Il potenziale endococleare sarebbe generato dalle cellule
intermedie, e più particolarmente dai canali K+ KCNJ10. In effetti, l’espressione di questo canale nel corso dello sviluppo è parallela alla formulazione del potenziale endococleare.
Inoltre, i topi che non hanno cellule intermedie o nelle quali questo canale è stato alterato hanno una concentrazione normale di K+, ma un potenziale endococleare vicino a 0.
Riciclaggio del K+
Il concetto di riciclaggio del K+ è stato ipotizzato in occasione della scoperta della rete estremamente sviluppata nella coclea delle giunzioni comunicanti (gap junctions). Queste giunzioni formano veri canali tra le cellule, permettendo la diffusione libera di piccole molecole (<1 000 Da), come i nutrienti, i secondi messaggeri e gli ioni. Sono formate da due emicanali chiamati «connessoni» e ogni connessone è costituito dall’assemblaggio omo- o eterotipico di sei proteine, le connessine. Il ruolo delle connessine nella fisiologia cocleare è stato oggetto di un certo numero di studi. In effetti, nell’uomo le mutazioni delle connessine 26 e 30 sono le più frequenti cause di sordità genetiche non sindromiche.
Il riciclaggio del K+ implica tappe che sono molto ben documentate sul piano sperimentale (organo del Corti, stria vascolare) e tappe più ipotetiche basate su dati da microscopia
e immunoistochimica (Fig. 4). Nell’organo del Corti le cellule ciliate sono la sede della
trasduzione meccanoelettrica, cioè della trasformazione delsegnale sonoro in influsso nervoso. Il flusso di K+ attraverso le cellule sensoriali è una fase determinante di questo processo, inducendo una depolarizzazione cellulare, un aumento della concentrazione di Ca2+, un rilascio di glutammato nello spazio sinaptico tra il polo basale della cellula sensoriale e la fibra afferente e una stimolazione della fibra afferente. Il K+ è eliminato al polo basolaterale della cellula ciliata. Il K+ sarebbe captato dalle cellule non sensoriali, in particolare del sulcus esterno. Questo circuito potrebbe permettere di attenuare le
variazioni della composizione di K+ risultante dalle fluttuazioni degli stimoli sonori. Il K+ presente nel polo basolaterale delle cellule ciliate può essere trasportato attraverso la rete delle giunzioni comunicanti, raggiungendo gli spazi perilinfatici del limbus spirale e del legamento spirale. Il K+ raggiungerebbe poi il compartimento endolinfatico attraverso le reti connettivali e le giunzioni comunicanti o attraverso il legamento spirale e la stria vascolare (cfr. Fig. 3) o attraverso le cellule interdentali (ID), raggiungendo così il compartimento endolinfatico.
Assorbimento di Na+
Mentre i meccanismi cellulari implicati nella secrezione di K+ sono stati molto studiati, pochi studi si sono interessati ai meccanismi di assorbimento di Na+ responsabile della concentrazione molto debole di questo ione nell’endolinfa. I trasportatori identificati sono il canale del sodio epiteliale (ENaC) e lo scambiatore Na+/H+. Le sedi preferenziali di assorbimento di Na+ sarebbero la membrana di Reissner e il sulcus esterno. Alcuni esperimenti di corrente di cortocircuito hanno messo in evidenza un trasporto di Na
inibito dagli analoghi dell’amiloride, in queste due strutture.
Nella stria vascolare il trasporto di Na+ è accoppiato a quello di K+ dalla Na+, K+-ATPasi e dal cotrasporto Na-K-Cl. Nell’uomo nessuna sordità è stata correlata a una mutazione dei canali del sodio. Tuttavia, mutazioni di TMPRSS3, una serina proteasi nota per attivare il canale ENaC e localizzata nella stria vascolare, le cellule di sostegno dell’organo del Corti e il ganglio spirale sono stati chiamati in causa nelle sordità autosomiche recessive DFNB8/10.
Trasporto dell’acqua
Il trasporto dell’acqua nella coclea è poco conosciuti. La questione principale è quella di far coesistere l’iperosmolarità dell’endolinfa in rapporto al plasma o alla perilinfa e l’osservazione
che la barriera epiteliale tra la perilinfa e l’endolinfa è circa 130 volte più permeabile all’acqua che al K+.
Negli epiteli assorbenti e secretori come il rene, il trasporto transepiteliali dell’acqua dipende dall’inserzione dei canali ad acqua, chiamati «aquaporine» (AQP), nella membrana cellulare.
Sono stati messi in evidenza diversi tipi di aquaporine (per immunoistochimica) nelle diverse strutture dell’orecchio interno. Le più abbondanti sono l’AQP-1 e la AQP-4, e la loro
espressione è largamente regolata nel corso dello sviluppo [34]. Nessun caso di sordità è ancora stato correlato, nell’uomo alla mutazione di un’aquaporina. Questa osservazione è sicuramente legata a una ridondanza delle diverse aquaporine presenti nell’orecchio interno. Bisogna sottolineare che i topi il cui gene che codifica l’AQP-4 è stato alterato sono sordi. Questa sordità è endococleare e riguarda tutte le frequenze. L’istologia della coclea è normale. La sede dell’AQP-4 nell’organo del Corti suggerisce un’anomalia della regolazione osmotica intracellulare delle cellule di sostegno, che rivestono un ruolo nel riciclaggio del K+.
Secrezione di endolinfa nel vestibolo
La differenza maggiore tra coclea e vestibolo riguarda il valore del potenziale endolinfatico. Le variazioni di ripartizione dei segmenti secretori (stria vascolare, cellule scure) e non secretori (membrana di Reissner, cellule epiteliali indifferenziate) potrebbero spiegare le differenze di composizione elettrochimiche dell’endolinfa osservate da un organo all’altro del sistema endolinfatico da una parte e, dall’altra, da una specie all’altra. Inoltre, l’organizzazione cellulare della stria vascolare, con tre tipi di cellule in serie, paragonata al sistema monostrato di cellule scure del vestibolo (otricolo e ampolle dei canali semicircolari), potrebbe essere responsabile della genesi del potenziale endococleare. Un argomento forte in favore di questa ipotesi è l’assenza di potenziale endococleare nei topi il cui gene
che codifica per il canale K+ delle cellule intermedie è stato alterato.
Ruolo del sacco endolinfatico
Il sacco endolinfatico, estensione endocranica del labirinto membranoso, è stato oggetto di numerosi lavori. Il suo ruolo nell’omeostasi dell’endolinfa è stato suggerito mettendo in evidenza, nell’animale, un’idrope endolinfatica in caso di sua distruzione. Nell’uomo, è generalmente ammesso che il sacco endolinfatico potrebbe intervenire come sistema di regolazione del volume dell’endolinfa, e si ipotizza una sua disfunzione nella comparsa della malattia di Ménière. La composizione del liquido intraluminale, intermedia tra endolinfa e perilinfa, la presenza di un potenziale transepiteliale positivo e di un gradiente di pH, come anche la struttura istologica delle cellule epiteliali, indicano che il sacco è sede di trasporti transepiteliali, trasporti che sono stati identificati sia sul piano molecolare sia su quello funzionale. A causa della sua dimensione e della sua localizzazione gli studi sperimentali sono difficili, ma è indiscutibile che questa struttura interviene nella regolazione del flusso di acqua e di elettroliti nei compartimenti del labirinto.
Regolazione dei trasporti idroelettrolitici nell’orecchio interno
Nell’orecchio interno sono stati studiati diversi sistemi di regolazione endocrina e paracrina.
Il primo enzima bersaglio di una regolazione ormonale è la Na+,K+-ATPasi. In effetti, si è visto da una parte il ruolo preponderante di questo enzima nella secrezione dell’endolinfa
e, dall’altra, esistono nelle cellule marginali recettori dei mineralcorticoidi, ormoni noti per stimolare la Na+,K+- ATPasi. Il ruolo di questi ormoni nell’orecchio interno non è
chiaro. Non sono state messe in evidenza modificazioni dell’udito e della composizione elettrochimica dei fluidi dell’orecchio interno in animali surrenalectomizzati. Inoltre, i
topi il cui gene che codifica per il recettore dei mineralcorticoidi è stato alterato non presentano anomalie della Na+,K+-ATPasi cocleare. Tuttavia, è stato dimostrato che l’aldosterone aumenta la frequenza della comparsa di idrope endolinfatica nelle cavie
il cui sacco endolinfatico è stato solo in parte distrutto. Questo risultato suggerisce che l’idrope endolinfatica possa essere il risultato della combinazione di un deficit parziale di
riassorbimento di endolinfa causata dal sacco endolinfatico e di un aumento della secrezione da parte della stria vascolare e/o delle cellule scure vestibolari. Il secondo sistema implicato nella regolazione della secrezione dell’endolinfa è il sistema ormone antidiuretico/ adenilciclasi/AQP-2. Una riduzione del volume plasmatico o un aumento dell’osmolarità plasmatica induce un aumento della concentrazione di ormone antidiuretico (AVP: arginina vasopressina): la stimolazione dei recettori V2 stimola la cascata adenilciclasi/adenosina monofosfato ciclica (AMPc), che stimola l’espressione dell’acido ribonucleico messaggero (ARNm) che codifica per l’AQP-2, così come il livello di inserimento membranario
delle AQP-2 già presenti nella cellula, permettendo così il riassorbimento dell’acqua secondo il gradiente osmotico. Nelle diverse parti dell’orecchio interno è stato possibile dimostrare le
varie tappe di questa cascata, suggerendo che l’AVP possa intervenire nella regolazione del volume e dell’osmolarità dell’endolinfa. L’aumento della pressione intralabirintica diminuisce la concentrazione di ormone in circolo, il che suggerisce, nell’orecchio interno, la presenza di volo- e/o barocettori la cui stimolazione modulerebbe la secrezione di ormone, che potrebbe localmente modificare la secrezione diendolinfa. In effetti, la somministrazione sistemica di AVP nella cavia riduce il potenziale endococleare [41] e induce la comparsa di un’idrope endolinfatica, mentre la somministrazione di antagonisti dei recettori V2 previene lo sviluppo di quest’idrope. Nei ratti Brattleboro, geneticamente privi di AVP, è stato dimostrato [44] che il gradiente longitudinale osmotico è abolito e che la somministrazione di ormone ricostituisce questo gradiente stimolando la secrezione di K+. Tuttavia, nell’uomo la relazione tra malattia di Ménière e concentrazione plasmatica di AVP rimane controversa.
Infine, altri mediatori potrebbero essere implicati nella regolazione dei fluidi dell’orecchio interno: si tratta delle prostaglandine, delle quali è stato possibile dimostrare una
sintesi locale, il fattore natriuretico, i cui recettori sono stati
identificati, e il platelet activating factor (PAF), che modifica il potenziale endococleare. Gli estrogeni (17bestradiolo) inibiscono in maniera acuta (probabilmente non genomica) la secrezione di K+ attraverso il canale KvLQT1 in un preparato di stria vascolare isolata [49]. In questa stessa struttura è stato dimostrato che il rilascio di K+ è rispettivamente
up-regolato e down-regolato attraverso i recettori b1-adrenergici e i recettori muscarinici M3 e M4. Localmente, l’adenosina trifosfato (ATP), i cui recettori sono stati identificati, potrebbe
avere un ruolo protettivo, in particolare al momento dei traumi sonori, riducendo il potenziale endococleare e, di conseguenza, la trasduzione meccanosensoriale a livello delle cellule ciliate, permettendo così un ripristino più rapido dell’udito [51].
La lista dei possibili regolatori della secrezione di endolinfa non è esaustiva ed è verosimile che altri fattori ormonali attivi nell’epitelio labirintico saranno messi in evidenza in un
prossimo futuro.
Conclusioni
I progressi nella caratterizzazione molecolare dei sistemi di trasporto idroelettrolitici implicati nella fisiologia dei fluidi dell’orecchio interno hanno permesso di comprendere meglio
alcune patologie, particolarmente nel campo delle sordità genetiche e della malattia di Ménière. In un secondo tempo, queste conoscenze dovrebbero permettere lo sviluppo di nuove terapie di sordità e vertigini legate ad anomalie di questi trasporti.