Fisiologia Udito
- Categoria: Fisiologia
- Pubblicato: Martedì, 27 Marzo 2012 15:37
- Visite: 48708
- Stampa
La fisiologia dell’udito include la fisiologia dell’orecchio esterno, medio e interno, nonché la fisiologia del sistema nervoso uditivo. Lo scopo di questo articolo è quello di dare al lettore una visione d’insieme sulle modalità con cui l’orecchio traduce il segnale acustico in un segnale organizzato di attività neurale che permette il trattamento centrale e la percezione uditiva. L’orecchio estrae l’informazione frequenziale, di intensità e temporale dallo stimolo sonoro. Tutte le connessioni centrali, che siano ascendenti o discendenti, permettono di moltiplicare le opportunità di convergenza e di divergenza dell’informazione sonora fino alla corteccia, di effettuare un trattamento del segnale in parallelo e/o in serie e di modulare
mediante feedback l’attività dei centri sottostanti.
La fisiologia del sistema uditivo è stata oggetto di progressi considerevoli da una ventina d’anni, non solo per quanto riguarda l’analisi della funzione dell’orecchio medio e della
coclea, ma anche dei centri uditivi. È stato possibile ottenere questi progressi importanti solo grazie allo sviluppo di numerose tecniche biologiche innovative e alla comparsa di modelli
complessi applicati ai centri nervosi. Questo nuovo articolo si propone di presentare uno stato dell’arte della fisiologia del sistema uditivo insistendo sulle sue novità, alcune delle quali hanno rivoluzionato le nostre conoscenze sulla funzione del sistema uditivo.
Fisiologia dell’orecchio esterno e dell’orecchio medio
- Orecchio esterno
L’orecchio esterno ha una doppia funzione: una funzione protettiva dell’orecchio medio e in modo particolare della membrana timpanica e, soprattutto, una funzione di amplificazione. L’orecchio esterno modifica la percezione del campo sonoro amplificando alcune frequenze, ma aumenta anche la direzionalità a causa della diffrazione delle onde sonore sull’insieme del volume cranico e dell’orecchio esterno, in particolare del padiglione uditivo.
Funzione di trasferimento dell’orecchio medio L’orecchio esterno modifica la fase e l’ampiezza del segnale sonoro incidente in funzione dell’angolo di incidenza e della frequenza del segnale sonoro. Queste alterazioni corrispondono alla funzione di trasferimento dell’orecchio esterno; ogni struttura anatomica contribuisce allo stabilirsi di questa funzione (Fig. 1 e 2). La Figura 1 rappresenta la funzione di trasferimento dell’orecchio esterno nell’uomo in funzione della frequenza del suono i ncidente e del suono azimut. La Figura 2 riporta l’amplificazione fornita nell’uomo dall’orecchio esterno per un azimut di 45° in funzione della frequenza del suono
ncidente e del suono azimut. La Figura 2 riporta l’amplificazione fornita nell’uomo dall’orecchio esterno per un azimut di 45° in funzione della frequenza del suono
incidente. L’amplificazione massima è dell’ordine di 20 dB per le frequenze comprese tra 2 e 3 kHz. Nell’uomo l’amplificazione di un suono la cui frequenza è compresa tra 2 e 6 kHz varia di circa 20 dB quando l’azimut è compreso tra – 90° e 90°. Si è potuto studiare il contributo di ogni elemento del volume corporeo e dell’orecchio esterno a questa funzione di trasferimento globale. Il volume corporeo (tronco, collo, testa)
induce un’amplificazione del suono di circa 10 dB con una debole selettività frequenziale. L’orecchietta (il padiglione nella vecchia denominazione anatomica) permette un’amplificazione con un guadagno inferiore a 10 dB per le frequenze comprese tra 5 e 6 kHz. Il meato acustico esterno e la membrana timpanica
kHz. Il meato acustico esterno e la membrana timpanica
interessano le frequenze vicine da 2 a 5 kHz. Localizzazione delle fonti sonore: ruolo
dell’orecchio esterno Lo studio della funzione di trasferimento della testa e dell’orecchio esterno si applica direttamente all’ascolto biauricolare e alla localizzazione tridimensionale delle sorgenti sonore (suono a tre dimensioni). Il principio consiste nel restituire, per mezzo di cuffie alle quali si applicano dei precisi segnali di fase e di pressione, un’impressione di volume sonoro. Tale tecnica è ampiamente utilizzata, in particolare nei cockpit degli aerei: un segnale sonoro che sembra provenire da una fonte precisa attira l’attenzione del pilota su una funzione difettosa. - Orecchio medio
Il ruolo principale dell’orecchio medio è quello di trasformare le vibrazioni sonore aeree che giungono alla membrana timpanica in variazioni di pressione nei compartimenti liquidi dell’orecchio interno (Fig. 3). Una tale trasformazione impone
di adattare l’impedenza tra l’ambiente esterno, aereo, e l’ambiente interno cocleare, liquido. L’orecchio medio ha anche un ruolo di protezione nei confronti dell’orecchio interno.
Funzione di trasferimento dell’orecchio medio e adattamento di impedenza
I modelli che permettono di analizzare le vibrazioni dell’orecchio medio sono relativamente complessi nella misura in cui devono integrare dei movimenti nelle tre dimensioni, di ampiezza microscopica, e sottoposti a una notevole variabilità
individuale e interspecie.
Spostamenti della membrana timpanica
Gli spostamenti del timpano sono stati studiati nell’animale con diverse tecniche: misurazione della pressione acustica all’interno dell’orecchio medio in presenza di uno stimolo acustico (misurazione dello spostamento volumetrico), misurazione diretta degli spostamenti del timpano per effetto Mössbauer, interferometria laser o interferometria olografica. Queste tecniche hanno permesso di mettere in evidenza il carattere microscopico degli spostamenti in causa. Lo spostamento medio della membrana timpanica per unità di pressione (per Pascal) varierebbe quindi da 1,2 a 10 × 10– 8 m. Khanna e Tonndorf hanno riscontrato nel gatto due zone del timpano che presentano un massimo di ampiezza delle vibrazioni da ogni lato del manico. I movimenti del martello stesso sembrano però essere di ampiezza meno grande rispetto a quelli della membrana timpanica. Questo modello sembra essere valido per frequenze inferiori a 6 kHz. Per frequenze superiori le zone di vibrazione del timpano sono multiple.
Spostamenti della catena degli ossicini
L’accoppiamento meccanico tra il timpano e il manico del martello fa sì che una forza che agisce sul timpano sia trasmessa al martello. Le modalità precise di questo accoppiamento sono tuttavia ancora in parte ignote. L’asse di rotazione degli ossicini
e di sospensione dei legamenti ossiculari coincide con il centro di inerzia rotazionale degli ossicini, creando così un fenomeno di leva. Più ci si allontana da questo asse di equilibrio, più lo spostamento della membrana timpanica è importante. Il rapporto di leva viene stimato con la misurazione del rapporto tra la distanza tra l’umbo e l’asse di rotazione e la distanza tra l’asse di rotazione e l’articolazione vocale incudostapediana. Più recentemente, Decraemer e Khanna [3] hanno dimostrato che l’asse di rotazione non è fisso ma che la sua posizione varia in funzione della frequenza, modificando di conseguenza il rapporto di leva, e che il movimento osservato non è soltanto un movimento di rotazione ma che esiste una componente di traslazione. La componente di rotazione è essenziale quando il sistema è stimolato a basse frequenze; ad alte frequenze la componente di traslazione sembra dominare sulla rotazione del blocco martello-incudine. Con tali conoscenze sui movimenti del martello, la semplice nozione di rapporto di leva della catena degli ossicini deve essere rivista. I movimenti della staffa
possono essere paragonati ai movimenti di un pistone che entra ed esce della finestra ovale.
Adattamento di impedenza dell’orecchio medio
Il ruolo del trasformatore di impedenza dell’orecchio medio consiste nel trasformare le vibrazioni con basse pressioni e grandi spostamenti dell’aria in vibrazioni ad alta energia con bassi spostamenti che permettono una conduzione nei liquidi del labirinto. I tre fattori che permettono questo meccanismo sono essenzialmente:
- il rapporto di superficie tra la membrana timpanica e il piatto della staffa: il rapporto di superficie è di circa 20-30. La forza applicata sulla membrana timpanica su una vasta
superficie è ritrasmessa sul piatto della staffa con un incremento della pressione proporzionale al rapporto delle superfici. Alcuni autori hanno stimato che una parte della membrana timpanica non giocava un ruolo attivo perché fissata all’anulus e hanno fissato quindi il rapporto delle superfici attive in 14/1;
- il braccio di leva della catena degli ossicini martello-incudine:
il manico del martello in proiezione appare più lungo del ramo discendente dell’incudine di un fattore 1,15-2,5. Lo spostamento trasmesso alla staffa dall’incudine è quindi
inferiore allo spostamento determinato dalla vibrazione sul martello;
- un terzo fattore più trascurabile si trova nella stessa membrana
timpanica. La risultante di questi tre fattori porta a un guadagno di un fattore 180. La trasmissione del suono tra un mezzo gassoso e un ambiente liquido senza adattamento di impedenza perderebbe più del 99% dell’energia acustica, che corrisponde a un’attenuazione sonora di circa 30 dB. Il meccanismo di trasformazione di impedenza che l’orecchio medio esercita nell’uomo permetterebbe di trasmettere fino ai
due terzi dell’energia in direzione della coclea.
Funzione di trasferimento dell’orecchio medio
L’adattamento di impedenza esercitata dall’orecchio medio non è omogeneo su tutte le frequenze (Fig. 3). Nedzelnitsky ha mostrato un picco di trasmissione nel gatto attorno a 1 kHz. La trasmissione è meno efficace sulle frequenze più basse e più alte. Risultati simili vengono ottenuti con delle rocche umane. I fattori che interessano le basse e le alte frequenze sono tuttavia probabilmente diversi, poiché la membrana timpanica
e particolarmente la sua elasticità svolgono un ruolo importante sulle basse frequenze, mentre sulle alte frequenze la messa in gioco dei risonatori dell’orecchio medio appare predominante. L’impedenza di ingresso dell’orecchio interno è definita dal
rapporto tra la pressione acustica nella rampa vestibolare in corrispondenza del piatto della staffa e il volume di perilinfa spostato da questo piatto per unità di tempo.
I movimenti del piatto della staffa non sono solo limitati dall’inerzia della perilinfa, ma dipendono anche dalla compliance della membrana basilare. L’impedenza di ingresso dell’orecchio interno è di tipo resistivo, cosa che determina due conseguenze: tutta l’energia acustica incidente viene dissipata nella coclea e le risonanze che si verificano nell’orecchio medio vengono attutite.
Funzione di protezione dell’orecchio interno
La funzione di protezione è esercitata essenzialmente dai muscoli dell’orecchio medio. Il muscolo del martello o tensore del timpano si inserisce sul manico del martello. La sua contrazione spinge il martello anteriormente e medialmente. Il secondo muscolo è il muscolo stapedio, che si inserisce nella parte posteriore della staffa e la cui contrazione tira la staffa posteriormente. La contrazione di questi due muscoli determina un aumento di rigidità della catena degli ossicini. I meccanismi fisiologici di contrazione riflessa del muscolo del martello sono meno noti rispetto a quelli del muscolo stapedio, e spesso per riflesso acustico si intende il solo riflesso dello stapedio.
L’effetto del riflesso acustico è particolarmente netto sulle basse frequenze, determinando una riduzione dell’ordine di 15 dB nel ratto. Altri studi hanno descritto delle attenuazioni molto più basse dell’ordine di 2 dB per intensità di 20 dB al di sopra della soglia di riflesso, particolarmente per frequenze acute. I muscoli dell’orecchio medio si contraggono in risposta a suoni di intensità superiore a 80 dB. L’arco riflesso corrispondente è polisinaptico e passa per il tronco cerebrale. Poiché il muscolo della staffa è innervato dal nervo facciale, l’arco riflesso corrispondente costituisce un circuito acusticofacciale che passa per il nucleo cocleare ventrale e il nucleo del nervo facciale. Il muscolo del martello invece, innervato dal nervo trigemino, è coinvolto in un arco riflesso acusticotrigeminale. Sono state descritte delle vie multisinaptiche di più lunga latenza che seguono la sostanza reticolare.
Il tempo di reazione di questi riflessi acustici è limitato dal tempo sinaptico di ogni relè. La latenza del riflesso stapediano o del muscolo del martello è quindi di almeno 7-10 ms, dipendendo dall’intensità del suono incidente. Questo riflesso può rivestire un ruolo protettivo dell’orecchio medio in caso di impulso sonoro troppo forte con, tuttavia, un effetto limitato dal tempo di reazione, dalla scarsa attenuazione e dai fenomeni di affaticabilità. Il secondo effetto del riflesso acustico sarebbe quello di aumentare la selettività frequenziale con, in particolare, un’attenuazione maggiore delle basse frequenze. Ciò può influenzare, per esempio, la comprensione dei suoni complessi
come la parola nel rumore.
? Fisiologia dell’orecchio interno e del nervo uditivo
Le nostre conoscenze sulla fisiologia della coclea sono state rivoluzionate da una quindicina d’anni; il sistema uditivo periferico dell’inizio del XXI secolo non ha niente a che vedere con quello degli anni Ottanta. Questi sconvolgimenti sono dovuti allo sviluppo di nuove tecniche di ricerca in neurofisiologia così come in biologia cellulare e molecolare. Basi morfologiche della coclea La coclea è ricoperta da una parete ossea, la capsula otica. Questa è formata da tre rampe avvolte a spirale intorno a un asse osseo che porta il nome di modiolo (Fig. 4, 5). Le rampe vestibolari e timpaniche sono piene di perilinfa e formano il compartimento perilinfatico. Queste due rampe comunicano tra di loro nella parte più apicale della spirale cocleare attraverso un orifizio denominato elicotrema. Le rampe vestibolari e timpaniche sono isolate dall’orecchio medio nella parte più basale della spirale cocleare dalla finestra ovale e dalla finestra rotonda. La coclea permette la circolazione delle onde di pressione generate dai suoni. La porta d’ingresso del segnale acustico è la finestra ovale, sulla quale è legato il piatto della staffa. L’onda di pressione si diffonde lungo la spirale formata dall’organo del Corti. Essendo i liquidi indeformabili, l’aumento di pressione prodotto viene eliminato attraverso la finestra rotonda. Le rampe vestibolari e timpaniche circondano il canale cocleare pieno di endolinfa. Il canale cocleare è delimitato dalla membrana di Reissner, dalla stria vascolare e dall’organo del Corti, sede della meccanotrasduzione. La perilinfa e l’endolinfa differiscono profondamente per il loro contenuto ionico. Mentre la perilinfa ha una composizione molto vicina ai liquidi extracellulari e al liquido cefalorachidiano, l’endolinfa è caratterizzata da un’estrema ricchezza di potassio. Questa differenza nella composizione ionica dei due fluidi cocleari si traduce con la presenza di un potenziale endolinfatico, chiamato potenziale endococleare, situato a circa +80 mV. L’organo del Corti poggia sulla membrana basilare e si avvolge dalla base all’apice della spirale cocleare (Fig. 5). Esso è composto da cellule sensoriali, le cellule ciliate, da fibre nervose, da cellule di sostegno e da cellule annesse non sensoriali (Fig. 6).


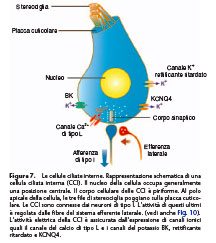
La trasduzione delle informazioni meccaniche in segnali elettrochimici è assicurata dalle cellule sensoriali. Queste ultime sono ricoperte al loro polo apicale da tre file di stereociglia, alle quali devono il loro nome di cellule ciliate (Fig. 7, 8). Esistono due tipi di cellule ciliate, disposte da una parte e dall’altra del tunnel di Corti: le cellule ciliate esterne (CCE) e le cellule ciliate interne (CCI). Le CCE hanno il ruolo di amplificare l’onda sonora e le CCI quello di tradurre l’informazione sonora in messaggio nervoso. Mentre le stereociglia delle cellule ciliate nuotano nell’endolinfa, il loro corpo cellulare è localizzato nel compartimento perilinfatico (Fig. 6). Le stereociglia, costituite soprattutto da actina, sono in numero di un centinaio per cellula ciliata e sono disposte su tre file. Esse sono collegate tra loro da numerosi legami trasversali e da legami terminali (tiplinks). Questi ultimi hanno una struttura a doppia elica e sono costituiti dalla combinazione di diverse caderine 23. Le
stereociglia più lunghe delle CCE sono ancorate in una struttura amorfa che ricopre l’organo del Corti, la membrana tectoria. Quest’ultima è composta da fibre collagene e da proteine come la a - e b -tectorina e l’otogelina.
Cellule ciliate esterne
Le cellule ciliate esterne, localizzate sul bordo esterno della spirale cocleare, sono organizzate in tre file e sono in numero di circa 13.000 per coclea nell’uomo. Da un punto di vista
morfologico le CCE hanno una forma perfettamente cilindrica e la loro lunghezza cresce regolarmente dalla base all’apice della coclea. Le loro stereociglia sono disposte a W sulla loro placca cuticolare. La rigidità delle stereociglia varia dalla base all’apice in un rapporto di circa 1 a 10 per la prima fila e di circa 1 a 40 per la terza fila. Questa rigidità dipende dal senso di
deflessione delle ciglia: è più alta per una deflessione verso l’esterno rispetto all’asse della coclea. Queste misure permettono di valutare la frequenza di risonanza delle ciglia delle CCE,
tenendo conto del loro accoppiamento con la membrana tectoria. Questa frequenza di risonanza varia dalla base della coclea al suo apice di un fattore 20 nella gamma delle frequenze udibili, ossia di 1,2-22 kHz nella cavia. Questa rigidità delle stereociglia è molto sensibile ai traumi sonori. Dopo una stimolazione sonora rilevante una restitutio ad integrum della funzione ciliare è possibile entro limiti ragionevoli quando la funzione cellulare è normale. Le CCE sono separate lateralmente tra di loro dagli spazi di Nuel. Sono in contatto con le cellule di Deiters soltanto al loro polo apicale e basale. Il polo apicale delle CCE e l’estremità delle falangi di Deiters formano la lamina reticolare, un mosaico
perfettamente adeso all’endolinfa. La parete laterale è tappezzata da un complesso di cisterne laterali e di mitocondri. Il nucleo delle CCE è localizzato alla base delle cellule, appena al di sopra del compartimento sinaptico che racchiude molti mitocondri.
Vi sono pochi dati sulla registrazione elettrica delle CCE in vivo poiché il posizionamento e il mantenimento di un microelettrodo intracellulare sono difficili. Queste difficoltà sono dovute alla scarsa fissità delle CCE nello spazio di Nuel, alla motilità delle CCE, alle loro piccole dimensioni e alla resistenza alla penetrazione della loro parete laterale. Nella cavia la parte essenziale delle registrazioni è stata effettuata nel terzo giro cocleare. Il potenziale a riposo intracellulare è negativo, compreso tra –53 mV e –70 mV dall’apice alla base. Sotto
l’influenza di una stimolazione sonora le deflessioni posteriori delle stereociglia in un senso e poi nell’altro creano delle serie di depolarizzazione (inclinazione delle ciglia verso l’esterno) e di iperpolarizzazione (inclinazione delle ciglia verso l’interno). In risposta a uno stimolo sonoro, è dunque possibile registrare due componenti elettriche sovrapposte (Fig. 9): una componente continua che riproduce l’aspetto dello stimolo acustico e una componente alternata che riproduce la sua frequenza. La componente continua è il più delle volte positiva, con una conseguente depolarizzazione per la CCE, salvo che per le frequenze inferiori alla frequenza tipica della cellula alla quale la cellula si iperpolarizza. Sembra esistano importanti variazioni delle proprietà elettriche delle CCE in funzione della loro posizione sulla membrana basilare. Le CCE della base nonsembrano quindi avere risposta elettrica continua (frequenza tipica prossima a 20 kHz nella cavia), che è invece presente nelle CCE delle regioni più apicali. Le CCE presentano una selettività frequenziale molto elevata. Dallos ha potuto registrare delle curve di accordo (curve di risposte isoelettriche) delle CCE dell’apice che mostrano una frequenza caratteristica ma ben determinata degli indici di selettività, che sembravano un po’ meno efficaci di quelli osservati nelle CCI della base della coclea.
Cellule ciliate interne
Le CCI si distinguono dalle CCE per la forma a pera del loro corpo cellulare (Fig. 7). Le CCI, in numero di 3 500 per coclea, sono situate sul bordo interno dell’organo del Corti e sono
organizzate su una singola fila. Contrariamente alle CCE, le stereociglia sono disposte in linea e non sono ancorate alla membrana tectoria. Il nucleo è in posizione mediana e la
membrana plasmatica laterale è classica. Anche se tre volte meno numerose delle CCE, le CCI sono le vere e proprie cellule sensoriali. Esse assicurano allo stesso tempo la trasduzione
della vibrazione meccanica in segnale elettrico e il trasferimento dell’informazione mediante la liberazione di neurotrasmettitore sulle fibre del nervo uditivo. Le zone attive
delle CCI sono caratterizzate dalla presenza di una struttura densa agli elettroni denominata bastoncino (Fig. 10). Questi corpi sinaptici sono ancorati alla membrana plasmatica e
circondati da vescicole sinaptiche, le quali contengono il neurotrasmettitore delle CCI. Fino a oggi, RIM, Ribeye, KIF3A, Bassoon e Piccolo sono state le sole proteine associate ai
bastoncini delle cellule sensoriali. Generalmente vi è un solo bastoncino per zona attiva e una decina di zone attive per CCI. Ogni zona attiva è connessa mediante la terminazione di una singola fibra del nervo uditivo.
La prima registrazione delle cellule ciliate interne è stata eseguita da Russel e Sellick. Queste cellule presentano un potenziale di riposo negativo di –40 mV alla base e di –32 mV all’apice. Quando la cellula è stimolata da un suono, presenta una risposta elettrica a due componenti. La componente continua riproduce lo sviluppo dello stimolo acustico mentre la
componente alternata ne segue la frequenza. Ogni CCI ha una risposta elettrofisiologica molto dipendente dalla frequenza del suono che stimola. È possibile tracciare delle curve isoelettriche (intensità di stimolazione necessaria per ottenere una risposta della cellula di una data ampiezza secondo la frequenza di stimolazione) che presentano una selettività in frequenza molto forte, sia che la misura venga eseguita sulla componente continua o sulla componente alternata della risposta. Queste
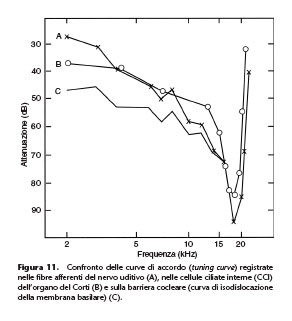
curve di accordo sono paragonabili sia a quelle ottenute studiando lo spostamento puramente meccanico della membrana basilare (sulla quale poggia l’organo del Corti) nel punto dove poggia la CCI che a quelle ottenute studiando l’attività unitaria delle fibre afferenti che nascono sotto la cellula ciliata interna studiata (Fig. 11).
Innervazione dell’organo del Corti
L’organo del Corti riceve una doppia innervazione, allo stesso tempo afferente ed efferente (Fig. 12). L’innervazione afferente ha origine dai neuroni di tipo I e II del ganglio spirale, i cui assoni proiettano verso i nuclei cocleari. L’innervazione efferente ha origine da neuroni che appartengono a due distinti sistemi i cui corpi cellulari si localizzano nei nuclei del tronco
cerebrale. Il prolungamento assonale dell’insieme di questi neuroni costituisce il nervo cocleare.
Innervazione afferente
L’innervazione afferente dell’organo del Corti ha origine dai neuroni uditivi primari, i cui corpi cellulari sono situati a livello del ganglio spirale. Quest’ultimo è situato nell’asse della coclea
(modiolo). I neuroni uditivi primari sono neuroni bipolari. Questi sono di due tipi, chiamati neuroni gangliari di tipo I e neuroni gangliari di tipo II. I loro prolungamenti periferici
terminano nell’organo del Corti, a contatto con le cellule ciliate, e il loro prolungamento centrale termina nei nuclei cocleari del tronco cerebrale.



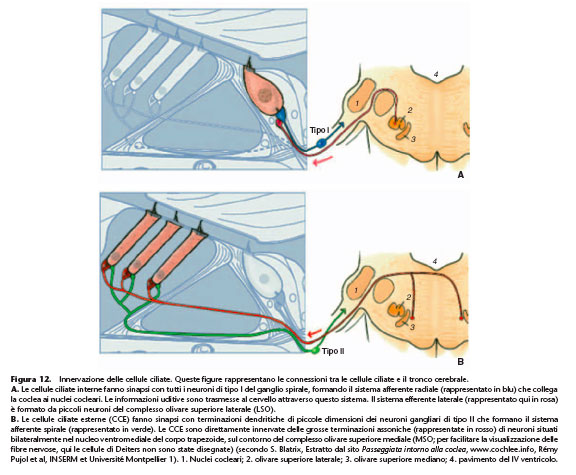 L’innervazione afferente delle CCI è assicurata da neuroni gangliari di tipo I (Fig. 12). I neuroni di tipo I rappresentano il 95% della popolazione neuronale del ganglio spirale. Sono dei neuroni mielinici di grandi dimensioni, raggruppati intorno al soma. Essi possiedono una branca periferica unica, anch’essa mielinizzata fino all’ingresso dell’organo del Corti, che proietta verso le CCI e si connette mediante un singolo bottone dendritico a una sola CCI. Parecchi neuroni di tipo I vanno a contattare una stessa CCI (in media una decina per CCI).
L’innervazione afferente delle CCI è assicurata da neuroni gangliari di tipo I (Fig. 12). I neuroni di tipo I rappresentano il 95% della popolazione neuronale del ganglio spirale. Sono dei neuroni mielinici di grandi dimensioni, raggruppati intorno al soma. Essi possiedono una branca periferica unica, anch’essa mielinizzata fino all’ingresso dell’organo del Corti, che proietta verso le CCI e si connette mediante un singolo bottone dendritico a una sola CCI. Parecchi neuroni di tipo I vanno a contattare una stessa CCI (in media una decina per CCI).
Nell’uomo esistono quindi circa 30 000 neuroni di tipo I per 3 500 CCI.
Il neurotrasmettitore utilizzato dalle CCI è il glutammato. Il glutammato è un aminoacido eccitatorio utilizzato dalla grande maggioranza delle sinapsi del sistema nervoso centrale.
La sua liberazione eccessiva può tuttavia diventare tossica (fenomeno di eccitotossicità). In questo caso i recettori postsinaptici si trovano sovrastimolati, provocando un flusso ionico
molto importante nella cellula, seguito da un ingresso massivo di acqua per fenomeno osmotico. La terminazione sinaptica si rigonfia e quindi scoppia. I neuroni gangliari di tipo I hanno però la capacità di formare dei nuovi prolungamenti e di ristabilire delle sinapsi funzionali con le CCI dopo uno shock eccitotossico. L’innervazione afferente delle CCE è assicurata da neuroni gangliari di tipo II (Fig. 12). Questi ultimi rappresentano una
popolazione minoritaria in seno al ganglio spirale: essi costituiscono
in effetti appena il 5% della popolazione neuronale di questa struttura. I neuroni di tipo II sono più piccoli dei neuroni di tipo I e, contrariamente a questi ultimi, non sono
mielinizzati. Il prolungamento periferico di questi neuroni è ramificato. Ogni neurone di tipo II va così a stabilire delle sinapsi con una decina di CCE diverse, che appartengono
generalmente alla stessa fila. La natura del neurotrasmettitore utilizzato da queste sinapsi e il ruolo di questo sistema afferente sono attualmente sconosciuti. In effetti, i neuroni di tipo II non sembrano rispondere agli stimoli sonori a forte intensità. Innervazione efferente La coclea è un organo controllato dai centri superiori. Le cellule ciliate ricevono un’innervazione massiva da parte dei due sistemi efferenti, i cui corpi cellulari originano dall’oliva
bulbare. Il sistema efferente mediano innerva direttamente le CCE, mentre il sistema efferente laterale innerva i dendriti delle fibre di tipo I del nervo uditivo. L’innervazione efferente dei dendriti dei neuroni di tipo I è assicurata dal sistema olivococleare efferente laterale (Fig. 12). I neuroni originano dall’oliva superiore laterale situata nel tronco cerebrale. Le fibre del sistema efferente laterale contattano direttamente i dendriti dei neuroni di tipo I del nervo uditivo, appena sotto il bottone sinaptico formato con la CCI (Fig. 10). Il sistema efferente laterale utilizza diversi neurotrasmettitori tra cui l’acetilcolina, l’acido gamma-aminobutirrico (GABA), la dopamina e dei neuromodulatori, il Calcitonine Gene-Related
Peptide (CGRP), le encefaline e le dinorfine. Pochi sono i dati attualmente disponibili sul ruolo fisiologico di questo sistema. La dopamina liberata dal sistema efferente laterale rappresenta un adattatore di guadagno che permette di adattare la soglia e la dinamica di risposta delle fibre in funzione del segnale di entrata. L’applicazione intracocleare di dopamina provoca una riduzione dell’attività spontanea delle fibre del nervo uditivo e un aumento della soglia di risposta alla stimolazione sonora. La dopamina riveste quindi un ruolo inibitore sulle attività dei neuroni uditivi primari. L’applicazione di antagonisti della dopamina provoca invece un aumento dell’attività spontanea dei neuroni uditivi primari e un miglioramento della sensibilità alla soglia. L’aumento dell’attività spontanea riflette probabilmente una rimozione di inibizione tonica a livello del sito d’inizio del messaggio uditivo. Se questi risultati dimostrano che l’attività delle fibre del nervo uditivo è dipendente dalla liberazione tonica di dopamina da parte del sistema efferente laterale, lavori recenti suggeriscono che l’attività secretrice delle diverse zone attive di una CCI può anche contribuire alle differenze di attività spontanee delle fibre che innervano la CCI. L’innervazione efferente delle CCE è assicurata dal sistema olivococleare efferente mediano (Fig. 12) , così chiamato per la presenza dei corpi cellulari dei neuroni nel nucleo mediodorsale del corpo trapezoide, sul contorno del complesso olivare superiore mediano. Il contatto tra le CCE e i neuroni del sistema efferente mediano avviene con l’intermediazione di grosse terminazioni assoniche. Il neurotrasmettitore utilizzato dal sistema efferente mediano è l’acetilcolina. L’acetilcolina, liberata dal sistema efferente mediano, attiva dei recettori nicotinici a 9 e a 10. Queste sub-unità nicotiniche conferiscono ai recettori nicotinici delle CCE un profilo farmacologico determinato: questi recettori sono bloccati dalla stricnina (antagonista glicinergico), dalla bicucullina (antagonista
gabaergico) e dalla nicotina e la muscarina. L’attivazione dell’ a9-10 da parte dell’acetilcolina determina l’ingresso di calcio, che a sua volta attiva dei canali per il potassio sensibili
al calcio SK. Questi ultimi assicurano l’uscita del potassio e, di conseguenza, provocano l’iperpolarizzazione delle CCE (Fig. 8). Controllando il potenziale di membrana delle CCE, il sistema efferente mediano modula dunque l’attività di queste cellule, il cui ruolo principale è quello di amplificare l’intensità delle onde sonore. La riduzione del guadagno dell’amplificatore cocleare permette al sistema efferente mediano di assicurare una protezione alle alte intensità di stimolazione. Notiamo così che il sistema efferente mediano è attivato anche in caso di processo di attenzione selettiva, che siaesso visivo o uditivo. Questo sistema è fortemente inibito dall’anestesia. Basi funzionali della coclea Selettività frequenziale cocleare
Nella coclea l’onda di pressione generata da un suono si diffonde lungo la membrana basilare dalla base all’apice della coclea. La vibrazione raggiunge la sua ampiezza massima in un
punto preciso, tanto più vicino all’apice quanto più la frequenza di stimolazione è grave. Questa tonotopia cocleare è valsa nel 1962 il premio Nobel per la medicina a Georg von Bekesy. Questa particolarità, dovuta alle proprietà strutturali e meccaniche della membrana basilare, è all’origine dell’analisi frequenziale dei suoni che arrivano alla coclea. Se questa tonotopia passiva permette di spiegare un primo livello di codificazione delle frequenze, questa codificazione è poco selettiva e non basta a spiegare il grado considerevole di sensibilità e di
selettività frequenziale della coclea. Di fatto, l’organo del Corti deve la sua sensibilità e la sua
selettività in frequenza alla presenza di meccanismi attivi endococleari. Gold, astrofisico inglese, fu il primo nel 1948 a realizzare un modello di coclea che comprendeva non solo le cellule trasduttrici classiche ma anche delle cellule in grado di produrre energia meccanica. La scoperta nel 1978 del fenomeno dell’otoemissione acustica da parte di David Kemp
ha permesso di rilanciare questa teoria e ha portato alla nozione attuale della fisiologia cocleare. Questi ultimi trovano la loro origine nelle proprietà elettromotrici delle CCE. In effetti le CCE si accorciano in risposta a una depolarizzazione e, viceversa, si allungano in risposta a un’iperpolarizzazione. Questi cambiamenti di dimensioni possono raggiungere
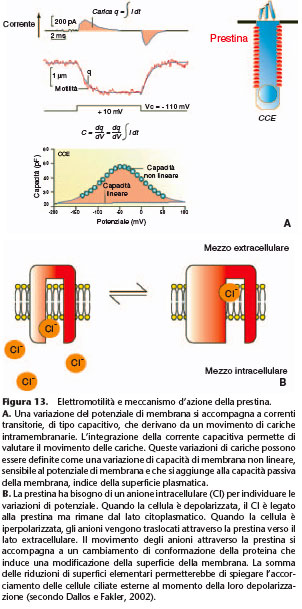
fino al 4% della lunghezza delle CCE e possono seguire delle frequenze di stimolazione compatibili con le frequenze udibili. La persistenza dell’elettromotilità dopo digestione delle reti citoscheletriche sotto-membranarie, con dialisi intracellulare di tripsina mostra che gli elementi motori responsabili dell’elettromotilità risiedono nella membrana plasmatica stessa. Un segno dell’elettromotilità è la capacità non lineare delle CCE. Questa riflette i movimenti di carico del motore in risposta a un cambiamento di potenziale transmembranario. La curva che esprime questa capacità della membrana in funzione del potenziale transmembranario
prende una caratteristica forma a campana (Fig. 13). L’identificazione della proteina prestina da parte dell’equipe del professor Dallos ha permesso di scoprire la natura del motore
molecolare all’origine dell’elettromotilità. In effetti, l’espressione della prestina in alcuni sistemi eterologhi provoca un cambiamento di lunghezza delle cellule in risposta a un salto di
potenziale e conferisce loro una capacità non lineare paragonabile
a quella delle CCE. [38] Diversamente dai canali ionici sensibili al potenziale, l’individuazione del potenziale transmembranario non è una proprietà intrinseca della prestina, ma è assicurata dagli ioni Cl– intracellulari. [39] L’assenza di ioni Cl– intracellulari abolisce in maniera reversibile la capacità membranaria non lineare. La fissazione di ioni Cl– alla prestina
e la loro traslocazione verso il lato citosolico o verso quello esterno della proteina, secondo il potenziale transmembranario, sarebbero responsabili di un cambiamento di conformazione
della proteina, modificando così la superficie della membrana (Fig. 13). Da notare che nei ratti l’invalidazione del gene prestina provoca una perdita di udito di 50 dB , ossia il guadagno
concesso dai meccanismi attivi, e una perdita della selettività in frequenza. Infine, una manifestazione in vivo dei meccanismi attivi è la presenza delle otoemissioni acustiche. Queste otoemissioni acustiche, testimoni dell’attività delle CCE, sono assenti nel topo prestina –/–. La doppia trasduzione meccanoelettrica ed elettromeccanica all’origine dei meccanismi attivi sottintesi dalle CCE può essere riassunta con la Figura 14. Le CCE sono strettamente accordate sulla frequenza da rilevare. Alle basse intensità di stimolazione acustica esse si
contraggono in fase con gli spostamenti della membrana, aumentando così considerevolmente (di un fattore 100 circa) gli spostamenti delle strutture che provocano la stimolazione delle CCI. Se la prestina conferisce alla coclea la sua sensibilità e la sua selettività in frequenza, anche un fenomeno di inibizione laterale associata a elettromotilità delle CCE può prendere parte alla selettività in frequenza. In effetti, la contrazione di una CCE
in risposta a un salto di potenziale depolarizzante determina l’iperpolarizzazione della CCE vicina e, di conseguenza, il suo allungamento. Dal lato delle CCI il numero di sinapsi varia in funzione della posizione sulla membrana basilare. Si riscontrano in effetti maggiori contatti sinaptici tra le CCI e i neuroni gangliari di tipo I nella regione più sensibile in frequenza. Citiamo l’esempio della «fovea» della coclea del pipistrello, nella quale si contano fino a 50 bottoni sinaptici per CCI. Trasduzione: le cellule ciliate interne La trasduzione dell’informazione meccanica in segnale elettrochimico può essere riassunta in cinque fasi.
Propagazione dell’onda meccanica nei fluidi cocleari. La vibrazione sonora trasmessa alla perilinfa dalla catena degli ossicini fa ondulare la membrana basilare dall’alto verso il basso. L’onda meccanica si diffonde lungo la membrana basilare con un picco massimo di ampiezza localizzato tanto più vicino alla base quanto più la frequenza è acuta (tonotopia passiva).
 Questo spostamento, qualificato come passivo, è quello scoperto da Georg von Bekesy all’inizio degli anni Sessanta.
Questo spostamento, qualificato come passivo, è quello scoperto da Georg von Bekesy all’inizio degli anni Sessanta.
Stimolazione delle CCE
Il movimento di taglio della membrana tectoria provoca la deflessione delle stereociglia delle CCE, impiantate nella
membrana tectoria stessa. La deflessione di queste stereociglia determina la deflessione dell’insieme delle stereociglia grazie ai tip-links e ai legami trasversali. Il movimento delle stereociglia favorisce l’apertura dei canali cationici non specifici situati ad ogni estremità delle stereociglia. Questi canali, che appartengono probabilmente alla famiglia dei canali TRP (Transient Receptor Potential), lasciano entrare il potassio dell’endolinfa nelle CCE. Questa è una trasduzione meccanoelettrica. Messa in gioco dei meccanismi attivi Le CCE, depolarizzate dall’ingresso di potassio, si contraggono.
Questa contrazione modifica l’accoppiamento tra la membrana basilare e la membrana tectoria e amplifica localmente le vibrazioni della membrana basilare grazie ai meccanismi attivi, permettendo l’acquisizione di una tonotopia molto sottile. Questa è una trasduzione elettromeccanica. Il funzionamento della CCE si basa quindi su una doppia trasduzione meccanoelettrica e poi elettromeccanica (Fig. 14). Stimolazione delle CCI Analogamente alla CCE, la CCI che corrisponde alla frequenza
di stimolazione è attivata in risposta alla deflessione delle sue stereociglia. A differenza delle CCE le stereociglia delle
CCI, più grandi, non sono ancorate alla membrana tectoria: la deflessione delle stereociglia delle CCI è favorita dal contatto diretto con la banda di Hensen della membrana tectoria.
L’apertura dei canali meccanosensibili determina l’ingresso di potassio e conseguentemente depolarizza la CCI. Liberazione del neurotrasmettitore La depolarizzazione della CCI causa l’apertura dei canali del calcio sensibili al potenziale di tipo L. [48] L’afflusso di calcio
provoca la fusione delle vescicole sinaptiche alla membrana plasmatica. L’insieme delle vescicole sinaptiche delle CCI si divide in due popolazioni distinte. [49] Il primo contingente di
vescicole a fondersi è denominato RRP (Readily Releasable Pool) e corrisponde alle vescicole sinaptiche situate in prossimità dei canali del calcio. Il secondo contingente, chiamato SRP (Slowly Releasable Pool), è più lontano dai canali del calcio. Data la loro localizzazione, le vescicole del RRP si fonderanno prima di quelle del SRP (Fig. 10). La secrezione sinaptica mobilizza in parte le vescicole situate sulla faccia inferiore dei corpi sinaptici e risulta da una liberazione multivescicolare. Se l’esocitosi delle CCI è fortemente dipendente dal calcio, la
proteina sensibile al calcio e responsabile della fusione vescicolare resta ancora indeterminata. Una candidata può essere l’otoferlina, che presenta 6 domini C2, la cui funzione è quella
di legare i fosfolipidi in presenza di ioni calcio. Il neurotrasmettitore delle CCI, il glutammato, liberato nella fessura sinaptica, attiva quindi i recettori AMPA presenti sulle fibre del
nervo uditivo. Le cinetiche di attivazione e di desensibilizzazione di questi recettori sono molto rapide, il che permette una risposta delle fibre del nervo uditivo appropriato allo stimolo acustico. Un messaggio nervoso sarà allora veicolato dai neuroni uditivi di tipo I e inviato verso il sistema nervoso centrale.
Potenziali globali della coclea
La conoscenza delle proprietà elettrofisiologiche unitarie delle CCE ha permesso di comprendere meglio la fisiologia dei potenziali cocleari globali, conosciuti da quasi 60 anni. Questi potenziali globali corrispondono effettivamente alla somma delle attività unitarie delle cellule cocleari. Si possono registrare con un macroelettrodo posto sul promontorio (nell’uomo
con elettrococleografia) o con un elettrodo inserito nelle rampe timpanica e vestibolare della coclea. Questi potenziali complessivi provengono da un gran numero di cellule distanti
dal luogo di registrazione, a volte di un giro di spirale. Per migliorare la qualità delle registrazioni Tasaki et al. hanno sviluppato una tecnica di registrazione con elettrodi differenziali dove i due elettrodi sono collocati nelle rampe timpanica e vestibolare opposte, al fine di effettuare la differenza tra le tensioni raccolte. Questo metodo permette di eliminare i
segnali in fase sui due elettrodi che provengono da regioni lontane, così come il potenziale d’azione composito del nervo cocleare. In questo modo si registra soltanto l’attività di un
centinaio di cellule in linea di principio situate tutte nello stesso giro cocleare. L’eccitazione di tutte le cellule non è sincrona a causa degli intervalli di propagazione: questo impone di calcolare la media temporale di diverse risposte unitarie. Il segnale raccolto è complesso; esso comprende le risposte elettriche delle cellule ciliate con una componente alternata e una componente continua. La risposta alternata è il potenziale microfonico cocleare; esso riproduce la frequenza del suono che funge da stimolo.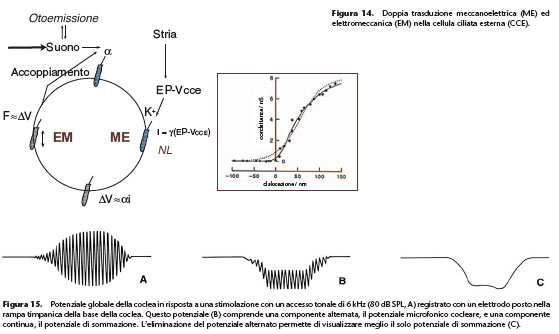 Questo potenziale microfonico è prodotto essenzialmente dalle CCE. Esso è proporzionale
Questo potenziale microfonico è prodotto essenzialmente dalle CCE. Esso è proporzionale
all’ampiezza degli spostamenti di una zona ridotta di setto cocleare, ma questa relazione è valida solo per le frequenze inferiori alla frequenza tipica di questa zona. Il potenziale microfonico cocleare può essere utilizzato come indice a bassa frequenza dello stato dei processi di trasduzione meccanoelettrica nella coclea basale. La risposta continua è il
potenziale di sommazione (Fig. 15). Anche questo è prodotto dalle CCE. La sua ampiezza dipende da molti fattori: intensità e frequenza del suono stimolatore, livello di registrazione nella coclea. Le sue proprietà sono complesse.
Otoemissioni acustiche cocleari
David Kemp fu il primo a pubblicare l’osservazione di un’emissione acustica cocleare nel 1978. Le emissioni acustiche cocleari sono dei suoni emessi dall’orecchio e registrabili nel meato acustico esterno in maniera non traumatizzante. Esistono diversi tipi di emissioni: le otoemissioni spontanee registrabili nel meato acustico esterno al di fuori di ogni
stimolazione sonora, le otoemissioni provocate registrabili in risposta a uno stimolo sonoro breve (un clic) e i prodotti di distorsione acustica registrabili in risposta a una doppia stimolazione tonale continua di frequenze vicine. L’origine endococleare delle emissioni acustiche cocleari è stata documentata con varie argomentazioni:
• la loro non-linearità (saturazione dell’emissione a forte livello
di stimolazione);
• la loro selettività frequenziale;
• la loro riduzione di ampiezza e addirittura la loro scomparsa
in caso di lesione delle CCE;
• il loro lungo intervallo di comparsa (da 5 a 25 ms a seconda
della frequenza).
Queste emissioni acustiche cocleari sono testimoni della presenza dei fenomeni attivi endococleari.
Fisiologia dei centri uditivi
I messaggi uditivi sono veicolati sotto forma di potenziali d’azione dal contingente di fibre afferenti di tipo I del nervo cocleare, che unisce la coclea al nucleo cocleare nel tronco
cerebrale. L’informazione camminerà allora di relè in relè, fino alla corteccia uditiva. È particolarmente interessante il fatto che su diversi piani del sistema uditivo esistano delle decussazioni: queste consentono tra l’altro ai dati provenienti dalle due orecchie di essere raggruppati e confrontati, cosa che porta all’estrazione di elementi essenziali che saranno valutati nel dettaglio in una sede più lontana. Per capire ciò che i centri uditivi potranno estrarre come informazione e per anticipare il modo in cui una sordità neurosensoriale, il più
delle volte di origine cocleare, va a provocare disturbi di comprensione, è necessario determinare la natura del o dei codici veicolati.
Analisi frequenziale
I messaggi acustici sono stati smistati dalla coclea prima di tutto sulla base del loro contenuto in frequenze. Quando diversi picchi spettrali sono presenti nel suono da codificare, l’elevata
selettività del sistema membrana basilare e CCE si manifesta con la presenza di risonanze molto fini, ciascuna nel punto lungo della spirale cocleare la cui frequenza tipica coincide con
quella di un picco spettrale del suono. I neuroni connessi con le CCI di questo punto hanno quindi un attivismo intenso che i loro vicini non hanno. Un profilo di attività neurale può
essere ottenuto al prezzo di registrazioni ripetute di molti neuroni, che permettono di stabilire il loro tasso di potenziali d’azione per unità di tempo e di riportarli su un grafico di
sintesi in funzione della frequenza tipica di ogni neurone. Questo profilo riproduce fedelmente il profilo spettrale del suono incidente (nucleo cocleare, collicolo) (Fig. 16). Il principio della ricostituzione nelle vie nervose uditive di tali profili, anche se semplificati, è evidentemente alla base del funzionamento degli impianti cocleari a multielettrodi e del loro successo.
Il tasso per unità di tempo di potenziali d’azione veicolati in un neurone uditivo codifica per l’intensità della componente spettrale che fa rispondere il neurone. Questo principio
di codificazione genera parecchie difficoltà: la dinamica di un neurone, entro la sua soglia di risposta (la più piccola intensità che provoca un aumento significativo della sua attività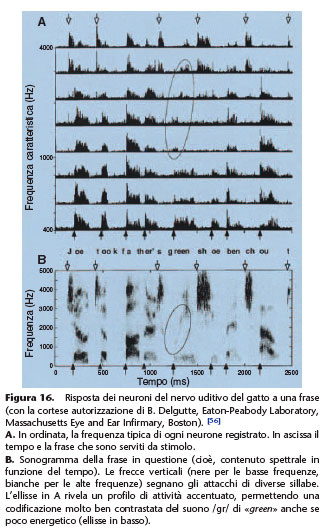 rispetto al suo livello spontaneo) e il raggiungimento di una saturazione (dove il tasso di potenziali d’azione è il massimo compatibile con l’esistenza di un periodo refrattario assoluto incompressibile) è dell’ordine di 40 dB. Il comportamento compressivo della membrana basilare insieme alle CCE (crescita da 0,2 a 0,3 dB/dB di aumento del suono esterno) offre
rispetto al suo livello spontaneo) e il raggiungimento di una saturazione (dove il tasso di potenziali d’azione è il massimo compatibile con l’esistenza di un periodo refrattario assoluto incompressibile) è dell’ordine di 40 dB. Il comportamento compressivo della membrana basilare insieme alle CCE (crescita da 0,2 a 0,3 dB/dB di aumento del suono esterno) offre
una prima soluzione per aumentare la dinamica neuronale (quando le CCE diventano non funzionali, in caso di sordità cocleare, la compressione scompare e la dinamica neuronale si
riduce, dando origine al reclutamento di sonia, che è una distorsione nella sensazione di forza sonora che cresce troppo rapidamente una volta superata la soglia uditiva). La seconda
soluzione è fornita dalla coesistenza di neuroni di bassa e alta attività spontanea (rispettivamente di alta e bassa soglia). Quando i neuroni di bassa soglia sono saturi, i neuroni di alta soglia generati dalle stesse CCI acquisiscono il relè in quanto
la loro dinamica non è ancora saturata. Poiché il tasso di potenziali d’azione per secondo, considerato
globalmente, codifica per l’intensità sonora, ci si può interrogare sulle informazioni che la struttura fine dei potenziali d’azione può veicolare. Alle frequenze superiori a 3 kHz, questa non rappresenta in niente la struttura fine temporale dell’onda di pressione da codificare, poiché i periodi refrattari dei neuroni
sono troppo lunghi per permettere a un sincronismo (o phase locking) di verificarsi.
A frequenza più bassa, nel corso del periodo di un suono, la probabilità di presenza di un potenziale d’azione tende invece, quanto più la frequenza è bassa, a presentare un’oscillazione sinusoidale che riproduce quella del suono, con un massimo che corrisponde a una fase precisa dell’oscillazione. Questa capacità di sincronismo di fase si manifesta a livello della popolazione neuronale che risponde a un suono, piuttosto che a livello di un neurone individuale i cui potenziali di azione possono «essere privi di» uno o di diversi periodi del suono
incidente. Ciò ha due conseguenze sul piano delle informazioni codificate. La prima è che vi sia una possibilità di codificazione delle basse frequenze complementare a quella basata sul principio di tonotopia. Questa nuova possibilità, di natura temporale, consiste nel prendere in considerazione il periodo medio dei potenziali d’azione e spiega come vi siano diversi modi di
valutare (e di avvertire) l’altezza di un suono, a seconda della regione cocleare che risponde (tonotopia) e a seconda della periodicità che deriva da un’analisi globale dei potenziali
d’azione. Queste due modalità sono normalmente (in una coclea normale e in assenza di rumore) coerenti, pertanto è difficile dire quale indice, tonotopico o temporale, sia sfruttato
dai centri uditivi. In caso di patologia invece, gli indici temporali sono spesso più consistenti di quelli tonotopici, che sono molto degradati in caso di sordità con lesione delle CCE. In
presenza di rumore aleatorio sembra anche che gli indici temporali possano essere i soli conservati. Il caso degli impianti cocleari pone un problema particolare interessante
perché la sincronia è molto ben rispettata, mentre la tonotopia non è che approssimativa, se non slivellata, a seconda della posizione del porta-elettrodi. È stato recentemente dimostrato
che la percezione di altezza è molto alterata in caso di discordanza importante tra tonotopia e periodicità: ciò può spiegare le difficoltà tipiche dei soggetti con impianti cocleari per quanto riguarda la percezione dell’altezza e della musica. La seconda conseguenza del sincronismo di fase dei potenziali d’azione alle basse frequenze è che le sottili differenze di tempo tra le due orecchie, legate all’orientamento di una fonte sonora nel piano azimutale (il tempo impiegato dal suono per raggiungere l’orecchio distale rispetto all’orecchio prossimale dipende in maniera univoca dall’angolo della sorgente rispetto all’asse di simmetria nel piano orizzontale che passa per le due orecchie), possono essere sfruttate per la localizzazione sonora al di sotto
di 3 kHz. Alcuni importanti fenomeni percettivi derivati dalla struttura semplice dei pattern di potenziali d’azione veicolati dal nervo cocleare saranno esaminati nel paragrafo successivo. Il centro uditivo responsabile dell’elaborazione è a volte identificato chiaramente (è questo il caso dei centri coinvolti nella localizzazione), anche se il modo in cui la sua funzione viene messa in atto rimane ancora spesso oggetto di controversie o di interrogazioni. In altri casi sono senza dubbio implicati diversi piani del sistema uditivo. In cima alla scala si trovano i
meccanismi di comprensione (e di produzione) della parola, implicati nella comunicazione parlata, tanto essenziali per la specie umana. Il loro studio va molto al di là dei nostri
propositi.
Localizzazione
La capacità di localizzare un suono è essenziale sul piano percettivo (non solamente per la localizzazione di un predatore, di una preda o di un partner, ma anche per separare efficacemente le fonti di rumore e di segnali pertinenti). Quando una fonte sonora si trova in una direzione laterale che forma un angolo a con l’asse di simmetria, il suono giunge all’orecchio distale, da una parte ritardato di un tempo (dell’ordine di alcune centinaia di microsecondi al massimo) direttamente correlato a a, d’altra parte attenuato di x dB a causa dell’effetto d’ombra della testa (differenza interauricolare di intensità). A bassa frequenza l’effetto d’ombra della testa è molto debole o trascurabile a causa del fenomeno di diffrazione che devia senza attenuazione ogni suono la cui lunghezza d’onda è superiore al diametro della testa (caratteristicamente una lunghezza d’onda k= 20 cm corrisponde nell’aria a una frequenza limite dell’ordine di 1.500 Hz). È necessario dunque che la frequenza sia superiore a 1,5-2 kHz per far sì che lo scarto interauricolaredi intensità raggiunga o superi 1 dB, la più piccola differenza di rispetto al suo livello spontaneo) e il raggiungimento di una saturazione (dove il tasso di potenziali d’azione è il massimo compatibile con l’esistenza di un periodo refrattario assoluto incompressibile) è dell’ordine di 40 dB. Il comportamento compressivo della membrana basilare insieme alle CCE (crescita da 0,2 a 0,3 dB/dB di aumento del suono esterno) offre una prima soluzione per aumentare la dinamica neuronale (quando le CCE diventano non funzionali, in caso di sordità cocleare, la compressione scompare e la dinamica neuronale si riduce, dando origine al reclutamento di sonia, che è una distorsione nella sensazione di forza sonora che cresce troppo rapidamente una volta superata la soglia uditiva). La seconda soluzione è fornita dalla coesistenza di neuroni di bassa e alta attività spontanea (rispettivamente di alta e bassa soglia). Quando i neuroni di bassa soglia sono saturi, i neuroni di alta soglia generati dalle stesse CCI acquisiscono il relè in quanto
la loro dinamica non è ancora saturata. Poiché il tasso di potenziali d’azione per secondo, considerato globalmente, codifica per l’intensità sonora, ci si può interrogare sulle informazioni che la struttura fine dei potenziali d’azione può veicolare. Alle frequenze superiori a 3 kHz, questa non rappresenta in niente la struttura fine temporale dell’onda di pressione da codificare, poiché i periodi refrattari dei neuroni sono troppo lunghi per permettere a un sincronismo (o phase locking) di verificarsi. A frequenza più bassa, nel corso del periodo di un suono, la probabilità di presenza di un potenziale d’azione tende invece, quanto più la frequenza è bassa, a presentare un’oscillazione sinusoidale che riproduce quella del suono, con un massimo che corrisponde a una fase precisa dell’oscillazione. Questa capacità di sincronismo di fase si manifesta a livello della popolazione neuronale che risponde a un suono, piuttosto che a livello di un neurone individuale i cui potenziali di azione possono «essere privi di» uno o di diversi periodi del suono incidente. Ciò ha due conseguenze sul piano delle informazioni codificate. La prima è che vi sia una possibilità di codificazione delle basse frequenze complementare a quella basata sul principio di tonotopia. Questa nuova possibilità, di natura temporale, consiste nel prendere in considerazione il periodo medio dei potenziali d’azione e spiega come vi siano diversi modi di valutare (e di avvertire) l’altezza di un suono, a seconda della regione cocleare che risponde (tonotopia) e a seconda della periodicità che deriva da un’analisi globale dei potenziali d’azione. Queste due modalità sono normalmente (in una coclea normale e in assenza di rumore) coerenti, pertanto è difficile dire quale indice, tonotopico o temporale, sia sfruttato dai centri uditivi. In caso di patologia invece, gli indici temporali sono spesso più consistenti di quelli tonotopici, che sono molto degradati in caso di sordità con lesione delle CCE. In presenza di rumore aleatorio sembra anche che gli indici
temporali possano essere i soli conservati. Il caso degli impianti cocleari pone un problema particolare interessante perché la sincronia è molto ben rispettata, mentre la tonotopia
non è che approssimativa, se non slivellata, a seconda della posizione del porta-elettrodi. È stato recentemente dimostrato che la percezione di altezza è molto alterata in caso di
discordanza importante tra tonotopia e periodicità: ciò può spiegare le difficoltà tipiche dei soggetti con impianti cocleari per quanto riguarda la percezione dell’altezza e della musica.
La seconda conseguenza del sincronismo di fase dei potenziali d’azione alle basse frequenze è che le sottili differenze di tempo tra le due orecchie, legate all’orientamento di una fonte sonora nel piano azimutale (il tempo impiegato dal suono per raggiungere l’orecchio distale rispetto all’orecchio prossimale dipende in maniera univoca dall’angolo della sorgente rispetto all’asse di simmetria nel piano orizzontale che passa per le due orecchie), possono essere sfruttate per la localizzazione sonora al di sotto di 3 kHz.
Alcuni importanti fenomeni percettivi derivati dalla struttura semplice dei pattern di potenziali d’azione veicolati dal nervo cocleare saranno esaminati nel paragrafo successivo. Il centro
uditivo responsabile dell’elaborazione è a volte identificato chiaramente (è questo il caso dei centri coinvolti nella localizzazione), anche se il modo in cui la sua funzione viene messa
in atto rimane ancora spesso oggetto di controversie o di interrogazioni. In altri casi sono senza dubbio implicati diversi piani del sistema uditivo. In cima alla scala si trovano i
meccanismi di comprensione (e di produzione) della parola, implicati nella comunicazione parlata, tanto essenziali per la specie umana. Il loro studio va molto al di là dei nostri
propositi.
Sonia
La sonia è la sensazione di forza sonora e, con l’altezza e il timbro, essa rappresenta uno dei tre attributi fondamentali di un suono. È la distorsione della sonia, o reclutamento di
sonia, che rende la strumentazione delle ipoacusie cocleari così delicata. È ampiamente accettato che la sonia sia codificata dal numero totale di potenziali d’azione veicolati dal
nervo cocleare. La soglia differenziale di sonia è facile da valutare, poiché il compito sottoposto ai soggetti testati è comparativo: è il più piccolo aumento di intensità calcolabile,
di circa 1 dB. Secondo la celebre legge di Weber questa soglia differenziale è approssimativamente costante e indipendente dal livello scelto come riferimento. Abbiamo visto la sua importanza nella localizzazione grazie allo scarto interauricolare di intensità. La crescita della sonia è molto più difficile da riconoscere perché è puramente soggettiva. In caso di sordità cocleare tipica con CCE interessate, poiché la compressione osservata a livello
della membrana basilare è scomparsa insieme al guadagno fornito dalle CCE, si accetta di buon grado la logica del disturbo di un soggetto che riferisce un reclutamento, ma, nel caso di
un’iperacusia «di base», è la sola parola del paziente a essere depositata agli atti. Normalmente e in media, si ritiene (legge di Stevens) che la sonia raddoppi ogni volta che il livello sonoro aumenta di 10 dB, o ancora (Fechner) che la sua crescita sia «logaritmica». Le due leggi, di Stevens e Fechner, benché abbiano basi abbastanza diverse, forniscono in realtà delle previsioni numeriche molto vicine. Se non si sa esattamente come né dove la sonia venga valutata, si sospetta invece degli elementi che permettono questa valutazione: si deve tenere conto non solo dell’attività dei neuroni uditivi connessi alle CCI della regione in risonanza, aggiungendo anche il contributo dei neuroni a bassa e ad alta soglia, ma anche dell’attività dei neuroni che spiegano la distribuzione delle eccitazioni lungo la membrana basilare e, in particolare, verso la base della coclea agli alti livelli. Le discordanze tra le previsioni dei modelli neuronali basati su quanto detto prima e alcune osservazioni psicofisiche indicano tuttavia che tutto non è stato ancora chiarito correttamente.
Bande critiche e mascheramento
Quando due suoni di frequenze diverse, per esempio un segnale e un rumore, raggiungono la coclea nello stesso tempo, può essere esercitato un mascheramento da parte di una
componente frequenziale sull’altra. Uno dei meccanismi implicati è quello detto «della linea occupata» (Fletcher), attraverso il quale i neuroni implicati nella codificazione del
segnale, ma connessi a una zona della coclea capace anche di rispondere al rumore, si trovano per questa ragione a rispondere al rumore al momento della comparsa del segnale. I potenziali d’azione dovuti al segnale si trovano mescolati a quelli dovuti al rumore, o peggio ancora, il neurone già saturo per via del rumore o posto dal rumore in periodo refrattario non è disponibile per rispondere al segnale. Abbiamo visto precedentemente che il sistema efferente mediano era coinvolto nei meccanismi di eliminazione dei rumori. Abbiamo anche sospettato il ruolo della localizzazione delle sorgenti uditive nel far sì che i centri ritrovino la parte del rumore e quella del segnale attraverso le loro localizzazioni spaziali differenti (smascheramento biauricolare, effettuato nel tronco cerebrale – a partire da informazioni che senza dubbio originano nel complesso olivare superiore). Un ruolo importante nella distinzione tra rumori e segnali viene svolto grazie anche al fenomeno delle bande critiche. Supponiamo un suono test a 1 kHz, mescolato a un rumore a larga banda spettrale. Si osserva che, fintanto che il rumore non contenga energia debordante in una banda centrata su 1 kHz e di larghezza normale di 160 Hz (cioè [920, 1080 Hz]), esso non influisce sulla percezione della sonia del suono test e dunque non lo maschera. Questa nozione si generalizza e definisce
così la nozione di banda critica, essendo la larghezza di ogni banda critica proporzionale alla sua frequenza centrale (160 Hz intorno a 1 kHz, 320 e poi 640 Hz intorno a 2 e poi 4 Hz
rispettivamente ecc.). Si ritrova la correlazione nelle curve di accordo dei neuroni nel nucleo centrale del collicolo inferiore (mesencefalo uditivo): questi neuroni hanno una curva di
accordo a forma di banda critica e le loro risposte rimangono imperturbabili a ogni rumore esterno. È evidente che, se le risonanze cocleari sono allargate in seguito a patologia delle
CCE, le bande critiche si trovano funzionalmente «allargate» poiché l’eccitazione dovuta a un rumore deborda troppo sulla membrana basilare e va a interessare dei neuroni normalmente
non rispondenti al rumore considerato: alcune bande critiche cominciano a ricevere dei messaggi che normalmente non le riguardano.
Alcuni aspetti della terapia spettrale dei suoni complessi Gli elementi precedenti riguardano alcuni aspetti molto basilari del trattamento dei segnali acustici. Si sa che lo spettrogramma di un suono complesso (per esempio un suono di parola) si ritrova in molti dei suoi dettagli a livello dei centri uditivi localizzati sempre più in alto, ma non si sa ancora a quale(i) livello(i) inizi(no) realmente l’analisi in vista dell’identificazione dei messaggi veicolati (forse principalmente a livello della corteccia uditiva – modello bottom-up benché, per alcuni,
la presenza di vie efferenti disposte dalla corteccia alla coclea propenda per un modello dove le interazioni top-down sono importanti).
In ogni caso si sa che l’immagine di questo spettrogramma, già ben visibile a livello del nervo cocleare, si può affinare gradualmente nel nucleo cocleare (nucleo dove esistono molteplici
circuiti basati su molteplici tipi neuronali, gli uni sensibili agli attacchi gli altri ad altri aspetti temporali o spettrali dei suoni) e poi nel collicolo inferiore. [56] Alcuni indici
importanti per l’identificazione delle sillabe vedono il loro contrasto rinforzato, anche (e soprattutto) in presenza di suoni competitori o di rumore. Quando ci si interessa alle protesi
uditive di tipo impianto cocleare o del tronco cerebrale, è assolutamente essenziale che i loro algoritmi di trattamento si rifacciano a quello realizzato dal sistema uditivo normale, al
fine di fornire al soggetto portatore di apparecchio degli indici pertinenti che i suoi circuiti neuronali possano utilizzare il più naturalmente ed efficacemente possibile. È tutto l’interesse della migliore conoscenza della fisiologia dell’udito nella sua forma integrata.