Otomicosi (Micosi del CUE)
- Categoria: Infiammazioni Forme Flogistiche
- Pubblicato: Lunedì, 07 Dicembre 2015 18:39
- Visite: 23981
Categoria: INFIAMMAZIONI FORME FLOGISTICHE Inestetismi dell'orecchio (Malformazioni Congenite e Acquisite) eliminare
Otomicosi:
causa:
1.Aspergillus niger,
2.Aspergillus fumigatus,
3.Candida albicans.
Il patogeno più comune è l’Aspergillus (80 a 90 percento dei casi), seguito da Candida.
Classicamente, l'infezione fungina è il risultato di un trattamento prolungato di otite esterna batterica che altera la flora del canale uditivo. Infezioni batteriche e fungine misti sono così comuni
Caratteristiche cliniche :
i sintomi più comuni dell’ otomicosi sono prurito in profondità all'interno dell'orecchio e un irresistibile desiderio di grattarsi.
Il prurito progredisce generalmente al dolore acuto, con o senza drenaggio.
L'accumulo di detriti fungine nel infiammata, restringeva canale spesso porta a una denuncia di perdita dell'udito.
L'acufene è un disturbo comune che presenta.
tuttavia, con infezioni gravi dolori si verificherà anche
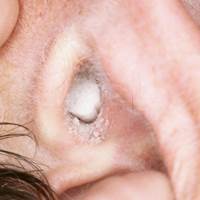
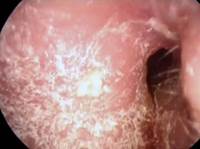
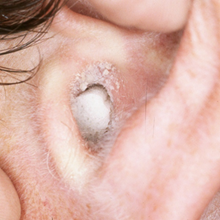
esame con otoscopio : L'esame fisico dimostra generalmente eritema del canale uditivo, edema mite e la presenza di bianco, grigio o nero detriti fungine all'interno del canale.
massa fungina è visto come "pezzo di carta da filtro umida"

Fig.1: Aspergillus niger- crescita filamentosa .con spore rotonde nere

Fig.2: Aspergillus fumigatus- azzurro o verde

Fig.3: Candida albicans - deposito bianco cremoso
Trattamento:
La pulizia del condotto uditivo, aspirando è un trattamento principale.
Gocce acidificanti, date tre o quattro volte al giorno per 5-7 giorni, sono di solito sufficienti per completare il trattamento.
Perché l'infezione può persistere asintomatico, il paziente deve essere rivalutati al termine del ciclo di trattamento. In questo momento ogni ulteriore pulizia può essere eseguita come necessario. Se l'infezione non si risolve, over-the-counter soluzione clotrimazolo 1% (Lotrimin), che ha anche una certa attività antibatterica, può essere utilizzato
Nistatina è efficace contro la candida
otomicosi:APPROFONDIMENTO

Fig.1A: Condotto uditivo esterno con crescita eccessiva di Aspergillus niger che si manifesta come una matrice cotonosa sormontata da piccole sfere nere.

Fig.2A: Color SEM del fungo, Aspergillus niger

Fig.3A Definizione :Una infezione fungina superficiale del orecchio, di solito si trova nel canale uditivo esterno, può anche essere trovato nell’orecchio medio o in un mastoidectomia. Le infezioni fungine profonde che coinvolgono l'orecchio sono infrequenti. Eziologia Aspergillus niger, Aspergillus flavus, Aspergillus fumigatus e Candida albicans, sono gli organismi più comunemente incontrati. Fattori predisponenti comprendono l'umidità, per esempio il nuoto o la doccia, e l’uso precedente di gocce antibiotiche topiche orecchio, soprattutto quelli contenenti neomicina che può uccidere la normale flora del canale esterno. Sintomi I sintomi della Otomicosi sono prurito, irritazione locale, otorrea persistente e dolore. In una fase iniziale il dolore è spesso più grave di quanto l'aspetto clinico giustificherebbe, suggerendo all'esaminatore la possibilità di una infezione micotica. L'esame otoscopico nelle prime fasi , rivela generalmente l'apparenza di cottone o detriti che assomigliano a tessuto di carta umida. Il lume del canale è riempito da una crema bianca o essudato muco-purulento. Notare la soffice isola bianca diagnostica che consiste nelle ife fungine nell’ Aspergillus.
Introduzione
L'otomicosi è un'infezione fungina che colpisce soprattutto l'orecchio esterno. In pratica, è il condotto uditivo esterno ad esserne interessato. Le localizzazioni a livello del padiglione (dermatomicosi) si avvicinano di più alle micosi cutanee che alle otomicosi e, il più delle volte, sono indirizzate verso un trattamento dermatologico. L'otomicosi è una patologia relativamente frequente, riscontrata prevalentemente durante il periodo estivo.
Prospettiva storica
Andrai e Gavarret nel 1843 e Mayer nel 1844 per primi hanno descritto le infezioni fungine del canale uditivo esterno e successivamente Virchow ha suggerito il termine 'otomycosis'. Nel 1851, Pacini è stato il primo a descrivere una preparazione per il trattamento dell’ otomicosi (citato da Tom, 2000). Ulteriori rapporti sono stati pubblicati all'inizio del XX secolo (Galloway, 1903; Cheatle, 1920). Wolf ha descritto il rapporto di diversi funghi con questa entità clinica (Wolf, 1947) Il ruolo predominante di A. niger in otomycosis è stata fondata nel 1960 e 1970 (Damato et al, 1964; Bezjak, 1970). Damato credeva anche che la ricorrenza era probabile se la pulizia e asciugatura erano i soli regimi di gestione e in seguito dichiarato il ruolo di tolnaftate nel suo trattamento (Damato, 1966 e 1973). Stern et al suggerisce che la maggior parte dei casi di otomycosis risolverebbero con la pulizia meticolosa e asciugatura (Stern et al, 1988). Otomycosis classicamente è stato descritto come una infezione fungina del condotto uditivo esterno, ma Paulose et al ha suggerito che il termine debba essere ampliato e ridefinito per includere infezioni fungine dell'orecchio medio e cavità mastoide aperto (Paulose et al, 1989). Maligna (invasiva) otite esterna, la forma più grave della malattia, è stato descritto da Chandler (Chandler, 1968). Haruna et al ha aggiornato i risultati istopatologici di otomycosis (Haruna et al, 1994), che sono stati ulteriormente elaborati dai Vennewald et al (2002).
La sua prevalenza rappresenterebbe dal 5 al 10% dell'insieme delle otiti esterne (Baya M, 1994;, Molina UR, 1994;). I fattori che favoriscono la comparsa di otomicosi sono quelli abitualmente osservati in caso di infezioni fungine: clima tropicale (Bokowy C.,1995: Loh K.S., 1998), immunodepressione, traumatismi locali e chirurgici(Garcia MP, 1993; Hennequin C, 1994), applicazione di antibiotici o di corticosteroidi in situ... Gli agenti patogeni (lieviti, filamenti miceliali cheratinofili) maggiormente riscontrati (Chander J., 1996; Garcia MP, 1993) sono Candida albicans e Aspergillus. Accanto a questa forma acuta canonica, si distinguono forme subacute, croniche e invasive che devono essere sempre affrontate in caso di resistenza al trattamento consueto.
L'otomicosi è una forma particolare di otite esterna. Può essere primitiva e isolata o sovrapposta a un'infezione classica da germi piogeni [Bambule G.,1982] e deve essere sospettata in caso di resistenza al trattamento e di passaggio alle forme subacute o croniche. La diagnosi è clinica e microbiologica. Gli agenti causali di più comune riscontro sono Aspergillus e Candida (Bordure P.,1995; Kaur R., 2000] I fattori che favoriscono lo sviluppo delle micosi sono l'umidità, il calore e il buio. La terapia fa ricorso al trattamento locale (essiccazione), ai topici e agli agenti antimicotici. Solitamente a evoluzione favorevole, le otomicosi sono a volte lunghe e difficili da trattare, in particolare nel caso di patologie otologiche croniche sottostanti. Tuttavia, la diagnosi può essere particolarmente difficoltosa, soprattutto in caso di sovrainfezione. È necessario, tuttavia, saper individuare le otomicosi gravi o estese la cui diagnosi può essere più difficile. Queste forme si presentano soprattutto in soggetti immunodepressi. Esse richiedono un trattamento medico urgente per via sistemica e, talvolta, il trattamento chirurgico.
OTOMICOSI
E' una dermatite che colpisce il condotto uditivo in genere da un solo lato, causata da funghi di vario tipo (Aspergillus niger, Candida albicans, ecc...).
L'infiammazione genera prurito, ipoacusia, dolore e tensione.
La malattia ha un decorso di alcuni mesi.
La terapia è medica e si basa su farmaci applicati localmente dal paziente o mediante medicazioni eseguite dallo specialista.
E' una affezione benigna e guarisce quasi sempre senza postumi, anche se può recidivare con estrema facilità.
L’otomicosi può essere favorita da un’immunodepressione, da un clima di tipo tropicale, da traumi del condotto uditivo esterno, dall’applicazione di antibiotici o di corticosteroidi. La diagnosi si basa prima di tutto sull’esame obiettivo e gli esami micobatteriologici sono realizzati solo in caso di dubbio diagnostico. Il trattamento dell’otomicosi abitualmente è locale e si basa sull’applicazione di antifungini, di tipo polienico o imidazolico e deve durare almeno 2 settimane. Nella maggior parte dei casi, l’otomicosi rimane un’otite comune, che guarisce solamente con un trattamento adeguato. È necessario, tuttavia, saper individuare le forme complicate o estese che richiedono un trattamento sistemico urgente e prolungato. Le localizzazioni a livello del padiglione (dermatomicosi) si avvicinano di più alle micosi cutanee che alle otomicosi e, il più delle volte, sono indirizzate verso un trattamento dermatologico. L’otomicosi è una patologia relativamente frequente, riscontrata prevalentemente durante il periodo estivo. La sua prevalenza rappresenterebbe dal 5 al 10% dell’insieme delle otiti esterne. I fattori che favoriscono la comparsa di otomicosi sono quelli abitualmente osservati in caso di infezioni fungine: clima tropicale, immunodepressione, traumatismi locali e chirurgici, applicazione di antibiotici o di corticosteroidi in situ... Gli agenti patogeni (lieviti, filamenti miceliali cheratinofili) maggiormente riscontrati sono Candida albicans e Aspergillus. La diagnosi di otomicosi si basa innanzitutto sull’esame otoscopico e la sua sintomatologia clinica è simile a quella dell’otite esterna batterica. Tuttavia, la diagnosi può essere particolarmente difficoltosa, soprattutto in caso di sovrainfezione. Il suo trattamento è innanzitutto locale, basato sull’applicazione di antifungini, di tipo polienico (spettro stretto) o imidazolico (ampio spettro). Nella maggior parte dei casi, l’otomicosi guarisce solamente con un trattamento adeguato. È necessario, tuttavia, saper individuare le otomicosi gravi o estese la cui diagnosi può essere più difficile.
Queste forme si presentano soprattutto in soggetti immunodepressi.
Esse richiedono un trattamento medico urgente per via sistemica e, talvolta, il trattamento chirurgico.

Fig.4A E' possibile fare diagnosi immediata di otite esterna micotica per la presenza di ife fungine o la presenza di spore nerastre (simili a palline nerastre raggruppate) dell'Aspergillus.
E' buona norma rivedere il paziente dopo qualche giorno per pulire di nuovo il condotto e osservare se il quadro è cambiato oppure ci è sfuggito qualcosa a causa della abbondante secrezione e controllare la risposta alla terapia.
Se la pulizia è impossibile, per il dolore e la tumefazione, specialmente se si tratta di bambini poco collaboranti, è buona norma rivedere il paziente con follow-up frequenti.
Fisiopatologia
La cute del CUE cartilagineo (terzo esterno) contiene follicoli piliferi e ghiandole sebacee e apocrine che producono il cerume, mentre la cute del CUE osseo (due terzi interni) è molto più sottile ed è priva di annessi. Il cerume e la flora commensale del CUE proteggono la cute e il timpano dalle infezioni (Bordure P. 1995; Senturia B.H., 1980).
Il cerume è una barriera fisica e fisiologica contro le infezioni. Il suo carattere idrofobo protegge la cute sottostante dalla macerazione; il suo pH acido (Senturia B.H., 1980; Goffin G.B. ,1963) non è adatto allo sviluppo di germi patogeni (Goffin G.B. ,1963) e, oltre a ciò, il cerume contiene delle immunoglobuline e dei lisozimi, il cui ruolo non è ancora ben definito (Hyslop N.E. ,1971 ; Petrakis N.L., 1971)
La pulizia eccessiva del CUE (bastoncini di cotone) rimuove il cerume e crea microtraumi nella cute del CUE osseo, che favoriscono le infezioni.
La flora commensale del CUE è composta da batteri e da micromiceti che vivono in uno stato di equilibrio (Bordure P. 1995;Singer D.E 1952)]. La conoscenza di questa flora saprofita permette di validare il carattere patologico di un prelievo. In caso di squilibrio di questa flora legato a fattori esterni (terapia antibiotica per via locale o generale, lavaggio, corticosteroidi per uso topico), alcuni micromiceti possono proliferare e diventare patogeni (in particolare Aspergillus).
Micologia e commensalismo del condotto uditivo esterno
Lo studio dell’ecologia micologica e microbica cutanea permette di descrivere un certo numero di microorganismi che costituiscono la flora commensale del condotto uditivo esterno. Tra questi si riscontrano batteri e funghi (o micromiceti). I micromiceti appartengono al regno vegetale. Sono tallofiti, ovvero non comportano né stelo, né foglie, né radici; l’assenza di sistema clorofilliano li rende saprofiti obbligatori. Ma ogni saprofitismo non implica necessariamente patogenicità e, dunque, bisogna dare il giusto valore ai risultati dei prelievi micologici e batteriologici eseguiti a livello cutaneo. Senza il confronto dell’esame obiettivo, un prelievo effettuato a livello del condotto uditivo esterno ha scarso significato clinico: può indicare la presenza di una popolazione di microorganismi saprofitici od essere semplicemente indice di una contaminazione esterna. Lo studio della flora saprofita del condotto uditivo esterno (commensalismo) evidenzia che i batteri e i micromiceti sono presenti in grande quantità
Micromiceti commensali
Frequentemente vengono isolati nel condotto uditivo esterno in assenza di infezione conclamata. Si distinguono (Bordure P., 1995):
– il genere dei micromiceti filamentosi della famiglia delle aspergillacee (gruppo degli Aspergilli);
– il genere dei lievitiformi, quali Pityrosporum ovale (Leyden J.J., 1987);
Invece, il carattere saprofita dei lieviti di tipo Candida albicans, riconosciuto a livello dell’apparato digerente, è controverso a livello del condotto uditivo esterno.
Qualsiasi squilibrio della flora cutanea saprofita del condotto uditivo esterno può essere all’origine di un’infezione dell’orecchio. In effetti una distruzione elettiva della flora batterica determina un aumento anomalo della percentuale degli agenti fungini, dando loro un carattere invasivo e patogeno.
Batteri saprofiti
Sono riscontrati nel 70-95% dei prelievi del condotto uditivo esterno
eseguiti in assenza di anomalie cliniche(Bordure P., 1995) . I germi riscontrati con maggiore frequenza(Leyden J.J., 1987) possono essere classificati in quattro gruppi.
Stafilococchi coagulasi negativi
Sono i più numerosi. Fanno parte del gruppo dei cocchi Gram positivi e sono tipicamente raggruppati in piccoli ammassi più o meno regolari. Tra essi, i due principali sono lo Staphylococcus auricularis (specifico del condotto uditivo esterno) e lo Staphylococcus capitis (non specifico). Non è stato descritto alcun ruolo patogeno per questi stafilococchi coagulasi negativi a livello del condotto uditivo esterno.
Difteroidi aerobi o corineiformi
Sono osservati molto spesso nel condotto uditivo esterno. Hanno forma di bastoncini e fanno parte del gruppo dei bacilli Gram positivi. Alcuni di essi sono particolarmente lipofili e si sviluppano nelle regioni ricche di ghiandole sebacee.
Difteroidi anaerobi
Si riscontrano meno di frequente. Si tratta soprattutto del gruppo dei Propionibacterium.
Altri batteri: Escherichia coli, Proteus e Pseudomonas aeruginosa (Singer D.E., 1952)
Sono riscontrati sporadicamente nel condotto uditivo esterno sano.
Epidemiologia
L'otomicosi può essere osservata a tutte le età, con un picco di frequenza nel giovane adulto legato a determinati fattori predisponenti (bagni di mare, piscina) (Stern J.C., 1988). La forma acuta colpisce quattro in 1.000 persone ogni anno e la forma cronica colpisce il 3-5% della popolazione. Malattia acuta comunemente deriva dalla proliferazione batterica (90%) o funghi (10%) in un canale auricolare sottoposto a umidità eccessiva o ad un trauma locale (Osguthorpe et al, 2006) . In diversi studi, si stima che circa il 5-25% dei casi totali di otite esterna sono dovuti a otomicosi (Del Palacio et al, 1993). La malattia è mondiale nella distribuzione. Otomicosi è più prevalente in climi caldi e umidi, specialmente nella stagione delle piogge rispetto ai climi aridi o freddi. E 'più frequente in individui di basso status socio-economico, con pessime condizioni igieniche. E 'più frequente tra decenni 2a e 3a della vita. I lavoratori in ambienti polverosi o ammuffiti sono di solito più colpite. La prevalenza di otomicosi è maggiore nei bambini malnutriti rispetto ai bambini normali (Enweani et al, 1997).La prevalenza e la caratterizzazione micologica delle otomicosi variano a seconda delle regioni; le aree tropicali e subtropicali, tenuto conto dei fattori climatici e ambientali, sono le zone più esposte [Kaur R., 2000 ; Geaney G.P. 1967). L`otomicosi rappresenta il 5-10% delle otiti esterne, con un netto picco di frequenza in estate (Baya M., 1994).La diagnosi di otomicosi è abitualmente posta nell’adulto al di sopra dei 35 anni di età, di sesso maschile. L’estate e l’autunno costituiscono i periodi di predilezione. Le otomicosi si possono riscontrare in soggetti sani e senza precedenti anamnestici, tuttavia, abitualmente esistono dei fattori predisponenti: recente terapia antibiotica, modificazione del pH cutaneo o delle proprietà antibatteriche del cerume, alla nutrizione, chirurgia otologica recente o traumi del condotto uditivo esterno. In generale, tutti gli stati che inducono un’immunodepressione aumentano il rischio di insorgenza di otomicosi. L’otite esterna è innanzitutto un’infezione di origine batterica: uno studio che raggruppa più di 1.400 prelievi effettuati in pazienti con otorrea ha dimostrato che il germe principale dell’otite esterna era lo Pseudomonas aeruginosa. Tuttavia, è stata ipotizzata anche la responsabilità isolata di un microorganismo fungino nel 6% dei casi, mentre un’eziologia mista, batterica e fungina, era riportata nel 7% dei casi. Prelievi realizzati in pazienti affetti da otomicosi accertata evidenziano che i principali agenti responsabili sono del genere Aspergillus (Aspergillus niger, ma anche flavus e fumigatus) e del genere dei lieviti (Candida albicans, parapsilosis). La presenza di Penicillum è solitamente riportata, ma in proporzioni minori.
Fattori che favoriscono l'infezione del condotto uditivo esterno
L'otite esterna è un'infezione causata da una ferita cutanea o da una rottura della barriera protettiva ceruminosa. I microtraumi strumentali (bastoncini di cotone), come i bagni che alterano il pH e la barriera ceruminosa costituiscono i principali fattori predisponenti (Malard O., 1999 ). L'otite media cronica e, in particolare, il colesteatoma, favoriscono la superinfezione del CUE. Il calore e l'umidità, che accelerano lo sviluppo dei microrganismi, sono anch'essi dei fattori predisponenti.
Fattori che favoriscono specificamente le otomicosi
La maggior parte dei funghi che albergano sugli o negli organismi è costituita da specie non patogene. Solo alcuni miceti si comportano come veri patogeni mentre altri sono opportunisti e approfittano di una defaillance delle difese immunitarie, di disturbi metabolici (diabete) o dell'azione di alcune terapie farmacologiche (antibioticoterapia, corticosteroidi).
Complessivamente, i fattori da ipotizzare e da ricercare al cospetto di un'otomicosi sono i seguenti:
• l'impiego di un antibiotico locale crea uno squilibrio della flora del CUE a vantaggio dei micromiceti [Garcia M.P., Delgado D., Marin P., Mira J. Analysis of 40 cases of otomycosis Enferm. Infect. Microbiol. Clin. 1993 ; 11 : 487-489 13];
• l'uso di corticosteroidi topici (associati o meno agli antibiotici);
• le dermatosi del CUE (dermatite seborroica, eczema), a causa dei microtraumi strumentali ripetuti legati al prurito, all'uso di corticosteroidi topici, alla macerazione e alla desquamazione eccessiva che alterano la barriera ceruminosa (Selesnick S.H.,1994);
• la chirurgia otologica, a causa delle ferite cutanee, della macerazione e dell'uso di antibiotici topici [Selesnick S.H. Otitis externa: management of the recalcitrant case Am. J. Otol. 1994 ; 15 : 408-41215];
• i bagni ripetuti (nuotatori assidui);
• il diabete (Salit I.E.,1982);
• il deficit immunitario.
L'uso di protesi acustiche non sembra essere un fattore di rischio [Bordure P., 2003).
Valutazione micologica
Gli agenti patogeni responsabili di otomicosi appartengono quasi esclusivamente ai gruppi Aspergillus e Candida, la cui frequenza varia in funzione dell'ambiente e del clima (Tabella 1) (Bambule G.,1982;Mugliston T.,1985;Tisner J.,1995; Gugnani H.C., 1989 ; Araiza J., 2006 ; Chander J., 1996). L'agente di più comune riscontro in Europa è Candida albicans, seguito da Aspergillus niger e da Aspergillus flavus [Kaur R., 2000; Vennewald I., 2003]; Aspergillus fumigatus, che pone i maggiori problemi terapeutici, è più raro alle nostre latitudini. Nei paesi subtropicali, il rapporto è rovesciato, con una predominanza di Aspergillus (Kaur R., 2000).
Raramente i dermatofiti sono responsabili di una lesione del CUE; tuttavia, questa diagnosi deve essere sospettata in caso di lesioni eritematosquamose, specialmente se multifocali, resistenti a una terapia ben condotta e senza risultati agli esami micologici abituali.
Studio clinico
Possono presentarsi varie forme cliniche. Di conseguenza la diagnosi è più o meno facile da porre.
Otomicosi acuta
La diagnosi di otomicosi si basa sulla clinica, confermata, in alcuni casi, da un esame micobatteriologico. I disturbi funzionali vanno dal prurito all'iperalgesia del CUE, talvolta associati a otorrea e a ipoacusia. L'anamnesi ricerca la presenza di fattori predisponenti. L'esame otologico con aspirazione mostra un'infiammazione del CUE associata a depositi (Figura 5a-b-c-d) il cui aspetto varia in funzione del germe riscontrato e dello stadio dell'otomicosi. Tipicamente, si osservano dei filamenti di aspetto cotonoso il cui colore varia (bianco per Candida, bianco/nero per Aspergillus niger, bianco/giallastro per Aspergillus flavus) o un aspetto di «carta assorbente bagnata» giallastra. Questi due aspetti possono essere osservati simultaneamente, come anche dei condotti uditivi totalmente ostruiti dai depositi.

Fig.5a Otomicosi acuta da aspergillus niger

Fig.5b Otomicosi Severa

Fig.5c Otomicosi acuta da aspergillus niger
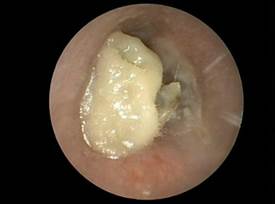
Otomicosi acuta da Candida albicans

Fig.5e:Otomicosi con depositi filamentosi caratteristici

Fig.5f:Otomicosi(detriti fungini nel canale uditivo)
Nella pratica, la diagnosi di otomicosi acuta viene sospettata:
• subito, in caso di forme tipiche con depositi caratteristici nel CUE;
• in presenza di un'otite esterna che persiste malgrado un trattamento antibiotico locale ben condotto.
Stadi
Il decorso clinico è stato diviso in quattro stadi (Senturia B.A., 1980).
• Lo stadio pre-infiammatorio corrisponde a una colonizzazione dello strato corneo dovuta all'alterazione dell'unità protettiva apoliposebacea. I segni funzionali sono limitati al prurito; l'esame del CUE evidenzia depositi che variano in funzione del micromicete responsabile.
• Lo stadio infiammatorio è legato alla lesione degli strati profondi della cute, in genere causata da microtraumi strumentali ripetuti legati al prurito della fase precedente. In questa fase si osservano dolore, edema del CUE, ulcerazioni cutanee, miringite granulomatosa a volte complicata da una perforazione (Fig. 6) e la comparsa di adenopatie preauricolari e di ipoacusia.

Fig. 6 :Otomicosi complicata da una perforazione timpanica.
• Nella fase cronica, il dolore diminuisce, e addirittura scompare, sostituito dal prurito. L'otorrea è presente e il CUE è ostruito da detriti cutanei e da depositi variabili. La cute è infiammatoria ed esulcerata e l'edema è costante. Il timpano è arrossato ed è possibile la concomitanza di una perforazione. La perforazione può provocare una contaminazione dell'orecchio medio e, addirittura, una labirintizzazione (Hurst W.B., 2001). Le diagnosi differenziali in questa fase sono l'otite esterna maligna degenerata e una dermatosi sottostante.
• L'ultimo stadio corrisponde all'otite esterna maligna manifesta, che associa alla fase cronica almeno uno dei seguenti elementi: febbre, sindrome settica, paralisi facciale e sindrome meningea.
In pratica, l'otomicosi viene spesso sospettata di fronte a un'otite esterna resistente a una terapia antibiotica ben condotta. Le otiti esterne «refrattarie» si riscontrano nelle seguenti circostanze (Selesnick S.H.,1994)]: terreno predisponente specifico, dermatosi del CUE, mantenimento dei fattori esterni predisponenti e otite esterna necrotizzante.
OTOMICOSI ESTERNA
Si possono distinguere tre stadi. Lo stadio iniziale corrisponde all’attecchimento del micete e alla sua crescita negli strati superficiali della cute. Si osserva prurito moderato e l’otoscopia rivela un’iperemia della cute. La presenza di filamenti colorati sulle secrezioni permette di porre la diagnosi. A uno stadio più avanzato, il paziente ricorre al medico per otalgia intensa associata ad otorrea. Il condotto uditivo esterno è ostruito da una massa biancastra, che forma un ammasso purulento. Dopo ablazione, la cute del condotto uditivo esterno è infiammata e talvolta ulcerata. Infine, ad uno stadio più avanzato di malattia, che si verifica in assenza di terapia adeguata, i segni funzionali si intensificano.
L’infiammazione è più estesa, talvolta si osservano adenopatie satelliti pretragiche e può insorgere una perforazione del timpano (chiodo micotico).
Prevalenza
– Alle nostre latitudini, la prevalenza dell’otomicosi è bassa. Essa rappresenterebbe il 10% delle cause di otiti esterne. Circa un terzo dei casi di otite esterna che persistono malgrado la terapia locale, avrebbe origine micotica: alcuni lavori scientifici concernenti più di 230 pazienti hanno permesso di evidenziare un micromicete in più del 35% delle otiti esterne che persistono dopo trattamento antibiotico e cortisonico per uso topico.
– In aree a clima tropicale, la prevalenza è nettamente più marcata. In alcune regioni l’incidenza potrebbe oltrepassare il 75% delle otiti esterne. In pratica, l’otomicosi rappresenterebbe il 10% delle visite otologiche in caso di clima caldo-umido . A latitudini tropicali i micromiceti di tipo aspergillare sono i più frequenti e sarebbero responsabili delle forme più gravi.
Otomicosi resistente e cronica
La maggior parte delle otomicosi acute evolve favorevolmente sotto un trattamento medico ben condotto. L'assenza di miglioramenti a un controllo clinico dopo 8 giorni dall'inizio del trattamento deve condurre alla realizzazione di un prelievo micologico e batteriologico. La diagnosi di otomicosi invasiva deve essere esclusa in questa fase: ricerca dei fattori di rischio e di segni clinici suggestivi e prescrizione di esami diagnostici al bisogno (Fig. 7)

Fig. 7 :Algoritmo decisionale. Iter da seguire di fronte a un'otomicosi persistente. CUE: condotto uditivo esterno; TDM: tomodensitometria; Emocromo: emocromo con formula leucocitaria; CRP: C reactive protein; VES: velocità di eritrosedimentazione; HIV: virus dell'immunodeficienza umana; RMN: risonanza magnetica; AG: anestesia generale; NDS: niente da segnalare.
Dopo aver escluso questi fattori di gravità, sono possibili due situazioni:
• il prelievo ha permesso di identificare il germe patogeno. In queste forme cliniche si tratta, il più delle volte, di Aspergillus (Ho T., 2006). Il trattamento sarà guidato da questo prelievo e i fattori predisponenti saranno soppressi;
• il prelievo è negativo. In questo caso deve essere osservata una finestra terapeutica, con un nuovo prelievo effettuato 72 ore dopo. Se anche questo nuovo prelievo è negativo, il carattere moderato delle granulosità del CUE e la presenza di lesioni cutanee squamose sulla conca orientano verso una dermatite seborroica del CUE oppure verso una dermatofitosi.
In caso di mancato miglioramento della sintomatologia nonostante una terapia ben condotta, deve nuovamente essere presa in considerazione una diagnosi di otomicosi invasiva che deve portare alla prescrizione di una TC e di una valutazione laboratoristica. Infine, in caso di persistenza di un importante tessuto di granulazione nel CUE, deve essere eseguita una biopsia per escludere la presenza di una patologia neoplastica.
Si tratta di una forma clinica più grave. La diagnosi spesso è più tardiva. Il suo aspetto clinico ed otoscopico è meno tipico rispetto alla forma acuta. È presente un’infiammazione diffusa del condotto uditivo esterno, ma la presenza di filamenti, di aree cotonose o nerastre induce spesso in errore. Tuttavia, il mancato miglioramento, o addirittura il peggioramento dei sintomi dopo una terapia antibiotica e corticosteroide locale ben eseguita, attira l’attenzione del medico e permette di porre la diagnosi. In queste forme, i prelievi micologici e batteriologici sono molto utili per confermare la diagnosi. In caso di recidiva alcune settimane dopo il termine delle terapie, o se persiste un’anomalia della cute del condotto, è opportuno ricercare una dermatosi sottostante. In effetti, l’otomicosi può insorgere sulla base di un eczema (atopico, da contatto) o di una psoriasi, la cui diagnosi è difficile a livello del condotto uditivo esterno. In questi casi è necessaria una valutazione clinica da parte di un dermatologo, poiché queste dermatosi richiedono spesso una terapia specifica indipendente da quella dell’otomicosi. Nelle forme croniche, gli agenti fungini possono esercitare la loro patogenicità in due modi differenti: da una parte, con un meccanismo invasivo legato alla penetrazione diretta dei micromiceti negli strati epidermici; dall’altra, con un meccanismo di tipo allergico chiamato micetite, che si verifica in particolare al contatto di micromiceti del genere Aspergillus.




OTOMICOSI ASINTOMATICA
La sua diagnosi è generalmente facile. L’otomicosi viene scoperta in occasione di un’otoscopia sistematica o eseguita per una semplice sensazione di orecchio pieno. L’otoscopia rivela depositi pulverulenti od una massa cotonosa che ostruisce tutto o parte del condotto uditivo esterno. Queste formazioni possono innestarsi su un tappo di cerume. Alcune forme sono colorate: può trattarsi sia di masse biancastre «cotonose o simili alla neve», evocatrici di otomicosi da Candida albicans, sia di secrezioni «nerastre» evocatrici di otomicosi da Aspergillus niger. Dopo la pulizia di questi depositi al microscopio, la cute e la membrana timpanica si rivelano intatte.
OTOMICOSI POSTOPERATORIA Fig.8
La presenza di depositi evocatori di otomicosi nel CUE in fase preoperatoria deve indurre a differire sistematicamente l'intervento: rischio di fallimento della timpanoplastica, di colonizzazione persistente delle cavità dell'orecchio medio e, perfino, di condrite del padiglione.
Lo stravolgimento del microambiente del CUE, le ferite cutanee e l'impiego di gocce auricolari contenenti antibiotici e/o corticosteroidi spiegano la comparsa di un'otomicosi postoperatoria. Si tratta, tuttavia, di una complicanza rara [Hennequin C., Elbez M., Trotoux J., Simonet M. Otomycose à Scopulariopsis brevicaulis après tympanoplastie Ann. Otolaryngol. Chir. Cervicofac. 1994 ; 111 : 353-354 15], che deve essere rapidamente diagnosticata a causa dei rischi di fallimento dell'intervento che essa comporta (necrosi dell'innesto timpanico). Un'otomicosi postoperatoria deve essere sospettata nelle seguenti circostanze:
• segni fortemente suggestivi di otomicosi (presenza di filamenti caratteristici);
• persistenza di una flogosi essudativa del CUE, malgrado il trattamento antibiotico locale postoperatorio.
Il periodo postoperatorio costituisce un fattore di rischio, poiché coesistono il sovvertimento della flora cutanea, la macerazione prodotta dalla medicazione del condotto uditivo esterno e, talvolta, la terapia antibiotica. Qualsiasi recrudescenza del dolore, qualsiasi comparsa di febbre o di otorrea fetida postoperatoria deve condurre allo stamponamento del paziente e ad un esame otoscopico accompagnato da prelievi micologici e batteriologici. L’otomicosi è possibile nel periodo postoperatorio precoce, ma anche diverse settimane dopo
l’intervento. Le cavità radicali non adeguatamente trattate e medicate possono anche essere sede di attecchimenti micotici, con una colonizzazione semplice e il più delle volte poco patogena

Fig.8: Otomicosi riscontrata nel corso del controllo postoperatorio di una paziente operata di stapedectomia.
Otomicosi necrotizzante o maligna Fig.9
L'otite esterna maligna è un'osteomielite dell'osso temporale, il più delle volte dovuta a Pseudomonas aeruginosa, che può infiltrare la base cranica e provocare conseguenze neurologiche gravi che possono mettere a rischio la prognosi quoad vitam. L'otomicosi esterna necrotizzante è stata descritta a più riprese (Petrak R.M., 1985 ; Kountakis S.E., 1997 ; Lesueur A., 1997 ; Lyos A.T., 1993). Il quadro clinico di otomicosi necrotizzante non è differente dalle altre forme «classiche» di otite esterna necrotizzante e la diagnosi è posta al momento del risultato del prelievo microbiologico. L'agente più frequentemente riscontrato è Aspergillus (Petrak R.M., 1985 ; Kountakis S.E., 1997 ; Lesueur A., 1997 ; Lyos A.T., 1993). Sono stati descritti alcuni casi sporadici che coinvolgono agenti più rari (Scedosporium apiospermum, Malassezia sympodiale, blastomicosi)[ Chai F.C., 2000 ; Yao M., 2001 ; Farr R.C., 1992], riscontrati in particolare durante profondi stati immunodepressivi (trapianti di midollo, ecc.). Questa forma molto grave di otomicosi colpisce quasi esclusivamente i soggetti immunodepressi: sindrome da immunodeficienza acquisita (AIDS) e aplasia midollare e, più raramente, diabete.

Fig.9 Otomicosi necrotizzante o maligna
Definizione
Una forma erosiva grave e aggressiva di otite esterna che si verifica in pazienti anziani diabetici e nei pazienti immunocompromessi altrimenti. Questa condizione è spesso fatale se non riconosciuta e trattata con energia in una fase precoce. maligna otite esterna non è maligno nel senso di neoplasia, ma è potenzialmente . letale a causa della diffusione della infezione fulminante che può comportare delle ossa, nervi cranici e il contenuto cranici un titolo migliore descrittivo per questa condizione sarebbe "invasiva otite esterna"! Eziologia L'organismo causativo è Pseudomonas aeruginosa, che è sempre trovato, il paziente è quasi sempre o diabetico o un individuo gravemente immunocompromessi. In questi pazienti non sembra esserci un difetto nel sistema di difesa immunitario che normalmente limitare la capacità invasiva di questo batterio. Sintomi I sintomi iniziali sono quelli di una otite esterna acuta, con dolore locale e di scarico dal canale auricolare. Con il progredire dell'infezione, il dolore diventa abbastanza grave e incessante, e paralisi del nervo cranico può apparire. maligna otite esterna è caratterizzata dalla progressiva diffusione dell'infezione dal canale auricolare nelle strutture adiacenti. Frequentemente, l'infezione si diffonderà nell'osso temporale, causando osteomielite che può estendersi fino alla base del cranio, con conseguente molteplici paralisi dei nervi cranici, meningite, ascesso cerebrale o morte. apparenze otoscopico Il meato è riempito con una secrezione purulenta. La caratteristica di otite esterna maligna è una zona di tessuto di granulazione infetto sul pavimento del canale uditivo cartilagineo vicino alla giunzione tra le porzioni cartilaginee ed ossee del canale come visto qui. Se il tessuto di granulazione viene rimosso, un difetto può essere trovato inseguimento sotto il canale esterno osseo. La cute sovrastante è gonfio e tessuto di granulazione è spesso presente all'interno del canale esterno, derivante dal bivio delle porzioni ossee e cartilaginee. tessuto di granulazione con essudato mucoso è vista derivante dalla giunzione tra le parti ossee e cartilaginee del canale.
Manifestazioni cliniche
La diagnosi può essere generalmente sospettata in presenza di un'otite esterna che resiste parecchie settimane a un trattamento ben condotto. Il CUE e il timpano sono granulomatosi e la perforazione è un evento frequente. Il dolore, che a volte impedisce il riposo notturno, è frequente come anche gli episodi febbrili. La paralisi facciale si osserva più frequentemente nelle otomicosi necrosanti che nelle altre osteomieliti temporali (Bordure P., 2003)).
Esami diagnostici
Di fronte a un quadro clinico sospetto, conviene:
• ricercare un'immunodepressione se non è conosciuta: emocromo con formula leucocitaria, glicemia;
• confermare l'otite esterna necrotizzante con una tomodensitometria: opacità mastoidee e lisi ossea (osso timpanico);
• eseguire una scintigrafia con gallio se gli elementi visualizzati alla TC non sono tipici; questo esame permette di confermare la diagnosi;
• valutare l'estensione dell'otite esterna necrotizzante rispetto ai nervi cranici con una risonanza magnetica (RMN);
• eseguire più campionamenti bioptici, in particolare profondi, per escludere una neoplasia maligna e confermare l'otite esterna necrotizzante (filamenti miceliali intratissutali);
• eseguire un nuovo prelievo micologico e batteriologico per ricercare una colonizzazione plurimicrobica che guiderà il trattamento antibiotico.
Trattamento dell'otite esterna necrotizzante
Il trattamento è urgente e medico-chirurgico (Hall P.J., 1993).
• Terapia medica: il trattamento di riferimento è l'amfotericina B per via parenterale (1 mg/kg/die) per 6 settimane (Hall P.J.,1993 ;Yates P.D.,1997).
• Trattamento chirurgico: mastoidectomia, ablazione dei tessuti necrotici ossei e molli e biopsie profonde multiple. Questo trattamento viene realizzato in caso di complicanze o di evoluzione sfavorevole sotto un trattamento antimicotico ben condotto.
Prognosi dell'otite esterna necrotizzante
La prognosi è riservata per la gravità dell'osteomielite della base cranica e per il contesto su cui essa si sviluppa (immunodepressione spesso severa). Nei casi descritti in letteratura, il 50% dei pazienti è deceduto, di cui la metà direttamente a causa dell'otomicosi necrotizzante (Bordure P., 2003,Petrak R.M., 1985 ; Kountakis S.E., 1997 ; Lesueur A., 1997 ; Lyos A.T., 1993;Chai F.C., 2000 ; Yao M., 2001 ; Farr R.C., 1992, Hall P.J., 1993 ; Upile T., 1997).
Monitoraggio dell'otite esterna necrotizzante
• Controllo clinico: valutazione assidua del CUE, che consente di assicurarsi della normalizzazione progressiva del condotto e del timpano.
• Controllo laboratoristico: velocità di eritrosedimentazione (VES), C reactive protein (CRP), emocromo.
• Diagnostica per immagini: tomodensitometria con mezzo di contrasto realizzata alla 6a settimana.
OTOMICOSI MALIGNA
Queste forme temibili di otomicosi sono molto rare e corrispondono ad un’evoluzione necrotizzante dell’infezione. Si deve temere un’estensione alla mastoide e alla base del cranio. L’agente patogeno è rappresentato quasi esclusivamente dall’Aspergillus, ma una contaminazione con lo Pseudomonas aeruginosa è possibile. Sono riscontrate essenzialmente in pazienti immunodepressi (AIDS) che non presentano altre localizzazioni. Attualmente, la fisiopatologia dell’invasione aspergillare timpanomastoidea si basa solo su alcune ipotesi: contagio di origine sinusale, ematogena, uditiva esterna... Il quadro clinico tipicamente descritto è quello di una otomastoidite subacuta. I dolori e l’otorrea sono intensi e precoci. La comparsa di una paralisi facciale periferica e di una labirintizzazione (sindrome labirintofacciale) è particolarmente evocatrice, ma deve anche far sospettare, in questo contesto, una tubercolosi dell’orecchio. Nelle forme evolute, sono state descritte estensioni dell’osteite alla base del crani. Accanto alle forme classiche che insorgono in pazienti immunodepressi, sono state eccezionalmente descritte forme di otomastoiditi invasive in pazienti non immunodepressi nonché in pazienti che hanno presentato precedentemente l’aspergillosi polmonare.
OTOMICOSI E PERFORAZIONE DEL TIMPANO
La sintomatologia di queste otomicosi è dominata dall’otorrea. Il loro aspetto clinico è simile a quello dell’otomicosi acuta. L’anamnesi, talvolta, può rilevare evidenze di perforazione timpanica presenti da tempo. L’esame otoscopico dimostra, dopo pulizia, una perforazione della membrana timpanica associata ad una reazione infiammatoria della mucosa dell’orecchio medio. Queste forme cliniche pongono un problema terapeutico particolare.


Fig 10Otomicosi con coesistente piccola perforazione del timpano
La combinazione di una perforazione timpanica e di un'otomicosi pone al medico due problemi: escludere un'otite esterna invasiva e adattare il trattamento a questa perforazione che controindica l'uso di molti agenti topici ototossici.
Oltre alle superinfezioni micotiche delle otiti medie croniche a timpano aperto e dei colesteatomi, l'otomicosi inaugurale del CUE può essere complicata da una perforazione timpanica «acuta» detta «chiodo micotico». Questa perforazione è regolare e non marginale al bordo infiammatorio e si verifica, il più delle volte, nel quadrante antero-inferiore [Malard O, Bordure P, Toquet J, Legent F. Otomycose. EMC (Elsevier Masson SAS, Paris), Oto-rhino-laryngologie, 20-080-A-10, 1999 : 7p. 12, Bordure P. Infections fongiques et otologie Rapport sur les mycoses en ORL Paris: Société française d'oto-rhino-laryngologie et de pathologie cervico-faciale (2003). 46-47 17, Ho T., Vrabec J.T., Yoo D., Coker N.J. Otomycosis: clinical features and treatment implications Otolaryngol. Head Neck Surg. 2006 ; 135 : 787-791 [cross-ref] 28]. Dopo l'aspirazione dell'otorrea, la mucosa timpanica visibile attraverso la perforazione è infiammatoria. Esiste un'ipoacusia di trasmissione da media a grave che spesso costituisce il disturbo principale del paziente.
Otomicosi e otite cronica
La superinfezione micotica di un'otite media cronica (Fig. 4) a timpano aperto o di un colesteatoma si può osservare in forma isolata o in associazione con altri germi di comune riscontro in questo contesto (Pseudomonas aeruginosa, Proteus mirabilis, Staphylococcus aureus). Il quadro è abituale (bagni, umidità, rinosinusite) come anche i sintomi clinici (otorrea, infiammazione del CUE, fondo della cassa protuberante e pulsante). Alcuni segni specifici delle micosi si osservano a volte all'inizio (filamenti, depositi neri), ma è più spesso la persistenza dell'otorrea o la comparsa di segni specifici dopo la terapia locale antibiotica ben condotta che porta a realizzare un prelievo microbiologico e a porre la diagnosi di otomicosi.
La terapia locale pone il problema dell'ototossicità di alcuni agenti. Alcuni casi possono, come per le perforazioni acute, richiedere un trattamento per via generale

Fig. 4 : Esacerbazione micotica di un'otite media cronica.
Otomicosi necrotizzante o maligna
L'otite esterna maligna è un'osteomielite dell'osso temporale, il più delle volte dovuta a Pseudomonas aeruginosa, che può infiltrare la base cranica e provocare conseguenze neurologiche gravi che possono mettere a rischio la prognosi quoad vitam. L'otomicosi esterna necrotizzante è stata descritta a più riprese (Petrak R.M., 1985 ; Kountakis S.E., 1997 ; Lesueur A., 1997 ; Lyos A.T., 1993). Il quadro clinico di otomicosi necrotizzante non è differente dalle altre forme «classiche» di otite esterna necrotizzante e la diagnosi è posta al momento del risultato del prelievo microbiologico. L'agente più frequentemente riscontrato è Aspergillus (Petrak R.M., 1985 ; Kountakis S.E., 1997 ; Lesueur A., 1997 ; Lyos A.T., 1993). Sono stati descritti alcuni casi sporadici che coinvolgono agenti più rari (Scedosporium apiospermum, Malassezia sympodiale, blastomicosi)[ Chai F.C., 2000 ; Yao M., 2001 ; Farr R.C., 1992], riscontrati in particolare durante profondi stati immunodepressivi (trapianti di midollo, ecc.). Questa forma molto grave di otomicosi colpisce quasi esclusivamente i soggetti immunodepressi: sindrome da immunodeficienza acquisita (AIDS) e aplasia midollare e, più raramente, diabete.

Otomicosi necrotizzante o maligna
Definizione
Una forma erosiva grave e aggressiva di otite esterna che si verifica in pazienti anziani diabetici e nei pazienti immunocompromessi altrimenti. Questa condizione è spesso fatale se non riconosciuta e trattata con energia in una fase precoce. maligna otite esterna non è maligno nel senso di neoplasia, ma è potenzialmente . letale a causa della diffusione della infezione fulminante che può comportare delle ossa, nervi cranici e il contenuto cranici un titolo migliore descrittivo per questa condizione sarebbe "invasiva otite esterna"! Eziologia L'organismo causativo è Pseudomonas aeruginosa, che è sempre trovato, il paziente è quasi sempre o diabetico o un individuo gravemente immunocompromessi. In questi pazienti non sembra esserci un difetto nel sistema di difesa immunitario che normalmente limitare la capacità invasiva di questo batterio. Sintomi I sintomi iniziali sono quelli di una otite esterna acuta, con dolore locale e di scarico dal canale auricolare. Con il progredire dell'infezione, il dolore diventa abbastanza grave e incessante, e paralisi del nervo cranico può apparire. maligna otite esterna è caratterizzata dalla progressiva diffusione dell'infezione dal canale auricolare nelle strutture adiacenti. Frequentemente, l'infezione si diffonderà nell'osso temporale, causando osteomielite che può estendersi fino alla base del cranio, con conseguente molteplici paralisi dei nervi cranici, meningite, ascesso cerebrale o morte. apparenze otoscopico Il meato è riempito con una secrezione purulenta. La caratteristica di otite esterna maligna è una zona di tessuto di granulazione infetto sul pavimento del canale uditivo cartilagineo vicino alla giunzione tra le porzioni cartilaginee ed ossee del canale come visto qui. Se il tessuto di granulazione viene rimosso, un difetto può essere trovato inseguimento sotto il canale esterno osseo. La cute sovrastante è gonfio e tessuto di granulazione è spesso presente all'interno del canale esterno, derivante dal bivio delle porzioni ossee e cartilaginee. tessuto di granulazione con essudato mucoso è vista derivante dalla giunzione tra le parti ossee e cartilaginee del canale.
Manifestazioni cliniche
La diagnosi può essere generalmente sospettata in presenza di un'otite esterna che resiste parecchie settimane a un trattamento ben condotto. Il CUE e il timpano sono granulomatosi e la perforazione è un evento frequente. Il dolore, che a volte impedisce il riposo notturno, è frequente come anche gli episodi febbrili. La paralisi facciale si osserva più frequentemente nelle otomicosi necrosanti che nelle altre osteomieliti temporali (Bordure P., 2003)).
Esami diagnostici
Di fronte a un quadro clinico sospetto, conviene:
• ricercare un'immunodepressione se non è conosciuta: emocromo con formula leucocitaria, glicemia;
• confermare l'otite esterna necrotizzante con una tomodensitometria: opacità mastoidee e lisi ossea (osso timpanico);
• eseguire una scintigrafia con gallio se gli elementi visualizzati alla TC non sono tipici; questo esame permette di confermare la diagnosi;
• valutare l'estensione dell'otite esterna necrotizzante rispetto ai nervi cranici con una risonanza magnetica (RMN);
• eseguire più campionamenti bioptici, in particolare profondi, per escludere una neoplasia maligna e confermare l'otite esterna necrotizzante (filamenti miceliali intratissutali);
• eseguire un nuovo prelievo micologico e batteriologico per ricercare una colonizzazione plurimicrobica che guiderà il trattamento antibiotico.
Trattamento dell'otite esterna necrotizzante
Il trattamento è urgente e medico-chirurgico (Hall P.J., 1993).
• Terapia medica: il trattamento di riferimento è l'amfotericina B per via parenterale (1 mg/kg/die) per 6 settimane (Hall P.J.,1993 ;Yates P.D.,1997).
• Trattamento chirurgico: mastoidectomia, ablazione dei tessuti necrotici ossei e molli e biopsie profonde multiple. Questo trattamento viene realizzato in caso di complicanze o di evoluzione sfavorevole sotto un trattamento antimicotico ben condotto.
Prognosi dell'otite esterna necrotizzante
La prognosi è riservata per la gravità dell'osteomielite della base cranica e per il contesto su cui essa si sviluppa (immunodepressione spesso severa). Nei casi descritti in letteratura, il 50% dei pazienti è deceduto, di cui la metà direttamente a causa dell'otomicosi necrotizzante (Bordure P., 2003,Petrak R.M., 1985 ; Kountakis S.E., 1997 ; Lesueur A., 1997 ; Lyos A.T., 1993;Chai F.C., 2000 ; Yao M., 2001 ; Farr R.C., 1992, Hall P.J., 1993 ; Upile T., 1997).
Monitoraggio dell'otite esterna necrotizzante
• Controllo clinico: valutazione assidua del CUE, che consente di assicurarsi della normalizzazione progressiva del condotto e del timpano.
• Controllo laboratoristico: velocità di eritrosedimentazione (VES), C reactive protein (CRP), emocromo.
• Diagnostica per immagini: tomodensitometria con mezzo di contrasto realizzata alla 6a settimana.
BIBLIOGRAFIA
Abou-Halawa AS, Khan MA, Alrobaee AA, et al ; Otomycosis with Perforated Tympanic Membrane: Self medication with Topical Antifungal Solution versus Medicated Ear Wick. Int J Health Sci (Qassim). 2012 Jan;6(1):73-7.
Afolabi AO, Kodiya AM, Bakari A, et al ; Attitude of self ear cleaning in black Africans: any benefit? East Afr J Public Health. 2009 Apr;6(1):43-6.
Araiza J., Canseco P., Bonifaz A. Otomycosis: clinical and mycological study of 97 cases Rev. Laryngol. Otol. Rhinol. (Bord.) 2006 ; 127 : 251-254
Attallah MS. Microbiology of chronic suppurative otitis media with cholesteatoma. Saudi Med J. 2000 Oct;21(10):924-7 PubMed
Bambule G., Savary M., Grigri D. Otomycoses Ann. Otolartyngol. Chir. Cervicofac. 1982 ; 99 : 537-540
Baya M, Agut M, Calvo MA Infectious external otitis: etiology in the Terrassa region, culture methods, and considerations on otomycosis. Microbiologia 1994; 10 : 279-284
Bellini C, Antonini P, Ermanni S, Dolina M, Passega E, Bernasconi E. Malignant otitis externa due to Aspergillus niger. Scand J Infect Dis. 2003;35(4):284-8 Article
Bickley LS, Betts RF, Parkins CW. Atypical invasive external otitis from Aspergillus. Arch Otolaryngol Head Neck Surg. 1988 Sep;114(9):1024-8 PubMed
Bokowy C, Cadot M, Lelièvre G. Pathologie acquise de l'oreille externe. Encycl Méd Chir (Elsevier, Paris), Oto-rhino-laryngologie, 20-070-A-10, 1995, 1-14
Bordure P. Infections fongiques et otologie Rapport sur les mycoses en ORL Paris: Société française d'oto-rhino-laryngologie et de pathologie cervico-faciale (2003). 46-47
Bordure P. Écologie microbienne du conduit auditif externe Le conduit auditif externe Paris: ASA (1995).
Bordure P. Les prélèvements bactériologiques au niveau du conduit auditif externe Rapport sur le conduit auditif externe. Société Française d'oto-rhino-laryngologie et de pathologie cervico-faciale Paris: Blackwell-Arnette (1995). 69-70
Bryce GE, Phillips P, Lepawsky M, Gribble MJ. Invasive Aspergillus tympanomastoiditis in an immunocompetent patient. J Otolaryngol. 1997 Aug;26(4):266-9 PubMed
Celebi Erdivanli O, Kazikdas KC, Ozergin Coskun Z, et al ; Skin prick test reactivity in patients with chronic eczematous external otitis. Clin Exp Otorhinolaryngol. 2011 Dec;4(4):174-6. doi: 10.3342/ceo.2011.4.4.174. Epub 2011 Dec 15.
Chai F.C., Auret K., Christiansen K., Yuen P.W., Gardam D. Malignant otitis externa caused by Malassezia sympodialis Head Neck 2000 ; 22 : 87-89 [cross-ref]
Chander J., Maini S., Subrahmanyan S., Handa A. Otomycosis: a clinico-mycological study of efficacy of mercurochrome in its treatment Mycopathologia 1996 ; 135 : 9-12 [cross-ref]
Comacchio F, D'Eredità R, Bison E, Chierichetti F, Ferlin G, Marchiori C. [Value of TC99m-Nanocolloid spect in diagnosis and follow-up of necrotizing external otitis]. Acta Otorhinolaryngol Ital. 1993 Nov-Dec;13(6):517-24 PubMed
Cunningham M, Yu VL, Turner J, Curtin H. Necrotizing otitis externa due to Aspergillus in an immunocompetent patient. Arch Otolaryngol Head Neck Surg. 1988 May;114(5):554-6 Article
Denning DW, Tucker RM, Hanson LH, Stevens DA. Treatment of invasive aspergillosis with itraconazole. Am J Med. 1989 Jun;86(6 Pt 2):791-800 Article
Dinçer AD, Tekeli A, Oztürk S, Turgut S. [Microorganisms isolated from chronic suppurative otitis media and their antimicrobial sensitivities]. Mikrobiyol Bul. 1992 Apr;26(2):131-8 PubMed
Farr R.C., Gardner G., Acker J.D., Brint J.M., Haglund L.F., Land M., e al. Blastomycotic cranial osteomyelitis Am. J. Otol. 1992 ; 13 : 582-586
Finer G, Greenberg D, Leibovitz E, Leiberman A, Shelef I, Kapelushnik J. Conservative treatment of malignant (invasive) external otitis caused by Aspergillus flavus with oral itraconazole solution in a neutropenic patient. Scand J Infect Dis. 2002;34(3):227-9 Article
Garcia M.P., Delgado D., Marin P., Mira J. Analysis of 40 cases of otomycosis Enferm. Infect. Microbiol. Clin. 1993 ; 11 : 487-489
Geaney G.P. Tropical otomycosis J. Laryngol. Otol. 1967 ; 81 : 987-997
Goffin G.B. PH as a factor in external otitis N. Engl. J. Med. 1963 ; 268 : 287-289
Gugnani H.C., Okafor B.C., Nzelibe F., Njoku-Obi A.N. Etiological agents of otomycosis in Nigeria Mycoses 1989 ; 32 : 224-229
Gurr P.A., Evans K., Dewey F.M., Gurr S.J. Otomycosis: the detection of fungi in ears by immunofluorescence microscopy Clin. Otolaryngol. 1997 ; 22 : 275-283
Hall P.J., Farrior J.B. Aspergillus mastoiditis Otolaryngol. Head Neck Surg. 1993 ; 108 : 167-170 [cross-ref]
Hanna E, Hughes G, Eliachar I, Wanamaker J, Tomford W. Fungal osteomyelitis of the temporal bone: a review of reported cases. Ear Nose Throat J. 1993 Aug;72(8):532, 537-41 Article
Harley WB, Dummer JS, Anderson TL, Goodman S. Malignant external otitis due to Aspergillus flavus with fulminant dissemination to the lungs. Clin Infect Dis. 1995 Apr;20(4):1052-4 Article
Hennequin C., Elbez M., Trotoux J., Simonet M. Otomycose à Scopulariopsis brevicaulis après tympanoplastie Ann. Otolaryngol. Chir. Cervicofac. 1994 ; 111 : 353-354
Ho T., Vrabec J.T., Yoo D., Coker N.J. Otomycosis: clinical features and treatment implications Otolaryngol. Head Neck Surg. 2006 ; 135 : 787-791 [cross-ref]
Hurst W.B. Outcome of 22 cases of perforated tympanic membrane caused by otomycosis J. Laryngol. Otol. 2001 ; 115 : 879-880
Hyslop N.E. Ear wax and host defence N. Engl. J. Med. 1971 ; 284 : 1099-1100
Jinnouchi O, Kuwahara T, Ishida S, et al ; Anti-microbial and therapeutic effects of modified Burow's solution on refractory otorrhea. Auris Nasus Larynx. 2012
Kaur R., Mittal N., Kakkar M., Aggarwal A.K., Mathur M.D. Otomycosis: a clinico-mycologic study Ear Nose Throat J. 2000 ; 79 : 606-609
Khanna V, Chander J, Nagarkar NM, Dass A. Clinicomicrobiologic evaluation of active tubotympanic type chronic suppurative otitis media. J Otolaryngol. 2000 Jun;29(3):148-53 PubMed
Kim DG, Hong SC, Kim HJ, Chi JG, Han MH, Choi KS, Han DH. Cerebral aspergillosis in immunologically competent patients. Surg Neurol. 1993 Oct;40(4):326-31 Article
Kujundzic M, Braut T, Manestar D, et al ; Water related otitis externa. Coll Antropol. 2012 Sep;36(3):893-7.
Kountakis S.E., Kemper J.V., Chang C.Y. Di Maio DJ, Stienberg CM. Osteomyelitis of the base of skull secondary to Aspergillus Am. J. Otolaryngol. 1997 ; 18 : 19-22 [cross-ref]
Kurnatowski P., Filipiak A. Otomycosis: prevalence, clinical symptoms, therapeutic procedure Mycoses 2001 ; 44 : 472-479 [cross-ref]
Lamprecht J, Kühn AG, Sauer S. [Aspergillus mastoiditis in infected granulomatosis--a case report]. Laryngorhinootologie. 1990 Jun;69(6):341-4 PubMed
Landry MM, Parkins CW. Calcium oxalate crystal deposition in necrotizing otomycosis caused by Aspergillus niger. Mod Pathol. 1993 Jul;6(4):493-6 PubMed
Latha R, Sasikala R, Muruganandam N ; Chronic otomycosis due to malassezia spp. J Glob Infect Dis. 2010 May;2(2):189-90. doi: 10.4103/0974-777X.62875.
Otitis externa ; NICE CKS, August 2012
Lesueur A., Salmon D., Corlieu P., Ginburg C., Sicard D. Aspergillus niger osteitis of the middle ear in a patient with HIV infection Presse Med. 1997 ; 26 : 1098
Ling SS, Sader C. Fungal malignant otitis externa treated with hyperbaric oxygen. Int J Infect Dis. 2008 Sep;12(5):550-2 Article
Loh KS, Tan KK, Kumarasinghe G, Leong HK, Yeoh KH Otitis externa: the clinical pattern in a tertiary institution in Singapore. Ann Acad Med Singapore 1998; 27 : 215-218
Lyos A.T., Malpica A., Estrada R., Katz C.D., Jenkins H.A. Invasive aspergillosis of the temporal bone: an unusual manifestation of acquired immunodeficiency syndrome Am. J. Otolaryngol. 1993 ; 14 : 444-448 [cross-ref]
Malard O, Bordure P, Toquet J, Legent F. Otomycose. EMC (Elsevier Masson SAS, Paris), Oto-rhino-laryngologie, 20-080-A-10, 1999 : 7p.
Mani R, Belcadhi M, Ben Said M, Bouzouita K. Aspergillus mastoiditis with intact tympanic membrane in immunocompetent host. B-ENT. 2008;4(1):39-43 PubMed
Martínez-Berriotxoa A, Montejo M, Aguirrebengoa K, González de Zárate P, Aguirre C. [Otomastoiditis caused by Aspergillus in AIDS]. Enferm Infecc Microbiol Clin. 1997 Apr;15(4):200-2 PubMed
Menachof MR, Jackler RK. Otogenic skull base osteomyelitis caused by invasive fungal infection. Otolaryngol Head Neck Surg. 1990 Mar;102(3):285-9 Article
Molina UR, Lao LJ, Perella SE, Companya HC, Casamitjana CF Otomycosis. Case reports of 18 months in the General University Hospital of the Valle de Hebron in Barcelona. An Otorrinolaringol Ibero Am 1994
Mugliston T., O'Donoghue G. Otomycosis, a continuing problem J. Laryngol. Otol. 1985 ; 32 : 224-229
Muñoz A, Martínez-Chamorro E. Necrotizing external otitis caused by Aspergillus fumigatus: computed tomography and high resolution magnetic resonance imaging in an AIDS patient. J Laryngol Otol. 1998 Jan;112(1):98-102 Article
Narozny W, Kuczkowski J, Stankiewicz C, Kot J, Mikaszewski B, Przewozny T. Value of hyperbaric oxygen in bacterial and fungal malignant external otitis treatment. Eur Arch Otorhinolaryngol. 2006 Jul;263(7):680-4 Article
No authors listed ; Estimated burden of acute otitis externa --- United States, 2003--2007. MMWR Morb Mortal Wkly Rep. 2011 May 20;60(19):605-9.
Ohki M, Ito K, Ishimoto S. Fungal mastoiditis in an immunocompetent adult. Eur Arch Otorhinolaryngol. 2001 Mar;258(3):106-8 Article
Otitis externa ; NICE CKS, August 2012
Pak MW, Soo G, van Hasselt CA. Flourishing otomycosis. Ear Nose Throat J. 1997 Jan;76(1):10 PubMed
Parize P, Chandesris MO, Lanternier F, Poirée S, Viard JP, Bienvenu B, Mimoun M, Méchai F, Mamzer MF, Herman P, Bougnoux ME, Lecuit M, Lortholary O. Antifungal Therapy of Aspergillus Invasive Otitis Externa: Efficacy of Voriconazole and Review. Antimicrob Agents Chemother. 2009 Mar;53(3):1048-53 Article
Petrak R.M., Pottage J.C., Levin S. Invasive external otitis caused by Aspergillus fumigatus in a immunocompromised host J. Infect. Dis. 1985 ; 151 : 196(letter).
Petrakis N.L., Doherty M., Lee R.E., Smith S.C., Page N.L. Demonstration and implications of lysosyme and immunoglobulins in human ear wax Nature 1971 ; 229 : 119-120 [cross-ref]
Phillips JS, Jones SE. Hyperbaric oxygen as an adjuvant treatment for malignant otitis externa. Cochrane Database Syst Rev. 2005 Apr 18;(2):CD004617 Article
Ress BD, Luntz M, Telischi FF, Balkany TJ, Whiteman ML. Necrotizing external otitis in patients with AIDS. Laryngoscope. 1997 Apr;107(4):456-60 Article
Reiss P, Hadderingh R, Schot LJ, Danner SA. Invasive external otitis caused by Aspergillus fumigatus in two patients with AIDS. AIDS. 1991 May;5(5):605-6 Article
Satish H et al ; A Clinical Study of Otomycosis, IOSR Journal of Dental and Medical Sciences, 2279-0861.Volume 5, Issue 2 (Mar.- Apr. 2013)
Senturia B.A., Marcus M.D., Lucent F.E. Diseases of external ear New York: Grune and Stratton (1980).
Shelton JC, Antonelli PJ, Hackett R. Skull base fungal osteomyelitis in an immunocompetent host. Otolaryngol Head Neck Surg. 2002 Jan;126(1):76-8 PubMed
Slack CL, Watson DW, Abzug MJ, Shaw C, Chan KH. Fungal mastoiditis in immunocompromised children. Arch Otolaryngol Head Neck Surg. 1999 Jan;125(1):73-5 PubMed
Stern J.C., Lucente F.E. Otomycosis Ear Nose Throat J. 1988 ; 67 : 804-810
Strauss M, Fine E. Aspergillus otomastoiditis in acquired immunodeficiency syndrome. Am J Otol. 1991 Jan;12(1):49-53 Article
Tisner J., Millán J., Rivas P., Adiego I., Castellote A., Valles H. Otomycosis and topical application of thimerosal: study of 152 cases Acta Otorrinolaringol. Esp. 1995 ; 46 : 85-89
van Tol A, van Rijswijk J. Aspergillus mastoiditis, presenting with unexplained progressive otalgia, in an immunocompetent (older) patient. Eur Arch Otorhinolaryngol. 2009 Oct;266(10):1655-7. doi: 10.1007/s00405-008-0877-4. Epub 2008 Dec 4 Articl
Vennewald I., Scholebe J., Klemm E. Mycological and histological investigations in humans with middle ear infections Mycoses 2003 ; 46 : 12-18 [cross-ref]
Vennewald I, Klemm E ; Otomycosis: Diagnosis and treatment. Clin Dermatol. 2010 Mar 4;28(2):202-11. doi: 10.1016/j.clindermatol.2009.12.003.
Viswanatha B, Sumatha D, Vijayashree MS ; Otomycosis in immunocompetent and immunocompromised patients: comparative study and literature review. Ear Nose Throat J. 2012 Mar;91(3):114-21.a
Yao M., Messner A.H. Fungal malignant otitis externa due to Scedosporium apiospermium Ann Otol Rhinol Laryngol 2001 ; 110 : 377-380 [cross-ref]
Yates P.D., Upile T., Axon P.R., de Carpentier J. Aspergillus mastoiditis in patient with acquired immunodeficiency syndrome J. Laryngol. Otol. 1997 ; 111 : 560-561