Vestibolopatia post-chirurgica
- Categoria: Vestibolopatie Traumatiche
- Pubblicato: Lunedì, 09 Gennaio 2017 18:01
- Visite: 16554
Chirurgia dell'orecchio e della base cranica laterale: insidie e complicazioni
Bernhard Schick e Julia Dlugaiczyk
ischi e complicazioni sono parte integrante di ogni procedura chirurgica stapedotomia, stapedectomia, impianto cocleare, implantologia odontoiatrica setto rinoplastica.,
DISEQUILIBRIO
La labirintite postoperatoria può influenzare la coclea e / o il labirinto. In generale, i sintomi vestibolari della labirinte assomigliano a quelli della neurite vestibolare. Il paziente mostra una nistagmo spontaneo (SN) orizzontale (rotatorio) battendo direzione (I.) Nell'orecchio interessato in caso di eccitazione vestibolare e (II) nell'orecchio controlaterale in caso di ipofunzione vestibolare. La terapia conservativa comprende (I) la somministrazione sistemica di corticosteroidi e antibiotici con una alta penetrabilità all'orecchio interno (es ceftriaxone) e (II) riabilitazione vestibolare [128]. A seconda del grado di nausea e vomito, dovrebbe essere considerato. fluidi / elettroliti e farmaci antiemetici per IV
È necessario un intervento chirurgico di revisione se un SN verso l'orecchio controlaterale e / o SNHL acuta si osservano nel periodo postoperatorio. Il chirurgo dovrebbe rimuovere tutti i corpi estranei (ad esempio protesi dell'orecchio medio) in questi casi e verificare la presenza di un difetto della capsula otica (fistola labirintica). Inoltre, è raccomandato [34] sigillare la finestra ovale e rotonda
Una fistola labirintica tra orecchio medio e interno (ad esempio presso il SCC orizzontale, finestra rotonda / ovale) è caratterizzata da brevi attacchi di vertigini rotatoria durante i cambiamenti di pressione nel liquido cerebrospinale (CSF) - e quindi della perilinfa. Gli attacchi possono essere scatenati ad esempio da starnuti, tosse, spingendo e sollevamento pesi pesanti. Se questi sintomi sono presenti, l’ otochirurgo orecchio deve verificare eventuali segni fistola, come il nistagmo provocato da (I) variazioni di pressione nel EAC (ad esempio mediante l'applicazione di un otoscopio Politzer) o (II) la transizione dalla posizione seduta a posizione supina e viceversa . La fistola deve essere identificata e sigillata (ad esempio con il tessuto connettivo e / o polvere di osso). Durante la chirurgia, corticosteroidi e ceftriaxone devono essere somministrate per via iv per proteggere la funzione dell'orecchio interno [2], [3].
Inoltre, si può osservare vertigine parossistica posizionale benigna (VPPB) conseguente alla chirurgia dell'orecchio. In base alle vibrazioni utilizzate per la perforazione della platina queste possono provocare il distacco degli otoliti dalla macula utriculare [129]. [2], [130], [131], [132], [133], [134], [135] come la variante idiopatica.
In caso di deficit vestibolare permanente dopo chirurgia dell'orecchio, il paziente dovrebbe ricevere una formazione di riabilitazione vestibolare, al fine di (i) promuovere la compensazione vestibolare centrale e (ii) induce somatosensoriale / sostituzione visivo [136]. Esercizi vestibolari hanno dimostrato di migliorare il risarcimento centrale a seguito di una perdita unilaterale di funzione vestibolare [137].
Segni e sintomi vestibolari non sempre si verificano nel periodo postoperatorio, ma possono anche evolvere dopo un intervallo senza sintomi, per esempio dopo un intervento chirurgico di impianto cocleare (si veda anche il capitolo 5.2.2.2). In questi casi, può essere difficile stabilire se i problemi di equilibrio sono dovuti alla chirurgia o una causa indipendente. In ogni caso, è consigliabile per il chirurgo orecchio di accedere a tutta la gamma di diagnosi e terapia neurotological per fornire la cura ottimale per i pazienti con problemi vestibolari dopo intervento chirurgico dell'orecchio / base cranica laterale.
Cosa fare in caso di una complicazione
L'atteggiamento del chirurgo in caso di una complicanza intra / postoperatoria è estremamente importante per il paziente interessato. Inoltre, una gestione onesta e professionale di complicanze può aiutare a prevenire le controversie legali [1]. Soprattutto, è essenziale mantenere un rapporto fedele tra il chirurgo e il paziente. Per raggiungere questo scopo, i seguenti suggerimenti dovrebbero essere considerati: il chirurgo deve (I) curare il paziente stesso, (II) spiegare onestamente al paziente quanto è accaduto e (III) trattare la complicazione in modo che il paziente possa capire. La condivisione delle informazioni con i parenti del paziente - dopo aver ottenuto il permesso del paziente di farlo - può anche aiutare a stabilizzare la situazione. Se nessuna comunicazione personale con il paziente è possibile dopo una complicazione grave, il chirurgo deve tentare di venire a contatto con la famiglia del paziente appena possibile.
Disequilibrio
Apertura intraoperatoria del vestibolo durante chirurgia della staffa comporta il rischio di indurre disfunzione vestibolare. In questo contesto, il chirurgo deve tenere a mente che i segni e sintomi vestibolari non mostrano necessariamente una correlazione perfetta [176], [177]. I pochi studi sui disturbi dell'equilibrio dopo chirurgia della staffa sono difficili da confrontare tra di loro a causa delle diverse tecniche chirurgiche e periodi di follow-up post-operatorio. Inoltre, è da notare che segni e sintomi vestibolari potrebbero essere stati presenti prima di chirurgia della staffa [176].
I primi sintomi vestibolari (per esempio vertigini, inclinando / sensazione di galleggiamento, vertigini) dopo chirurgia della staffa sono stati segnalati da 52% [177] e 82% [178] dei pazienti in studi recenti. Di solito, una risoluzione completa dei sintomi viene osservato entro la prima settimana postoperatoria. Solo il 3% dei pazienti ancora descritto una sensazione di vertigine un mese dopo stapedotomia [176]. Al contrario, in studi precedenti[179], il 30% dei pazienti ha manifestato sintomi vestibolari tre mesi dopo stapedectomia .
I sintomi vestibolari comprendono (I), vertigini rotatorie e non rotatorie (ad esempio a dondolo, ondeggiando, inclinando, ondeggiando, rimbalzando) e (II) vertigini / stordimento [177]. Il chirurgo orecchio dovrebbe essere in grado di distinguere tra i quattro seguenti sindromi vestibolari seguenti chirurgia della staffa: eccitazione vestibolare, ipofunzione vestibolare, VPPB e perilymph fistole (per i dettagli si veda il capitolo 4.3 e [2]). Segni vestibolari postoperatorie includono: (I) nistagmo (spontanea, testa-agitazione, posizionale / posizionamento, indotta da pressione), (II) inclinata soggettivo visivo orizzontale / verticale, (III) VEMPs asimmetrici e / o risposte calorici e (IV) anormali risultati Funzione / posturografia vestibulospinal.
In caso di eccitazione vestibolare dopo chirurgia della staffa, nistagmo batte verso l'orecchio operato, mentre un nistagmo si osserva dal lato contralaterale per ipofunzione vestibolare [177], [176]. Inoltre, una risposta calorico ridotta sul lato dell'orecchio operato indica un deficit vestibolare [180]. Inclinazione della visuale orizzontale soggettivo dal lato operato è stato interpretato come un segno per una maggiore attività degli organi otoliti in seguito a manipolazione chirurgica del vestibolo [181]. Inoltre, il calcolo con la posturografia dinamico rileva un deficit vestibolare funzionale transitorio dopo chirurgia della staffa [178].
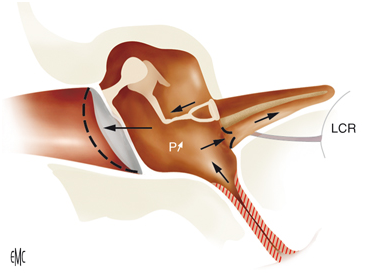
La relazione anatomica tra pedana della staffa, utriculo e sacculo è la chiave per comprendere il meccanismo patogenetico di disfunzione vestibolare dopo chirurgia della staffa. Recenti studi micro-TAC hanno confermato che la distanza minima tra la pedana staffa e epitelio vestibolare si trova nella parte posteriore della macula utricolare (distanza: 0,61 mm in media; si veda la Figura 1 (figura 4).) [182]. Pertanto, l’ utriculo è particolarmente a rischio, quando la protesi della staffa sporge troppo in profondità nel vestibolo, può essere causa (I) di eccitazione vestibolare cronica [181] o (II) di un deficit vestibolare permanente a causa dei danni dell'epitelio vestibolare. Inoltre, una ipofunzione vestibolare persistente dopo chirurgia della staffa può essere dovuto alla labirintite e / o perdita di perilinfa [177], [178], [183].
Figura 1

Ricostruzione tridimensionale (3D) di immagini micro-TC da dell'osso temporale umano illustra la relazione spaziale tra pedana staffa / pistone, utriculo e sacculo (in precedenza i dati non pubblicati, per gentile concessione di Ian Curthoys e Payal Mukherjee, Università di Sydney, Australia) . a) vista di un pistone della staffa (profondità di inserimento:. 0,25 millimetri) rispetto alla platina della staffa (verde), macula utricolare (azzurra) e macula sacculare (arancione). Le strutture membranose dell’ utriculo e sacculo sono mostrati, rispettivamente, in blu scuro e rosso,. b.) ricostruzione 3D della staffa (verde), utricolo (azzurro) e macula sacculare (arancione). Entrambi i dati mostrano che la macula posteriore utriculare si trova più vicino alla platina della staffa (per i dettagli vedi [182].
BPPV Postoperatoria, è stato descritta nel 6,1% [184] e 8,5% [185] dei casi, può risultare da frammenti (I) ossei della platina della staffa che rientrano nello spazio perilinfatico (II) o dal distacco degli otoliti dalla membrana utricolare a causa delle vibrazioni dovute al trapano. A questo punto, si deve notare che lo sviluppo dei sintomi VPPB può essere ritardata dopo chirurgia staffa [184], [185].
Le fistole Perilinfatiche si presentano con attacchi di vertigine indotta da pressione / o una SNHL fluttuante può essere causato da (I) un sigillo che fuoriesce dalla fenestrazione della finestra ovale o (II) dalla migrazione della protesi conseguente a lacerazione della neomembrane della finestra ovale [176]. Il chirurgo deve essere a conoscenza del fatto che una fistola perilinfatica si può verificare con una latenza di 12 a 15 anni dopo l'intervento chirurgico staffa [186].
Nel caso in cui un paziente si lamenta di vertigini / capogiri nel periodo postoperatorio, il chirurgo orecchio dovrebbe verificare la presenza di nistagmo e eseguire il test diapason Weber. In ogni caso, la pressione della guarnizione nel canale uditivo deve essere rilassato. BPPV è trattato con le ben note manovre liberatorio / ricollocamento (si veda anche il capitolo 4.3). Il trattamento conservativo di vestibolare eccitazione / ipofunzione e sospetta fistola perilymph comprende la somministrazione sistemica di corticosteroidi e antibiotici con un alto penetrabilità all'orecchio interno (ad esempio, ceftriaxone). Se i sintomi persistono nonostante queste misure conservative, revisione chirurgica deve essere effettuata immediatamente [187].
HRCT ha un alto valore diagnostico nel processo decisionale per la revisione staffa a causa di vertigini post-operatorio. Per esempio, una dislocazione del pistone nel vestibolo, un pneumolabirintite indica una fistola perilinfatica, appena formata sui foci otosclerotici, aderenze fibrose e difetti della protesi staffa sono visibili sulle immagini CT [188]. In sintesi, la sinossi del segni / sintomi oto neurotologici ed i reperti della TAC aiutano il chirurgo a decidere per il trattamento ottimale delle vertigini dopo chirurgia della staffa (conservativo / chirurgica) in ogni singolo caso [1]. Tuttavia, va tenuto presente che la profondità di inserimento del pistone staffa è spesso sovrastimato dalla TAC e tomografia di rotazione [189].
In una serie di 175 pazienti, revisione staffa è stata eseguita per vertigini postoperatorio in 16 casi (8%) [146]. Risultati intraoperatori inclusi: un pistone troppo lungo, la mobilità eccessiva del pistone dovuti allo spostamento dell’incudine e irritazione della macula utricular dovuta al pistone [146].
Se è prevista chirurgia della staffa del secondo orecchio, si deve tenere in considerazione che la disfunzione vestibolare dopo chirurgia del primo dell'orecchio potrebbe essere presente, ma completamente asintomatica. Pertanto, un esame oto neurotologico completo (compreso irrigazione calorica, VOR e VEMPs) deve essere effettuata prima di ogni chirurgia della staffa del secondo orecchio, in particolare al fine di valutare il potenziale di risarcimento in caso di ipofunzione vestibolare vestibolare postoperatoria.
CHIRURGIA DA IMPIANTO COCLEARE
Chirurgia impianto cocleare è considerato essere un procedure5.2.2 molto sicuro e affidabile
complicanze minori
5.2.2.1 Tinnitus
Sviluppo di tinnito dopo l'intervento chirurgico di impianto cocleare è rara: 0,7% (n = 438) e 1,9% (n = 262) degli utenti CI riferito tinnito dopo l'intervento [209], [239].
5.2.2.2 Vertigo / vertigini
Anche se il miglioramento della funzione vestibolare dopo l'impianto cocleare è stata riportata [ 249 ] , disfunzioni vestibolari è un aspetto importante nella cura post-operatoria di impiantati cocleari. Come già detto nel capitolo 2.2, il medico deve distinguere tra soggettive sintomi vestibolari e segni vestibolari oggettivi, che non sempre sono correlate tra loro perfettamente[ 6 ].
Vertigini transitoria e disequilibrio sono stati descritti come la complicanza più frequente minore dopo l'intervento chirurgico di impianto cocleare [ 217 ] . La prevalenza di sintomi vestibolari postoperatorio è stato segnalato per un range tra 0,33-75% [ 250 ], con valori compresi tra 30 e 60% in maggior parte degli studi [5]. Omolaterale debolezza calorico dopo impianto cocleare è stata osservata in 16 al 50% dei casi[ 4 ], [ 6 ], [ 250 ], [ 251 ], [ 252 ].
E 'importante considerare i diversi disegni di studio e periodi di osservazione al fine di valutare in modo adeguato questi valori. Vertigini e disturbi dell’equilibrio possono verificarsi nel periodo postoperatorio o dopo una latenza di settimane o mesi[ 5 ], [ 253 ]. Inoltre, devono essere distinte le diverse presentazioni cliniche che vanno da un singolo episodio di vertigine fino ad attacchi di vertigini ricorrenti o squilibrio persistente [ 5 ].
Uno sguardo più da vicino dei meccanismi patologici alla base aiuta a comprendere le diverse qualità e l’andamento nel tempo della disfunzione vestibolare dopo l'impianto cocleare. Questi modelli si basano su entrambe le osservazioni cliniche e studi dell'osso temporale[ 254 ], [ 255 ]. Grazie all'anatomia dell'orecchio interno, il rischio di lesioni intraoperatoria è più alto per la sacculo, seguito dal utriculo e canali semicircolari. L’Inserimento della matrice degli elettrodi nella coclea può danneggiare l'epitelio sensoriale vestibolare [ 255 ]. Inoltre, una perdita di perilinfa può verificarsi durante la cocleostomia. Entrambi i meccanismi sono in grado di spiegare l'osservazione clinica di una sindrome vestibolare acuta subito dopo l'operazione.
La BBPV, che si osserva in 2.2 al 10% dei pazienti dopo l'impianto cocleare[ 256 ], [ 257 ], può essere causato sia dalle polveri (I) dell’osso cadute nel labirinto o (II) od alla dislocazione degli otoliti associata alla vibrazione del trapano (vedi anche capitoli 4.3 e 5.1.4). Inoltre, l'attivazione dell'impianto è stato discusso come un trigger per lo spostamento dell'otolite. Si noti che adulti e bambini possono essere colpiti da VPPB dopo l'impianto cocleare [ 258 ].
Studi post mortem sulle ossa temporali impiantati cocleari hanno rivelato vari cambiamenti cronici dell'organo vestibolare (ad esempio fibrosi del vestibolo, osteogenesi, neuroma reattiva), che sono stati interpretati come sequele di labirintiti, reazione da corpo estraneo o lesione vascolare [ 255 ]. Il tempo intercorso per queste reazioni fisiopatologiche può spiegare l'insorgenza ritardata di sintomi vestibolari in alcuni utenti di CI dopo un intervallo libero da sintomi iniziali nel periodo postoperatorio. A questo punto è opportuno ricordare che i cambiamenti cronici sopra descritti sono stati osservati soltanto se l'elettrodo era stato inserito nella scala del vestibolo. Pertanto, il chirurgo dovrebbe mirare a posizionare l'elettrodo all'interno delle scala timpanica non solo per motivi audiologici, ma anche per motivi vestibolari. Inoltre, idrope endolinfatica è stata rilevata negli studi dell'osso temporale dopo l'impianto cocleare, che è considerato essere il correlato istologico per l'osservazione clinica di attacchi vertiginosi e Menière simili nei destinatari di CI [ 254 ].
Alcuni pazienti provano vertigini / disequilibrio se esposti a rumori forti, a condizione che l'impianto sia attivo. In questi casi, deve essere considerato una co-stimolazione cocleare e vestibolare [ 259 ]. D'altra parte, gli attacchi di vertigine indotte a breve da pressione (ad esempio provocati da starnuti, tosse, sollevamento pesi pesanti) possono essere causati da una fistola perilinfatica a causa di una sigillatura insufficiente della cocleostomia .
In sintesi, la pletora di cause alla base per la disfunzione vestibolare impiantati cocleare richiede un accurato work-up neurotologico. Le opzioni terapeutiche includono: manovre di riposizionamento per VPPB, riabilitazione vestibolare per ipofunzione vestibolare acuta e cronica [ 214 ] e timpanotomia nei casi di una sospetta fistola perilinfa.
Chirurgia Soft è generalmente consigliato di ridurre le complicanze associate alla vestibolari impianto cocleare. In questo contesto, diversi studi hanno confrontato postoperatorio funzione vestibolare dopo anteriore cocleostomia contro l'inserimento finestra rotonda dell'elettrodo. Un decremento postoperatoria della funzionalità SCC saccular e orizzontale stata osservata più frequentemente seguente cocleostomia anteriore (50% e 43%) rispetto all'inserimento finestra rotonda (13% e 9%)[ 260 ]. Inoltre, l'applicazione locale di metilprednisolone alla membrana della finestra rotonda durante la chirurgia CI è stato raccomandato per ridurre l'incidenza di sintomi vestibolari postoperatorie[ 261 ].
Purtroppo, non predittori preoperatoria della funzione vestibolare postoperatoria sono stati identificati fino ad oggi [ 262 ]. In particolare, si deve notare che una disfunzione vestibolare cronica può essere presente dopo l'intervento di impianto cocleare, anche se il paziente non ha sintomi soggettivi o ha recuperato rapidamente di vertigini postoperatoria [ 263 ].
L’otochirurgo dovrebbe sempre tenere a mente che i problemi vestibolari possono avere un forte impatto sulla qualità della vita degli utenti del CI. E’ consigliata una rivalutazione vestibolare prima di un intervento chirurgico di impianto cocleare del secondo orecchio (vedi capitolo 2.2 e 5.1.4), al fine di bilanciare i possibili benefici di un udito bilaterale contro il rischio di una vestibulopatia bilaterale. Questo aspetto merita particolare attenzione nella discussione sull’impianto cocleare bilaterale simultaneo [ 9 ].
Riferimenti
1. Linder TE, Lin F. Felsenbeinchirurgie. Komplikationen und unerwünschte Operationsfolgen. HNO. 2011; 59 :974–979. doi: 10.1007/s00106-011-2359-z. Available from: http://dx.doi.org/10.1007/s00106-011-2359-z . [ PubMed ] [ Cross Ref ]
2. Dlugaiczyk J, Schick B. Klinische Differenzialdiagnose vestibulärer Symptome. CME Hals Nasen Ohrenheilkd. 2010; 3 :128–149.
3. Haid CT. Vestibularisprüfung und vestibuläre Erkrankungen. Berlin, Heidelberg, New York: Springer-Verlag; 1990. Available from: http://dx.doi.org/10.1007/978-3-662-10791-1 . [ Cross Ref ]
4. Enticott JC, Tari S, Koh SM, Dowell RC, O'Leary SJ. Cochlear implant and vestibular function. Otol Neurotol. 2006 Sep; 27 (6):824–830. doi: 10.1097/01.mao.0000227903.47483.a6. Available from: http://dx.doi.org/10.1097/01.mao.0000227903.47483.a6 . [ PubMed ] [ Cross Ref ]
5. Fina M, Skinner M, Goebel JA, Piccirillo JF, Neely JG, Black O. Vestibular dysfunction after cochlear implantation. Otol Neurotol. 2003 Mar; 24 (2):234–242. doi: 10.1097/00129492-200303000-00018. Available from: http://dx.doi.org/10.1097/00129492-200303000-00018 . [ PubMed ] [ Cross Ref ]
6. Krause E, Louza JP, Wechtenbruch J, Gürkov R. Influence of cochlear implantation on peripheral vestibular receptor function. Otolaryngol Head Neck Surg. 2010 Jun; 142 (6):809–813. doi: 10.1016/j.otohns.2010.01.017. Available from: http://dx.doi.org/10.1016/j.otohns.2010.01.017 . [ PubMed ] [ Cross Ref ]
7. Melvin TA, Della Santina CC, Carey JP, Migliaccio AA. The effects of cochlear implantation on vestibular function. Otol Neurotol. 2009 Jan; 30 (1):87–94. doi: 10.1097/MAO.0b013e31818d1cba. Available from: http://dx.doi.org/10.1097/MAO.0b013e31818d1cba . [ PMC free article ] [ PubMed ] [ Cross Ref ]
8. Santina CC. Vestibular function and cochlear implantation. In: Niparko JK, editor. Cochlear implants. Principles & Practices. 2nd ed. Philadelphia: Lippincott Williams & Wilkins; 2009. pp. 187–190.
9. Wiener-Vacher S. Letter to the Editor. Int J Ped Otorhinolaryngol. 2010; 74 :105–106. doi: 10.1016/j.ijporl.2009.10.018. Available from: http://dx.doi.org/10.1016/j.ijporl.2009.10.018 . [ PubMed ] [ Cross Ref ]
10. Magnusson M, Kahlon B, Karlberg M, Lindberg S, Siesjö P. Preoperative vestibular ablation with gentamicin and vestibular 'prehab' enhance postoperative recovery after surgery for pontine angle tumours--first report. Acta Otolaryngol. 2007 Dec; 127 (12):1236–1240. doi: 10.1080/00016480701663433. Available from: http://dx.doi.org/10.1080/00016480701663433 . [ PubMed ] [ Cross Ref ]
11. Martin HC, Sethi J, Lang D, Neil-Dwyer G, Lutman ME, Yardley L. Patient-assessed outcomes after excision of acoustic neuroma: postoperative symptoms and quality of life. J Neurosurg. 2001 Feb; 94 (2):211–216. doi: 10.3171/jns.2001.94.2.0211. Available from: http://dx.doi.org/10.3171/jns.2001.94.2.0211 . [ PubMed ] [ Cross Ref ]
12. Nielsen A. Acoustic tumors: with special reference to end-results and sparing of the facial nerve. Ann Surg. 1942 May; 115 (5):849–863. doi: 10.1097/00000658-194205000-00015. Available from: http://dx.doi.org/10.1097/00000658-194205000-00015 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
13. Tufarelli D, Meli A, Alesii A, De Angelis E, Badaracco C, Falcioni M, Sanna M. Quality of life after acoustic neuroma surgery. Otol Neurotol. 2006 Apr; 27 (3):403–409. doi: 10.1097/00129492-200604000-00018. Available from: http://dx.doi.org/10.1097/00129492-200604000-00018 . [ PubMed ] [ Cross Ref ]
14. Youssef AS, Downes AE. Intraoperative neurophysiological monitoring in vestibular schwannoma surgery: advances and clinical implications. Neurosurg Focus. 2009 Oct; 27 (4):E9. doi: 10.3171/2009.8.FOCUS09144. Available from: http://dx.doi.org/10.3171/2009.8.FOCUS09144 . [ PubMed ] [ Cross Ref ]
15. Murphy EK. Use of an infrared camera to improve the outcome of facial nerve monitoring. Am J Electroneurodiagnostic Technol. 2008 Mar; 48 (1):38–47. [ PubMed ]
16. Brackmann DE, Cullen RD, Fisher LM. Facial nerve function after translabyrinthine vestibular schwannoma surgery. Otolaryngol Head Neck Surg. 2007 May; 136 (5):773–777. doi: 10.1016/j.otohns.2006.10.009. Available from: http://dx.doi.org/10.1016/j.otohns.2006.10.009 . [ PubMed ] [ Cross Ref ]
17. Samii M, Gerganov VM, Samii A. Functional outcome after complete surgical removal of giant vestibular schwannomas. J Neurosurg. 2010 Apr; 112 (4):860–867. doi: 10.3171/2009.7.JNS0989. Available from: http://dx.doi.org/10.3171/2009.7.JNS0989 . [ PubMed ] [ Cross Ref ]
25. Kontorinis G, Goetz F, Giourgas A, Lenarz T, Lanfermann H, Giesemann AM. Radiological diagnosis of incomplete partition type I versus type II: significance for cochlear implantation. Eur Radiol. 2012 Mar; 22 (3):525–532. doi: 10.1007/s00330-011-2301-5. Available from: http://dx.doi.org/10.1007/s00330-011-2301-5 . [ PubMed ] [ Cross Ref ]
26. Hara M, Takahashi H, Kanda Y. The usefulness of reconstructed 3D images in surgical planning for cochlear implantation in a malformed ear with an abnormal course of the facial nerve. Clin Exp Otorhinolaryngol. 2012; 5 (Suppl. 01):48–52. doi: 10.3342/ceo.2012.5.S1.S48. Available from: http://dx.doi.org/10.3342/ceo.2012.5.S1.S48 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
27. Song JJ, Park JH, Jang JH, Lee JH, Oh SH, Chang SO, Kim CS. Facial nerve aberrations encountered during cochlear implantation. Acta Otolaryngol. 2012 Jul; 132 (7):788–794. doi: 10.3109/00016489.2012.656765. Available from: http://dx.doi.org/10.3109/00016489.2012.656765 . [ PubMed ] [ Cross Ref ]
28. Aschendorff A, Laszig R, Maier W, Beck R, Schild C, Birkenhäger R, Wesarg T, Kröger S, Arndt S. Kochleaimplantat bei Innenohrfehlbildungen. HNO. 2009; 57 :533–541. doi: 10.1007/s00106-009-1936-x. Available from: http://dx.doi.org/10.1007/s00106-009-1936-x . [ PubMed ] [ Cross Ref ]
29. Aschendorff A. Imaging bei Cochlear-Implant-Patienten. Laryngo Rhino Otol. 2011; 90 :S16–S21. doi: 10.1055/s-0030-1270448. Available from: http://dx.doi.org/10.1055/s-0030-1270448 . [ PubMed ] [ Cross Ref ]
30. AWMF online. Leitlinien der Deutschen Röntgengesellschaft. Radiologische Diagnostik im Kopf-Hals-Bereich. Schläfenbein. Nichttraumatische periphere Fazialisparese.
31. Rubin LG, Papsin B. Cochlear implants in children: surgical site infections and prevention and treatment of acute otitis media and meningitis. Pediatrics. 2010 Aug; 126 (2):381–391. doi: 10.1542/peds.2010-1427. Available from: http://dx.doi.org/10.1542/peds.2010-1427 . [ PubMed ] [ Cross Ref ]
32. Merkus P, van Loon MC, Smit CF, Smits C, de Cock AF, Hensen EF. Decision making in advanced otosclerosis: an evidence-based strategy. Laryngoscope. 2011 Sep; 121 (9):1935–1941. doi: 10.1002/lary.21904. Available from: http://dx.doi.org/10.1002/lary.21904 . [ PubMed ] [ Cross Ref ]
33. Sanna M, Pandya Y, Mancini F, Sequino G, Piccirillo E. Petrous bone cholesteatoma: classification, management and review of the literature. Audiol Neurotol. 2011; 16 :124–136. doi: 10.1159/000315900. Available from: http://dx.doi.org/10.1159/000315900 . [ PubMed ] [ Cross Ref ]
34. Schwager K. Akute Komplikationen in der Mittelohrchirurgie. Teil 1: Probleme während der Tympanoplastik - was tun? HNO. 2007; 55 :307–317. doi: 10.1007/s00106-006-1527-z. Available from: http://dx.doi.org/10.1007/s00106-006-1527-z . [ PubMed ] [ Cross Ref ]
35. Yeh JS, Mooney KL, Gingrich K, Kim JT, Lalwani AK. Anesthetic complications in pediatric patients undergoing cochlear implantation. Laryngoscope. 2011 Oct; 121 (10):2240–2244. doi: 10.1002/lary.21924. Available from: http://dx.doi.org/10.1002/lary.21924 . [ PubMed ] [ Cross Ref ]
36. Wolfson A, Swamidoss C. Accidental subcutaneous remifentanil infusion as a cause of delayed awakening after craniotomy. Case Rep Anesthesiol. 2011; 2011 :919067. doi: 10.1155/2011/919067. Available from: http://dx.doi.org/10.1155/2011/919067 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
37. Fisch U. Tympanoplasty, Mastoidectomy and Stapes Surgery. Thieme-Verlag; 1994.
38. Yuan YY, Song YS, Chai CM, Shen WD, Han WJ, Liu J, Wang GJ, Dong TX, Han DY, Dai P. Intraoperative CT-guided cochlear implantation in congenital ear deformity. Acta Otolaryngol. 2012 Sep; 132 (9):951–958. doi: 10.3109/00016489.2012.674214. Available from: http://dx.doi.org/10.3109/00016489.2012.674214 . [ PubMed ] [ Cross Ref ]
39. Struffert T, Hertel V, Kyriakou Y, Krause J, Engelhorn T, Schick B, Iro H, Hornung J, Doerfler A. Imaging of cohlear implant electrode array with falt-detection CT and conventional multi-slice CT: comparison of image qualities and radiation dose. Acta Otolaryngol. 2010; 130 :443–452. doi: 10.3109/00016480903292700. Available from: http://dx.doi.org/10.3109/00016480903292700 . [ PubMed ] [ Cross Ref ]
40. Hertel V, Hornung J, Hoppe U, Zenk J, Iro H. Sprachverständnis nach Cochlea Implantation über Rundfenstermembraninsertion - Erlanger Erfahrungen. 82. Jahresversammlung der Deutschen Gesellschaft für Hals-Nasen-Ohren-Heilkunde, Kopf- und Hals-Chirurgie; 01.-05.06.2011; Freiburg i. Br.. Düsseldorf: German Medical Science GMS Publishing House; 2011. p. Doc11hnod357. Available from: http://dx.doi.org/10.3205/11hnod357 . [ Cross Ref ]
41. Aschendorff A, Maier W, Jaekel K, Wesarg T, Arndt S, Laszig R, Voss P, Metzger M, Schulze D. Radiologically assisted navigation in cochlear implantation for X-linked deafness malformation. Cochlear Implants Int. 2009; 10 (Suppl 1):14–18. doi: 10.1002/cii.379. Available from: http://dx.doi.org/10.1002/cii.379 . [ PubMed ] [ Cross Ref ]
42. Stelter K, Ledderose G, Hempel JM, Morhard DF, Flatz W, Krause E, Mueller J. Image guided navigation by intraoperative CT scan for cochlear implantation. Comput Aided Surg. 2012; 17 (3):153–160. doi: 10.3109/10929088.2012.668937. Available from: http://dx.doi.org/10.3109/10929088.2012.668937 . [ PubMed ] [ Cross Ref ]
43. Bellucci R. Iatrogenic surgical trauma in otology. J Laryngol Otol. 1983; 8 :13–17. [ PubMed ]
44. Hüttenbrink KB. Manipulating the mobile stapes during tympanoplasty: the risk of stapedial luxation. Laryngoscope. 1993 Jun; 103 (6):668–672. doi: 10.1288/00005537-199306000-00016. Available from: http://dx.doi.org/10.1288/00005537-199306000-00016 . [ PubMed ] [ Cross Ref ]
45. Milewski C, Dornhoffer J, De Meester C. Möglichkeiten des Hörerhalts bei Labyrinth-Fisteln von unterschiedlichem Schweregrad. Laryngo Rhino Otol. 1995; 74 :408–412. doi: 10.1055/s-2007-997770. Available from: http://dx.doi.org/10.1055/s-2007-997770 . [ PubMed ] [ Cross Ref ]
46. Helms J. Acoustic trauma from the bone cutting burr. J Laryngol Otolo. 1976; 90 :1143–1149. doi: 10.1017/S0022215100083225. Available from: http://dx.doi.org/10.1017/S0022215100083225 . [ PubMed ] [ Cross Ref ]
47. Pau HW, Just T, Bornitz M, Lasurashvilli N, Zahnert T. Noise exposure of the inner ear during drilling a cochleostomy for cochlea implantation. Laryngoscope. 2007; 117 :535–540. doi: 10.1097/MLG.0b013e31802f4169. Available from: http://dx.doi.org/10.1097/MLG.0b013e31802f4169 . [ PubMed ] [ Cross Ref ]
48. Punke C, Zehlicke T, Sievert U, Pau HW. Akustisch-mechanisches Trauma während einer Cochleostomie. HNO. 2011; 59 :570–574. doi: 10.1007/s00106-010-2257-9. Available from: http://dx.doi.org/10.1007/s00106-010-2257-9 . [ PubMed ] [ Cross Ref ]
49. Kylén P, Stjernvall JE, Arlinger S. Variables affecting the drill-generated noise levels in ear surgery. Acta Otolaryngol. 1977 Sep-Oct; 84 (3-4):252–259. doi: 10.3109/00016487709123964. Available from: http://dx.doi.org/10.3109/00016487709123964 . [ PubMed ] [ Cross Ref ]
50. Paparella MM, Morizono T, Le CT, Mancini F, Sipilä P, Choo YB, Lidén G, Kim CS. Sensorineural hearing loss in otitis media. Ann Otol Rhinol Laryngol. 1984 Nov-Dec; 93 (6 Pt 1):623–629. [ PubMed ]
51. Gjuric M, Schneider W, Buhr W, Wolf SR, Wigand ME. Experimental sensorineural hearing loss following drill-induced ossicular chain injury. Acta Otolaryngol. 1997 Jul; 117 (4):497–500. doi: 10.3109/00016489709113427. Available from: http://dx.doi.org/10.3109/00016489709113427 . [ PubMed ] [ Cross Ref ]
52. Hedgewald M, Heitman R, Wiederhold ML, Cooper JC, Gates GA. High-frequency electrostimulation hearing after mastoidectomy. Otolaryngol Head Neck Surg. 1989; 100 :49–56. [ PubMed ]
53. Suits GW, Brummett RE, Nunley J. Effect of otologic drill noise on ABR thresholds in a guinea pig model. Otolarnygol Head Neck Surg. 1993; 109 :660–667. [ PubMed ]
54. Urquhart AC, McIntosh WA, Bodenstein NP. Drill-generated sensorineural hearing loss following mastoid surgery. Laryngoscope. 1992 Jun; 102 (6):689–692. doi: 10.1288/00005537-199206000-00016. Available from: http://dx.doi.org/10.1288/00005537-199206000-00016 . [ PubMed ] [ Cross Ref ]
55. Tos M, Trojaborg N, Thomsen J. The contralateral ear after translabyrinthine removal of acoustic neuromas: is there a drill-noise generated hearing loss? J Laryngol Otol. 1989; 103 :845–849. doi: 10.1017/S0022215100110278. Available from: http://dx.doi.org/10.1017/S0022215100110278 . [ PubMed ] [ Cross Ref ]
56. da Cruz MJ, Fagan P, Atlas M, McNeill C. Drill-induced hearing loss in the nonoperated ear. Otolaryngol Head Neck Surg. 1997 Nov; 117 (5):555–558. doi: 10.1016/S0194-5998(97)70030-5. Available from: http://dx.doi.org/10.1016/S0194-5998(97)70030-5 . [ PubMed ] [ Cross Ref ]
57. Palva A, Sorri M. Can an operation of deaf ear be dangerous for hearing? Acta Otolaryngol Suppl. 1979; 360 :155–157. [ PubMed ]
58. Takemura K, Komeda M, Yagi M, Himeno C, Izumikawa M, Doi T, Kuriyama H, Miller JM, Yamashita T. Direct inner ear infusion of dexamethasone attenuates noise-induced trauma in guinea pig. Hear Res. 2004 Oct; 196 (1-2):58–68. doi: 10.1016/j.heares.2004.06.003. Available from: http://dx.doi.org/10.1016/j.heares.2004.06.003 . [ PubMed ] [ Cross Ref ]
59. El-Hennawi DM, El-Deen MH, Abou-Halawa AS, Nadeem HS, Ahmed MR. Efficacy of intratympanic methylprednisolone acetate in treatment of drill-induced sensorineural hearing loss in guinea pigs. J Laryngol Otol. 2005 Jan; 119 (1):2–7. doi: 10.1258/0022215053222815. Available from: http://dx.doi.org/10.1258/0022215053222815 . [ PubMed ] [ Cross Ref ]
60. Schneider W, Gjuric M, Katalinic A, Buhr W, Wolf SR. The value of methylprednisolone in the treatment of an experimental sensorineural hearing loss following drill-induced ossicular chain injury: a randomized, blinded study in guinea-pigs. Acta Otolaryngol. 1998 Jan; 118 (1):52–55. doi: 10.1080/00016489850155125. Available from: http://dx.doi.org/10.1080/00016489850155125 . [ PubMed ] [ Cross Ref ]
61. Palva T, Kärjä J, Palva A. High-tone sensorineural losses following chronic ear surgery. Arch Otolaryngol. 1973 Sep; 98 (3):176–178. doi: 10.1001/archotol.1973.00780020184008. Available from: http://dx.doi.org/10.1001/archotol.1973.00780020184008 . [ PubMed ] [ Cross Ref ]
62. Kylén P, Arlinger SD, Bergholtz LM. Peroperative temporary thershold shift in ear surgery. An electrocochleographic study. Acta Otolaryngol. 1977; 84 :393–401. doi: 10.3109/00016487709123982. Available from: http://dx.doi.org/10.3109/00016487709123982 . [ PubMed ] [ Cross Ref ]
63. Kylén P, Arlinger S, Jerlvall L, Harder H. Ossicular manipulation in chronic ear surgery. An electrocochleographic study. Arch Otolaryngol. 1980 Oct; 106 (10):598–601. doi: 10.1001/archotol.1980.00790340006002. Available from: http://dx.doi.org/10.1001/archotol.1980.00790340006002 . [ PubMed ] [ Cross Ref ]
64. Schick B, Schick BT, Kochannek S, Starlinger V, Iro H. Temporäre sensorineurale Hörverluste nach Ohroperationen – eine retrospektive Analyse. Laryngo Rhino Otol. 2007; 86 :200–205. doi: 10.1055/s-2006-944750. Available from: http://dx.doi.org/10.1055/s-2006-944750 . [ PubMed ] [ Cross Ref ]
65. Helms J, Mlynski R, Phleps G. T-Knorpel-Tympanoplastik bei offenem ovalem Fenster. Laryngo Rhino Otol. 2011; 90 :462–463. doi: 10.1055/s-0031-1283296. Available from: http://dx.doi.org/10.1055/s-0031-1283296 . [ PubMed ] [ Cross Ref ]
66. Copeland BJ, Buchman CA. Management of labyrinthine fistulae in chronic ear surgery. Am J Otolaryngol. 2003 Jan-Feb; 24 (1):51–60. doi: 10.1053/ajot.2003.10. Available from: http://dx.doi.org/10.1053/ajot.2003.10 . [ PubMed ] [ Cross Ref ]
67. Fuse T, Tada Y, Aoyagi M, Sugai Y. CT detection of facial canal dehiscence and semicircular canal fistula: comparison with surgical findings. J Comput Assist Tomogr. 1996 Mar-Apr; 20 (2):221–224. doi: 10.1097/00004728-199603000-00009. Available from: http://dx.doi.org/10.1097/00004728-199603000-00009 . [ PubMed ] [ Cross Ref ]
68. Portier F, Lescanne E, Racy E, Nowak C, Lamblin B, Bobin S. Studies of labyrinthine cholesteatoma-related fistulas: report of 22 cases. J Otolarnygol. 2005; 34 :1–6. doi: 10.2310/7070.2005.00001. Available from: http://dx.doi.org/10.2310/7070.2005.00001 . [ PubMed ] [ Cross Ref ]
69. Soda-Merhy A, Betancourt-Suárez MA. Surgical treatment of labyrinthine fistula caused by cholesteatoma. Otolaryngol Head Neck Surg. 2000 May; 122 (5):739–742. [ PubMed ]
70. Vartiainen E. What is the best method of treatment for labyrinthine fistulae caused by cholesteatoma? Clin Otolaryngol Allied Sci. 1992 Jun; 17 (3):258–260. doi: 10.1111/j.1365-2273.1992.tb01839.x. Available from: http://dx.doi.org/10.1111/j.1365-2273.1992.tb01839.x . [ PubMed ] [ Cross Ref ]
71. Brackmann DE, Shelton C, Arriaga M. Otologic surgery. Saunders; 2001.
72. Helms J, Jahrsdoerfer RA. Kopf- und Halschirurgie. Band 2: Ohr. Stuttgart, New York: Thieme-Verlag; 1996.
73. Magliulo G, Celebrini A, Cuiuli G, Parrotto D. Surgical management of the labyrinthine fistula complicating chronic otitis media with or without cholesteatoma. J Otolaryngol Head Neck Surg. 2008 Apr; 37 (2):143–147. [ PubMed ]
74. Chen Z, Dongzhen, Wu Y, Shi H, Zhou H, Wang J, Miyoshi A, Yin S. Surgical treatment of labyrinthine fistula caused by cholesteatoma with semicircular canal occlusion. Acta Otolaryngol. 2010; 130 (1):75–78. doi: 10.3109/00016480902875083. Available from: http://dx.doi.org/10.3109/00016480902875083 . [ PubMed ] [ Cross Ref ]
75. Baxter AB. Dehiscence of the fallopian canal: an anatomical study. J Laryngol Otol. 1971; 85 :587–594. doi: 10.1017/S0022215100073849. Available from: http://dx.doi.org/10.1017/S0022215100073849 . [ PubMed ] [ Cross Ref ]
76. Moreano EH, Paparella MM, Zelterman D, Goycoolea MV. Prevalance of facial canal dehiscence und of persistent stapedial artery in the human middle ear: a report of 1 000 temporal bones. Laryngoscope. 1994; 104 :309–320. doi: 10.1288/00005537-199403000-00012. Available from: http://dx.doi.org/10.1288/00005537-199403000-00012 . [ PubMed ] [ Cross Ref ]
77. Bayazit YA, Ozer E, Kanlikama M. Gross dehiscence of the bone covering the facial nerve in the light of otological surgery. J Laryngol Otol. 2002 Oct; 116 (10):800–803. doi: 10.1258/00222150260293600. Available from: http://dx.doi.org/10.1258/00222150260293600 . [ PubMed ] [ Cross Ref ]
78. Li D, Cao Y. Facial canal dehiscence: a report of 1,465 stapes operations. Ann Otol Rhinol Laryngol. 1996 Jun; 105 (6):467–471. [ PubMed ]
79. Maru N, Cheita AC, Mogoanta CA, Prejoianu B. Intratemporal course of the facial nerve: morphological, topographic and morphometric features. Rom J Morph Embryo. 2010; 51 :243–248. [ PubMed ]
80. Beddard D, Saunders WH. Congenital defects in the fallopian canal. Laryngoscope. 1962 Jan; 72 :112–115. doi: 10.1288/00005537-196201000-00008. Available from: http://dx.doi.org/10.1288/00005537-196201000-00008 . [ PubMed ] [ Cross Ref ]
81. Dietzel K. Über Dehiszenzen des Fazialiskanals. Z Laryngol Rhinol Otol. 1961; 40 :366–379. [ PubMed ]
82. Schwager K, Helms J. Anomalien des Nervus facialis im fehlgebildeten Felsenbein. Laryngo Rhino Otol. 1995; 74 :549–552. doi: 10.1055/s-2007-997799. Available from: http://dx.doi.org/10.1055/s-2007-997799 . [ PubMed ] [ Cross Ref ]
83. Spector JG, Ge X. Ossification patterns of the tympanic facial canal in the human fetus and neonate. Laryngoscope. 1993 Sep; 103 (9):1052–1065. doi: 10.1288/00005537-199309000-00018. Available from: http://dx.doi.org/10.1288/00005537-199309000-00018 . [ PubMed ] [ Cross Ref ]
84. Mutlu V, da Costo SS, Paparella MM, Schachern PA. Clinical-histopathological correlations of pitfalls in middle ear surgery. Eur Arch Otorhinolaryngol. 1998; 255 :189–194. doi: 10.1007/s004050050041. Available from: http://dx.doi.org/10.1007/s004050050041 . [ PubMed ] [ Cross Ref ]
85. Johnsson LG, Kingsley TC. Herniation of the facial nerve in the tympanic segment. Arch Otolaryngol. 1979; 91 :598–602. [ PubMed ]
86. Nager GT, Proctor B. Anatomical variations and anomalies involving the facial canal. Ann Otol Rhinol Laryngol. 1982; 91 (Suppl):61–77. [ PubMed ]
87. Basek M. Anomalies of the facial nerve in normal temporal bones. Ann Otol Rhinol Laryngol. 1962 Jun; 71 :382–390. [ PubMed ]
88. Helms J. Variations of the course of the facial nerve in the middle ear and mastoid. In: Samii D, Jannetta PJ, editors. The cranial nerves. Berlin, Heidelberg, New York: Springer; 1981. p. 391. Available from: http://dx.doi.org/10.1007/978-3-642-67980-3_49 . [ Cross Ref ]
89. Sedee GA. Facial nerve and dysplasia of the temporal bone. ORL J Otorhinolaryngol Relat Spec. 1973; 35 (3):222–228. doi: 10.1159/000275119. Available from: http://dx.doi.org/10.1159/000275119 . [ PubMed ] [ Cross Ref ]
90. Theissing J. Über operativ beobachtete Facialismissbildunge. [Facial nerve anomalies found at surgery (author's transl)]. HNO. 1975 Oct; 23 (10):310–312. (Ger). [ PubMed ]
91. Jahrsdoerfer RA. The facial nerve and the congenitally malformed middle ear. In: May M, editor. The facial nerve. Stuttgart, New York: Thieme; 1986. p. 631.
92. Crabtree JA. The facial nerve in congenital ear surgery. Otolaryngol Clin North Am. 1974 Jun; 7 (2):505–510. [ PubMed ]
93. Bellucci RJ. Congenital aural malformations: diagnosis and treatment. Otolaryngol Clin North Am. 1981 Feb; 14 (1):95–124. [ PubMed ]
94. Hawthorne M. Medical negligence in otology. In: Gleeson M, editor. Scott-Brown's otorhinolaryngology, head and neck surgery. 7. Auflage, Band 3, Teil 19
95. Szymański M, Gołabek W, Morshed K, Siwiec H. The influence of the sequence of surgical steps on complications rate in stapedotomy. Otol Neurotol. 2007 Feb; 28 (2):152–156. doi: 10.1097/01.mao.0000247815.23948.89. Available from: http://dx.doi.org/10.1097/01.mao.0000247815.23948.89 . [ PubMed ] [ Cross Ref ]
96. Thorne MC, Dunham BP, Tom LW. Delayed facial paresis following tympanomastoid surgery in a pediatric patient. Ear Nose Throat. 2010; 89 :357–361. [ PubMed ]
97. Bonkowsky V, Kochanowski B, Strutz J, Pere P, Hosemann W, Arnold W. Delayed facial palsy following uneventful middle ear surgery: a herpes simplex virus type 1 reactivation? Ann Otol Rhinol Laryngol. 1998 Nov; 107 (11 Pt 1):901–905. [ PubMed ]
98. Gyo K, Honda N. Delayed facial palsy after middle-ear surgery due to reactivation of varicella-zoster virus. J Laryngol Otol. 1999 Oct; 113 (10):914–915. doi: 10.1017/S0022215100145578. Available from: http://dx.doi.org/10.1017/S0022215100145578 . [ PubMed ] [ Cross Ref ]
99. McManus LJ, Stringer MD, Dawes PJ. Iatrogenic injury of the chorda tympani: a systematic review. J Laryngol Otol. 2012 Jan; 126 (1):8–14. doi: 10.1017/S0022215111002039. Available from: http://dx.doi.org/10.1017/S0022215111002039 . [ PubMed ] [ Cross Ref ]
100. Michael P, Raut V. Chorda tympani injury: operative findings and postoperative symptoms. Otolaryngol Head Neck Surg. 2007 Jun; 136 (6):978–981. doi: 10.1016/j.otohns.2006.12.022. Available from: http://dx.doi.org/10.1016/j.otohns.2006.12.022 . [ PubMed ] [ Cross Ref ]
101. Bull TR. Taste and the chorda typani. J Laryngol Otol. 1965 Jun; 79 :479–493. doi: 10.1017/S0022215100063969. Available from: http://dx.doi.org/10.1017/S0022215100063969 . [ PubMed ] [ Cross Ref ]
102. Mahendran S, Hogg R, Robinson JM. To divide or manipulate the chorda tympani in stapedotomy. Eur Arch Otorhinolaryngol. 2005 Jun; 262 (6):482–487. doi: 10.1007/s00405-004-0854-5. Available from: http://dx.doi.org/10.1007/s00405-004-0854-5 . [ PubMed ] [ Cross Ref ]
103. Saito T, Shibamori Y, Manabe Y, Yamagishi T, Yamamoto T, Ohtsubo T, Saito H. Morphological and functional study of regenerated chorda tympani nerves in humans. Ann Otol Rhinol Laryngol. 2000 Aug; 109 (8 Pt 1):703–709. [ PubMed ]
104. Yeo SB, Loy AH. Chorda tympani trauma--how much does it affect taste? Singapore Med J. 1997 Aug; 38 (8):329–331. [ PubMed ]
105. Gopalan P, Kumar M, Gupta D, Phillipps JJ. A study of chorda tympani nerve injury and related symptoms following middle-ear surgery. J Laryngol Otol. 2005 Mar; 119 (3):189–192. doi: 10.1258/0022215053561657. Available from: http://dx.doi.org/10.1258/0022215053561657 . [ PubMed ] [ Cross Ref ]
106. House HP. Early and late complications of stapes surgery. Arch Otolaryngol. 1963 Oct; 78 :606–613. doi: 10.1001/archotol.1963.00750020618022. Available from: http://dx.doi.org/10.1001/archotol.1963.00750020618022 . [ PubMed ] [ Cross Ref ]
107. Just T, Homoth J, Graumüller S, Pau HW. Schmeckstörungen und Erholung der Schmeckfunktion nach Mittelohroperationen. Laryngo Rhino Otol. 2003; 82 :494–500. doi: 10.1055/s-2003-40899. Available from: http://dx.doi.org/10.1055/s-2003-40899 . [ PubMed ] [ Cross Ref ]
108. Kveton JF, Bartoshuk LM. The effect of unilateral chorda tympani damage on taste. Laryngoscope. 1994 Jan; 104 (1 Pt 1):25–29. doi: 10.1288/00005537-199401000-00006. Available from: http://dx.doi.org/10.1288/00005537-199401000-00006 . [ PubMed ] [ Cross Ref ]
109. Moon CN, Pullen EW. Effects of chorda tympani section during middle ear surgery. Laryngoscope. 1963; 73 :392–405. doi: 10.1288/00005537-196304000-00004. Available from: http://dx.doi.org/10.1288/00005537-196304000-00004 . [ Cross Ref ]
110. Krarup B. Taste fibres and the chorda tympani. Acta Otolaryngol Suppl. 1958; 140 :201–205. doi: 10.3109/00016485809124416. Available from: http://dx.doi.org/10.3109/00016485809124416 . [ PubMed ] [ Cross Ref ]
111. Clark MPA, O'Malley S. Chorda tympani nerve function after middle ear surgery. Otol Neurotol. 2007; 28 :335–340. doi: 10.1097/01.mao.0000247820.16325.f0. Available from: http://dx.doi.org/10.1097/01.mao.0000247820.16325.f0 . [ PubMed ] [ Cross Ref ]
112. Hüttenbrink KB. Störungen des Riech- und Schmecksinns. Ther Umsch. 1995; 52 :732–737. [ PubMed ]
113. Catalanotto FA, Bartoshuk LM, Östrum KM, Gent JF, Fast K. Effects of anesthesia of the facial nerve on taste. Chem Senses. 1993; 18 :461–470. doi: 10.1093/chemse/18.5.461. Available from: http://dx.doi.org/10.1093/chemse/18.5.461 . [ Cross Ref ]
114. Östrum KM, Catalanotto FA, Garcia J, Bartoshuk LM. Effects of oral sensory filed loss of taste scaling ability. Chem Senses. 1985; 10 :459.
115. Yamada Y, Tomita H. Influences on taste in the area of chorda tympani nerve after transtympanic injection of local anesthetic (4% lidocaine) Auris Nasus Larynx. 1989; 16 (Suppl 1):S41–S46. doi: 10.1016/S0385-8146(89)80028-8. Available from: http://dx.doi.org/10.1016/S0385-8146(89)80028-8 . [ PubMed ] [ Cross Ref ]
116. Helms J, Schwager K. Mittelohrmissbildungen. In: Helms J, editor. Oto-Rhino-Laryngologie in Klinik und Praxis, Band 1: Ohr. Stuttgart: Thieme; 1994. pp. 545–563.
117. Sone M, Sakagami M, Tsuji K, Mishiro Y. Younger patients have a higher rate of recovery of taste function after middle ear surgery. Arch Otolaryngol Head Neck Surg. 2001 Aug; 127 (8):967–969. doi: 10.1001/archotol.127.8.967. Available from: http://dx.doi.org/10.1001/archotol.127.8.967 . [ PubMed ] [ Cross Ref ]
118. Schick B, Ibing R, Brors D, Draf W. Long-term study of endonasal duraplasty and review of the literature. Ann Otol Rhinol Laryngol. 2001 Feb; 110 (2):142–147. [ PubMed ]
119. Hittel JP, Mertens J. Aberranter Verlauf der A. carotis interna. Laryngorhinootologie. 2000; 79 :557–558. doi: 10.1055/s-2000-6940. Available from: http://dx.doi.org/10.1055/s-2000-6940 . [ PubMed ] [ Cross Ref ]
120. Delank KW, Stoll W, Schuierer G, Wassmann H. Die Aneurysmablutung als Komplikation der Parazentese. HNO. 1998; 46 :762–765. doi: 10.1007/s001060050308. Available from: http://dx.doi.org/10.1007/s001060050308 . [ PubMed ] [ Cross Ref ]
121. Valentine R, Boase S, Jervis-Bardy J, Dones Cabral JD, Robinson S, Wormald PJ. The efficacy of hemostatic techniques in the sheep model of carotid artery injury. Int Forum Allergy Rhinol. 2011 Mar-Apr; 1 (2):118–122. doi: 10.1002/alr.20033. Available from: http://dx.doi.org/10.1002/alr.20033 . [ PubMed ] [ Cross Ref ]
122. Draf W. Tumoren des Mittelohres. In: Helms J, editor. Oto-Rhino-Laryngologie in Klinik und Praxis. Band 1: Ohr. Stuttgart: Thieme; 1994. pp. 701–726.
123. Welling DB, Glasscock ME, 3rd, Tarasidis N. Management of carotid artery hemorrhage in middle ear surgery. Otolaryngol Head Neck Surg. 1993 Dec; 109 (6):996–999. [ PubMed ]
124. Stennert E. Fazialisparesen. In: Helms J, editor. Oto-Rhino-Laryngologie in Klinik und Praxis. Band 1: Ohr. Stuttgart: Thieme; 1994. pp. 666–701.
125. Rudert H. Die Versorgung der intratemporalen Facialisläsionen. HNO. 1975; 23 :297–306. [ PubMed ]
126. Das K, Murali R, Lindstrom CJ, Couldwell WT. Symptomatic subdural hygroma and temporal lobe edema after translabyrinthine removal of acoustic neuroma. Skull Base. 2001 May; 11 (2):137–142. doi: 10.1055/s-2001-14434. Available from: http://dx.doi.org/10.1055/s-2001-14434 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
127. Horowitz SW, Leonetti JP, Azar-Kia B, Anderson D. Postoperative radiographic findings following acoustic neuroma removal. Skull Base Surg. 1996; 6 (4):199–205. doi: 10.1055/s-2008-1058626. Available from: http://dx.doi.org/10.1055/s-2008-1058626 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
128. Ostrowski VB, Borjab DI. Otolith dysfunction and semicircular canal dysfunction. In: Jackler RK, Brackmann DE, editors. Neurotology. 2. Auflage. Philadelphia: Elsevier Mosby; 2005. pp. 241–255. Available from: http://dx.doi.org/10.1016/B978-0-323-01830-2.50020-1 . [ Cross Ref ]
129. Nigam A, Moffat DA, Varley EW. Benign paroxysmal positional vertigo resulting from surgical trauma. J Laryngol Otol. 1989 Feb; 103 (2):203–204. doi: 10.1017/S0022215100108448. Available from: http://dx.doi.org/10.1017/S0022215100108448 . [ PubMed ] [ Cross Ref ]
130. Dix MR, Hallpike CS. The pathology symptomatology and diagnosis of certain common disorders of the vestibular system. Proc R Soc Med. 1952 Jun; 45 (6):341–354. [ PMC free article ] [ PubMed ]
131. Dlugaiczyk J, Siebert S, Hecker DJ, Brase C, Schick B. Involvement of the anterior semicircular canal in posttraumatic benign paroxysmal positioning vertigo. Otol Neurotol. 2011 Oct; 32 (8):1285–1290. doi: 10.1097/MAO.0b013e31822e94d9. Available from: http://dx.doi.org/10.1097/MAO.0b013e31822e94d9 . [ PubMed ] [ Cross Ref ]
132. Epley JM. The canalith repositioning procedure: for treatment of benign paroxysmal positional vertigo. Otolaryngol Head Neck Surg. 1992 Sep; 107 (3):399–404. [ PubMed ]
133. Fife TD, Iverson DJ, Lempert T, Furman JM, Baloh RW, Tusa RJ, Hain TC, Herdman S, Morrow MJ, Gronseth GS. Practice parameter: therapies for benign paroxysmal positional vertigo (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2008 May; 70 (22):2067–2074. doi: 10.1212/01.wnl.0000313378.77444.ac. Available from: http://dx.doi.org/10.1212/01.wnl.0000313378.77444.ac . [ PubMed ] [ Cross Ref ]
134. Kim YK, Shin JE, Chung JW. The effect of canalith repositioning for anterior semicircular canal canalithiasis. ORL J Otorhinolaryngol Relat Spec. 2005; 67 (1):56–60. doi: 10.1159/000084336. Available from: http://dx.doi.org/10.1159/000084336 . [ PubMed ] [ Cross Ref ]
135. Lempert T, Tiel-Wilck K. A positional maneuver for treatment of horizontal-canal benign positional vertigo. Laryngoscope. 1996 Apr; 106 (4):476–478. doi: 10.1097/00005537-199604000-00015. Available from: http://dx.doi.org/10.1097/00005537-199604000-00015 . [ PubMed ] [ Cross Ref ]
136. Herdman SJ, Whitney SL. Interventions for the patient with vestibular hypofunction. In: Herdman SJ, editor. Vestibular Rehabilitation. 3. Auflage. Philadelphia: FA Davis Company; 2007. pp. 309–337.
137. Strupp M, Arbusow V, Maag KP, Gall C, Brandt T. Vestibular exercises improve central vestibulospinal compensation after vestibular neuritis. Neurology. 1998 Sep; 51 (3):838–844. doi: 10.1212/WNL.51.3.838. Available from: http://dx.doi.org/10.1212/WNL.51.3.838 . [ PubMed ] [ Cross Ref ]
138. Lu X, Zhao Y, Lu D, An P, Zheng Y, Qin X, Wang L, Roberson JB. Rarely reported ocular complications following surgery to correct chronic suppurative otitis media. Eur Arch Otorhinolaryngol. 2012 Feb; 269 (2):407–411. doi: 10.1007/s00405-011-1646-3. Available from: http://dx.doi.org/10.1007/s00405-011-1646-3 . [ PubMed ] [ Cross Ref ]
139. Rudnick EF, Chu MW, Sismanis A, Dodson KM, Mitchell RB. Orbital sequelae of rhinosinusitis after cochlear implantation in children. Laryngoscope. 2006 Aug; 116 (8):1368–1371. doi: 10.1097/01.mlg.0000225381.36099.54. Available from: http://dx.doi.org/10.1097/01.mlg.0000225381.36099.54 . [ PubMed ] [ Cross Ref ]
140. Hoffman RA, Parisier SC, Roland JT., Jr In reference to Orbital sequelae of rhinosinusitis after cochlear implantation in children. Laryngoscope. 2007 Aug; 117 (8):1505. doi: 10.1097/MLG.0b013e318065aa42. Available from: http://dx.doi.org/10.1097/MLG.0b013e318065aa42 . [ PubMed ] [ Cross Ref ]
141. Keles, E, Kizirgil A, Kaygusuz I, Karlidag T, Yalçin S, Alpay HC, Demir YS. Bacteriemia during mastoidectomy and/or tympanoplasty. Otolaryngol Head Neck Surg. 2005 Sep; 133 (3):347–351. doi: 10.1016/j.otohns.2005.02.012. Available from: http://dx.doi.org/10.1016/j.otohns.2005.02.012 . [ PubMed ] [ Cross Ref ]
142. Warner ME, Fronapfel PJ, Hebl JR, Herman DC, Warner DO, Decker P, Warner MA. Perioperative visual changes. Anesthesiology. 2002 Apr; 96 (4):855–859. doi: 10.1097/00000542-200204000-00012. Available from: http://dx.doi.org/10.1097/00000542-200204000-00012 . [ PubMed ] [ Cross Ref ]
143. Ulug T, Basaran B, Minareci O, Aydin K. An unusual complication of stapes surgery: profuse bleeding from the anteriorly located sigmoid sinus. Eur Arch Otorhinolaryngol. 2004 Aug; 261 (7):397–399. doi: 10.1007/s00405-003-0655-2. Available from: http://dx.doi.org/10.1007/s00405-003-0655-2 . [ PubMed ] [ Cross Ref ]
144. Shea JJ., Jr Complications of the stapedectomy operation. Ann Otol Rhinol Laryngol. 1963 Dec; 72 :1108–1123. [ PubMed ]
145. Lesinski SG. Revision stapedectomy. Curr Opin Otolaryngol Head Neck Surg. 2003 Oct; 11 (5):347–354. doi: 10.1097/00020840-200310000-00007. Available from: http://dx.doi.org/10.1097/00020840-200310000-00007 . [ PubMed ] [ Cross Ref ]
146. Schmid P, Häusler R. Revision stapedectomy: an analysis of 201 operations. Otol Neurotol. 2009 Dec; 30 (8):1092–1100. doi: 10.1097/MAO.0b013e3181b4ecb2. Available from: http://dx.doi.org/10.1097/MAO.0b013e3181b4ecb2 . [ PubMed ] [ Cross Ref ]
147. Röösli C, Hoffmann A, Treumann T, Linder TE. Stellenwert der CT-Diagnostik vor Revisions-Stapedotomien. HNO. 2008; 56 :895–900. doi: 10.1007/s00106-008-1670-9. Available from: http://dx.doi.org/10.1007/s00106-008-1670-9 . [ PubMed ] [ Cross Ref ]
148. Van Rompaey V, Offeciers E, De Foer B, Somers T. Jugular bulb diverticulum dehiscence towards the vestibular aqueduct in a patient with otosclerosis. J Laryngol Otol. 2012; 126 :313–315. doi: 10.1017/S0022215111003100. Available from: http://dx.doi.org/10.1017/S0022215111003100 . [ PubMed ] [ Cross Ref ]
149. Hope A, Fagan P. Latent superior canal dehiscence syndrome unmasked by stapedotomy for otosclerosis. J Laryngol Otol. 2010 Apr; 124 (4):428–430. doi: 10.1017/S0022215109991654. Available from: http://dx.doi.org/10.1017/S0022215109991654 . [ PubMed ] [ Cross Ref ]
150. Lesinski SG. Causes of conductive hearing loss after stapedectomy or stapedotomy: a prospective study of 279 consecutive surgical revisions. Otol Neurotol. 2002 May; 23 (3):281–288. doi: 10.1097/00129492-200205000-00009. Available from: http://dx.doi.org/10.1097/00129492-200205000-00009 . [ PubMed ] [ Cross Ref ]
151. Vibert D, Häusler R, Lövblad KO, Schroth G. Hearing loss and vertigo in superficial siderosis of the central nervous system. Am J Otolaryngol. 2004 Mar-Apr; 25 (2):142–149. doi: 10.1016/j.amjoto.2003.10.001. Available from: http://dx.doi.org/10.1016/j.amjoto.2003.10.001 . [ PubMed ] [ Cross Ref ]
188. Woldag K, Meister EF, Kösling S. Diagnostik bei persistierenden Gleichgewichtsstörungen nach Operationen am Stapes. Laryngo Rhino Otol. 1995; 74 :403–407. doi: 10.1055/s-2007-997769. Available from: http://dx.doi.org/10.1055/s-2007-997769 . [ PubMed ] [ Cross Ref ]
189. Bozzato A, Struffert T, Hertel V, Iro H, Hornung J. Analysis of the accuracy of high-resolution computed tomography techniques for the measurement of stapes prostheses. Eur Radiol. 2010 Mar; 20 (3):566–571. doi: 10.1007/s00330-009-1582-4. Available from: http://dx.doi.org/10.1007/s00330-009-1582-4 . [ PubMed ] [ Cross Ref ]
190. Ginsberg IA. Cochlear reaction following stapedectomy. A comparison of two techniques. Arch Otolaryngol. 1968 Nov; 88 (5):481–490. doi: 10.1001/archotol.1968.00770010483006. Available from: http://dx.doi.org/10.1001/archotol.1968.00770010483006 . [ PubMed ] [ Cross Ref ]
191. Shea JJ. Thirty years of stapes surgery. J Laryngol Otol. 1988 Jan; 102 (1):14–19. doi: 10.1017/S0022215100103846. Available from: http://dx.doi.org/10.1017/S0022215100103846 . [ PubMed ] [ Cross Ref ]
192. Zohar Y, Laurian N. Facial palsy following stapedectomy: (a case report) J Laryngol Otol. 1985 Apr; 99 (4):387–388. doi: 10.1017/S0022215100096894. Available from: http://dx.doi.org/10.1017/S0022215100096894 . [ PubMed ] [ Cross Ref ]
193. Smith MCF, Simon P, Ramalingam KK. Delayed facial palsy following uncomplicated stapedectomy. J Laryngol Otol. 1990; 104 :611–612. doi: 10.1017/S0022215100113374. Available from: http://dx.doi.org/10.1017/S0022215100113374 . [ PubMed ] [ Cross Ref ]
194. Althaus SR, House HP. Delayed post-stapedectomy facial paralysis: a report of five cases. Laryngoscope. 1973 Aug; 83 (8):1234–1240. doi: 10.1288/00005537-197308000-00007. Available from: http://dx.doi.org/10.1288/00005537-197308000-00007 . [ PubMed ] [ Cross Ref ]
195. Shea JJ, Jr, Ge X. Delayed facial palsy after stapedectomy. Otol Neurotol. 2001 Jul; 22 (4):465–470. doi: 10.1097/00129492-200107000-00009. Available from: http://dx.doi.org/10.1097/00129492-200107000-00009 . [ PubMed ] [ Cross Ref ]
196. Ng M, Maceri DR. Delayed facial paralysis after stapedotomy using KTP laser. Am J Otol. 1999 Jul; 20 (4):421–424. [ PubMed ]
197. Salvinelli F, Casale M, Vitaliana L, Greco F, Dianzani C, D'Ascanio L. Delayed peripheral facial palsy in the stapes surgery: can it be prevented? Am J Otolaryngol. 2004 Mar-Apr; 25 (2):105–108. doi: 10.1016/j.amjoto.2003.11.010. Available from: http://dx.doi.org/10.1016/j.amjoto.2003.11.010 . [ PubMed ] [ Cross Ref ]
198. Yung M, Smith P, Hausler R, Martin C, Offeciers E, Pytel J, Skladzien J, Somers T, Ven de Heyning P. International Common Otology Database: taste disturbance after stapes surgery. Otol Neurotol. 2008 Aug; 29 (5):661–665. doi: 10.1097/MAO.0b013e3181778211. Available from: http://dx.doi.org/10.1097/MAO.0b013e3181778211 . [ PubMed ] [ Cross Ref ]
199. Rebol J. The unilateral stapes gusher. Wien Klin Wochenschr. 2004; 116 (Suppl 2):90–92. [ PubMed ]
200. Bellucci RJ. Cochlear hearing loss in tympanoplasty. Otolaryngol Head Neck Surg. 1985 Aug; 93 (4):482–485. [ PubMed ]
201. Lo TM, Zhang M, Young LJ, Antonelli PJ. Hearing loss with stapedotomy and treated otitis media. Otolaryngol Head and Neck Surg. 2006; 134 :674–679. doi: 10.1016/j.otohns.2005.11.008. Available from: http://dx.doi.org/10.1016/j.otohns.2005.11.008 . [ PubMed ] [ Cross Ref ]
202. Antonelli PJ, Briggs RD, Gerhardt KJ. Hearing preservation with labyrinthine ablation in otitis media. Laryngoscope. 2000 May; 110 (5 Pt 1):779–786. doi: 10.1097/00005537-200005000-00008. Available from: http://dx.doi.org/10.1097/00005537-200005000-00008 . [ PubMed ] [ Cross Ref ]
203. Nielsen TR, Thomsen J. Meningitis following stapedotomy: a rare and early complication. J Laryngol Otol. 2000 Oct; 114 (10):781–783. doi: 10.1258/0022215001903915. Available from: http://dx.doi.org/10.1258/0022215001903915 . [ PubMed ] [ Cross Ref ]
204. García AM, Pérez A, Viada J, Cadaval F. Meningoencefalitis post estapedotomía. Análisis de un caso clínico. [Repeated episodes of meningoencephalitis after a stapedotomy. Report of one case]. Rev Med Chil. 2004 Nov; 132 (11):1407–1411. [ PubMed ]
205. Marion M, Hinojosa R, Khan AA. Persistence of the stapedial artery: a histopathological study. Otolaryngol Head Neck Surg. 1985; 93 :298–312. [ PubMed ]
206. Schuknecht HF. Otosclerosis Surgery. In: Nadol JB, Schuknecht HF, editors. Surgery of the ear and temporal bone. New York: Raven Press; 1993.
207. Sudhoff H, Hildmann H. Stapes surgery. In: Hildmann H, Sudhoff H, editors. Middle ear surgery. Heidelberg: Springer; 2006. pp. 112–119. Available from: http://dx.doi.org/10.1007/978-3-540-47671-9_22 . [ Cross Ref ]
208. Fenton JE, Turner J, Shirazi A, Fagan PA. Post-stapedectomy reparative granuloma: a misnomer. J Laryngol Otol. 1996 Feb; 110 (2):185–188. doi: 10.1017/S0022215100133134. Available from: http://dx.doi.org/10.1017/S0022215100133134 . [ PubMed ] [ Cross Ref ]
209. Ciorba A, Bovo R, Trevisi P, Rosignoli M, Aimoni C, Castiglione A, Martini A. Postoperative complications in cochlear implants: a retrospective analysis of 438 consecutive cases. Eur Arch Otorhinolaryngol. 2012 Jun; 269 (6):1599–1603. doi: 10.1007/s00405-011-1818-1. Available from: http://dx.doi.org/10.1007/s00405-011-1818-1 . [ PubMed ] [ Cross Ref ]
210. Cohen NL, Hoffman RA. Complications of cochlear implant surgery in adults and children. Ann Otol Rhinol Laryngol. 1991 Sep; 100 (9 Pt 1):708–711. [ PubMed ]
211. Bhatia K, Gibbin KP, Nikolopoulos TP, O'Donoghue GM. Surgical complications and their management in a series of 300 consecutive pediatric cochlear implantations. Otol Neurotol. 2004; 25 :730–739. doi: 10.1097/00129492-200409000-00015. Available from: http://dx.doi.org/10.1097/00129492-200409000-00015 . [ PubMed ] [ Cross Ref ]
212. Venail F, Sicard M, Piron JP, Levi A, Artieres F, Uziel A, Mondain M. Reliability and complications of 500 consecutive cochlear implantations. Arch Otolaryngol Head Neck Surg. 2008 Dec; 134 (12):1276–1281. doi: 10.1001/archoto.2008.504. Available from: http://dx.doi.org/10.1001/archoto.2008.504 . [ PubMed ] [ Cross Ref ]
213. Dutt SN, Ray J, Hadjihannas E, Cooper H, Donaldson I, Proops DW. Medical and surgical complications of the second 100 adult cochlear implant patients in Birmingham. J Laryngol Otol. 2005; 119 :759–764. doi: 10.1258/002221505774481291. Available from: http://dx.doi.org/10.1258/002221505774481291 . [ PubMed ] [ Cross Ref ]
214. Kim CS, Oh SH, Chang SO, Kim HM, Hur DG. Management of complications in cochlear implantation. Acta Oto Laryngol. 2008; 128 :408–414. doi: 10.1080/00016480701784973. Available from: http://dx.doi.org/10.1080/00016480701784973 . [ PubMed ] [ Cross Ref ]
215. Brito R, Monteiro TA, Leal AF, Tsuji RK, Pinna MH, Bento RF. Surgical complications in 550 consecutive cochlear implantation. Braz J Otorhinolaryngol. 2012 Jun; 78 (3):80–85. doi: 10.1590/S1808-86942012000300014. Available from: http://dx.doi.org/10.1590/S1808-86942012000300014 . [ PubMed ] [ Cross Ref ]
216. Cohen NL, Roland JT, Jr, Marrinan M. Meningitis in cochlear implant recipients: the North American experience. Otol Neurotol. 2004 May; 25 (3):275–281. doi: 10.1097/00129492-200405000-00013. Available from: http://dx.doi.org/10.1097/00129492-200405000-00013 . [ PubMed ] [ Cross Ref ]
217. Hansen S, Anthonsen K, Stangerup SE, Jensen JH, Thomsen J, Cayé-Thomasen P. Unexpected findings and surgical complications in 505 consecutive cochlear implantations: a proposal for reporting consensus. Acta Otolaryngol. 2010 May; 130 (5):540–549. doi: 10.3109/00016480903358261. Available from: http://dx.doi.org/10.3109/00016480903358261 . [ PubMed ] [ Cross Ref ]
218. Kandogan T, Levent O, Gurol G. Complications of paediatric cochlear implantation: experience in Izmir. J Laryngol Otol. 2005 Aug; 119 (8):606–610. doi: 10.1258/0022215054516331. Available from: http://dx.doi.org/10.1258/0022215054516331 . [ PubMed ] [ Cross Ref ]
219. Stratigouleas ED, Perry BP, King SM, Syms CA., 3rd Complication rate of minimally invasive cochlear implantation. Otolaryngol Head Neck Surg. 2006 Sep; 135 (3):383–386. doi: 10.1016/j.otohns.2006.03.023. Available from: http://dx.doi.org/10.1016/j.otohns.2006.03.023 . [ PubMed ] [ Cross Ref ]
220. Telian SA, El-Kashlan HK, Arts HA. Minimizing wound complications in cochlear implant surgery. Am J Otol. 1999 May; 20 (3):331–334. [ PubMed ]
221. Orhan KS, Guldiken Y, Basaran B, Ulusan M, Polat B, Celik M, Deger K. Complications and their management following pediatric cochlear implantations. Int Adv Otol. 2012; 8 :244–252.
323. Satar B, Jackler RK, Oghalai J, Pitts LH, Yates PD. Risk-benefit analysis of using the middle fossa approach for acoustic neuromas with >10 mm cerebellopontine angle component. Laryngoscope. 2002 Aug; 112 (8 Pt 1):1500–1506. doi: 10.1097/00005537-200208000-00031. Available from: http://dx.doi.org/10.1097/00005537-200208000-00031 . [ PubMed ] [ Cross Ref ]
324. Kanzaki J, Ogawa K, Inoue Y, Shiobara R. Hearing preservation surgery in acoustic neuroma patients with normal hearing. Skull Base Surg. 1997; 7 (3):109–113. doi: 10.1055/s-2008-1058601. Available from: http://dx.doi.org/10.1055/s-2008-1058601 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
325. Kane NM, Kazanas S, Maw AR, Coakham HB, Torrens MJ, Morgan MH, Stranjalis G, Butler SR. Functional outcome in patients after excision of extracanalicular acoustic neuromas using the suboccipital approach. Ann R Coll Surg Engl. 1995 May; 77 (3):210–216. [ PMC free article ] [ PubMed ]
326. Hilton CW, Haines SJ, Agrawal A, Levine SC. Late failure rate of hearing preservation after middle fossa approach for resection of vestibular schwannoma. Otol Neurotol. 2011 Jan; 32 (1):132–135. doi: 10.1097/MAO.0b013e3182001c7d. Available from: http://dx.doi.org/10.1097/MAO.0b013e3182001c7d . [ PubMed ] [ Cross Ref ]
327. Sughrue ME, Yang I, Aranda D, Kane AJ, Parsa AT. Hearing preservation rates after microsurgical resection of vestibular schwannoma. J Clin Neurosci. 2010 Sep; 17 (9):1126–1129. doi: 10.1016/j.jocn.2010.01.018. Available from: http://dx.doi.org/10.1016/j.jocn.2010.01.018 . [ PubMed ] [ Cross Ref ]
328. Rudolf J, Freigang B. Hörvermögen vor, während und nach transtemporaler Akustikusneurinomextirpation. In: Bootz F, Strauuss G, editors. Die Chirurgie der lateralen Schädelbasis. Springer-Verlag; 2002. Springer-Verlag; 2002. pp. 71–75. Available from: http://dx.doi.org/10.1007/978-3-642-56058-3_18 . [ Cross Ref ]
329. Schick B, Iro H. Aktuelles Management bei Vestibularisschwannomen. In: Biesinger E, Iro H, editors. HNO Praxis heute 27. Springer-Verlag; 2007. pp. 87–97.
330. Baguley DM, Humphriss RL, Axon PR, Moffat DA. Change in tinnitus handicap after translabyrinthine vestibular schwannoma excision. Otol Neurotol. 2005 Sep; 26 (5):1061–1063. doi: 10.1097/01.mao.0000185043.54147.3a. Available from: http://dx.doi.org/10.1097/01.mao.0000185043.54147.3a . [ PubMed ] [ Cross Ref ]
331. Kameda K, Shono T, Hashiguchi K, Yoshida F, Sasaki T. Effect of tumor removal on tinnitus in patients with vestibular schwannoma. J Neurosurg. 2010 Jan; 112 (1):152–157. doi: 10.3171/2009.3.JNS081053. Available from: http://dx.doi.org/10.3171/2009.3.JNS081053 . [ PubMed ] [ Cross Ref ]
332. Saman Y, Bamiou DE, Gleeson M. A contemporary review of balance dysfunction following vestibular schwannoma surgery. Laryngoscope. 2009 Nov; 119 (11):2085–2093. doi: 10.1002/lary.20648. Available from: http://dx.doi.org/10.1002/lary.20648 . [ PubMed ] [ Cross Ref ]
333. Driscoll CL, Lynn SG, Harner SG, Beatty CW, Atkinson EJ. Preoperative identification of patients at risk of developing persistent disequilibrium after acoustic neuroma removal. Am J Otol. 1998; 19 :491–495. [ PubMed ]
334. Vereeck L, Wuyts FL, Truijen S, De Valck C, Van de Heyning PH. The effect of early customized vestibular rehabilitation on balance after acoustic neuroma resection. Clin Rehabil. 2008 Aug; 22 (8):698–713. doi: 10.1177/0269215508089066. Available from: http://dx.doi.org/10.1177/0269215508089066 . [ PubMed ] [ Cross Ref ]
335. Magnusson M, Karlberg M, Tjernström F. PREHAB": vestibular prehabilitation to ameliorate the effect of a sudden vestibular loss. Neuro Rehabilitation. 2011; 29 :153–156. [ PubMed ]
336. Tjernström F, Fransson PA, Kahlon B, Karlberg M, Lindberg S, Siesjö P, Magnusson M. Vestibular PREHAB and gentamicin before schwannoma surgery may improve long-term postural function. J Neurol Neurosurg Psychiatr. 2009 Nov; 80 (11):1254–1260. doi: 10.1136/jnnp.2008.170878. Available from: http://dx.doi.org/10.1136/jnnp.2008.170878 . [ PubMed ] [ Cross Ref ]
337. Behari S, Tyagi I, Banerji D, Kumar V, Jaiswal AK, Phadke RV, Jain VK. Postauricular, transpetrous, presigmoid approach for extensive skull base tumors in the petroclival region: the successes and the travails. Acta Neurochir (Wien) 2010 Oct; 152 (10):1633–1645. doi: 10.1007/s00701-010-0701-y. Available from: http://dx.doi.org/10.1007/s00701-010-0701-y . [ PubMed ] [ Cross Ref ]
338. Schaller B, Probst R, Gratzl O, Rem JA, Hauser R, Tolnay M. Different aspects of hearing preservation in surgery of vestibular schwannoma in women and men. Acta Neurochir (Wien) 1996; 138 (11):1275–1281. doi: 10.1007/BF01411055. Available from: http://dx.doi.org/10.1007/BF01411055 . [ PubMed ] [ Cross Ref ]
339. Magliulo G, D'Amico R, Di Cello P. Delayed facial palsy after vestibular schwannoma resection: clinical data and prognosis. J Otolaryngol. 2003 Dec; 32 (6):400–404. doi: 10.2310/7070.2003.13968. Available from: http://dx.doi.org/10.2310/7070.2003.13968 . [ PubMed ] [ Cross Ref ]
340. Samii M, Gerganov V, Samii A. Improved preservation of hearing and facial nerve function in vestibular schwannoma surgery via the retrosigmoid appraoch in a series of 200 patients. J Neurosurg. 2006; 105 :527–535. doi: 10.3171/jns.2006.105.4.527. Available from: http://dx.doi.org/10.3171/jns.2006.105.4.527 . [ PubMed ] [ Cross Ref ]
341. Piccirillo E, Wiet MR, Flanagan S, Dispenza F, Giannuzzi A, Mancini F, Sanna M. Cystic vestibular schwannoma: classification, management, and facial nerve outcomes. Otol Neurotol. 2009 Sep; 30 (6):826–834. doi: 10.1097/MAO.0b013e3181b04e18. Available from: http://dx.doi.org/10.1097/MAO.0b013e3181b04e18 . [ PubMed ] [ Cross Ref ]
342. Yashar P, Zada G, Harris B, Giannotta SL. Extent of resection and early postoperative outcomes following removal of cystic vestibular schwannomas: surgical experience over a decade and review of the literature. Nurosurg Focus. 2012; 33 :E13. doi: 10.3171/2012.7.FOCUS12206. Available from: http://dx.doi.org/10.3171/2012.7.FOCUS12206 . [ PubMed ] [ Cross Ref ]
343. Irving RM, Viani L, Hardy DG, Baguley DM, Moffat DA. Nervus intermedius function after vestibular schwannoma removal: clinical features and pathophysiologocal mechanisms. Laryngoscope. 1995; 105 :809–813. doi: 10.1288/00005537-199508000-00007. Available from: http://dx.doi.org/10.1288/00005537-199508000-00007 . [ PubMed ] [ Cross Ref ]
344. Mulhern MG, Aduriz-Lorenzo PM, Rawluk D, Viani L, Eustace P, Logan P. Ocular complications of acoustic neuroma surgery. Br J Ophthalmol. 1999 Dec; 83 (12):1389–1392. doi: 10.1136/bjo.83.12.1389. Available from: http://dx.doi.org/10.1136/bjo.83.12.1389 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
345. Farris P, Brown K, Vuitch F, Meyerhoff WL. Middle ear mucocele: an unusual complication of the tranlabyrinthine approach to acoustic neuroma. Skull Base Surg. 1997; 7 (4):207–210. doi: 10.1055/s-2008-1058597. Available from: http://dx.doi.org/10.1055/s-2008-1058597 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
346. Fishman AJ, Marrinan MS, Golfinos JG, Cohen NL, Roland JT., Jr Prevention and management of cerebrospinal fluid leak following vestibular schwannoma surgery. Laryngoscope. 2004 Mar; 114 (3):501–505. doi: 10.1097/00005537-200403000-00022. Available from: http://dx.doi.org/10.1097/00005537-200403000-00022 . [ PubMed ] [ Cross Ref ]
347. Friedman RA, Cullen RD, Ulis J, Brackmann DE. Management options of cerebrospinal fluid leaks after acoustic tumour removal. Neurosurgery. 2007; 61 :35–39. doi: 10.1227/01.neu.0000289709.87802.12. Available from: http://dx.doi.org/10.1227/01.neu.0000289709.87802.12 . [ PubMed ] [ Cross Ref ]
348. Selesnick SH, Liu JC, Jen A, Carew JF. Management options for cerebrospinal fluid leak after vestibular schwannoma surgery and introduction of an innovative treatment. Otol Neurotol. 2004 Jul; 25 (4):580–586. doi: 10.1097/00129492-200407000-00027. Available from: http://dx.doi.org/10.1097/00129492-200407000-00027 . [ PubMed ] [ Cross Ref ]
349. Reece AT, O'Reilly B, Teasdale E, Todd NV. Subarachnoid fat embolism complicating autologous fat grafting following translabyrinthine excision of acoustic neuroma. J Laryngol Otol. 1989 Sep; 103 (9):870–871. doi: 10.1017/S0022215100110345. Available from: http://dx.doi.org/10.1017/S0022215100110345 . [ PubMed ] [ Cross Ref ]
350. Carvalho GA, Cervio A, Matthies C, Samii M. Subarachnoid fat dissemination after resection of a cerebellopontine angle dysontogenic cyst: case report and review of the literature. Neurosurgery. 2000; 47 :760–763. [ PubMed ]
351. Sanchez GB, Kaylie DM, O'Malley MR, Labadie RF, Jackson CG, Haynes DS. Chemical meningitis following cerebellopontine angle tumor surgery. Otolaryngol Head Neck Surg. 2008 Mar; 138 (3):368–373. doi: 10.1016/j.otohns.2007.10.038. Available from: http://dx.doi.org/10.1016/j.otohns.2007.10.038 . [ PubMed ] [ Cross Ref ]
352. Hertel V, Schick B. Diagnostik und Therapie von frontobasalen Liquorfisteln. Laryngo Rhino Otol. 2012; 91 :585–597. doi: 10.1055/s-0032-1316382. Available from: http://dx.doi.org/10.1055/s-0032-1316382 . [ PubMed ] [ Cross Ref ]
353. Mattock C, Crockard A. Does intravascular coagulation contribute to the operative mortality for large acoustic neuromas? J Neurol Neurosurg Psych. 1986; 49 :699–701. doi: 10.1136/jnnp.49.6.699. Available from: http://dx.doi.org/10.1136/jnnp.49.6.699 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
354. Wigand ME, Haid T, Berg M, Rettinger G. The enlarged transtemporal approach to the cerebellopontine angle: technique and indications. Acta Otorhinolaryngol Ital. 1982; 2 :571–582.
355. Shimada K, Kaneko Y, Sato I, Ezure H, Murakami G. Classification of the ophthalmic artery that arises from the middle meningeal artery in Japanese adults. Okajimas Folia Anat Jpn. 1995 Aug; 72 (2-3):163–176. [ PubMed ]
356. Brors D, Schäfers M, Bodmer D, Draf W, Kahle G, Schick B. Postoperative magnetic resonance imaging findings after transtemporal and translabyrinthine vesibular schwannoma resection. Laryngoscope. 2003; 113 :420–426. doi: 10.1097/00005537-200303000-00006. Available from: http://dx.doi.org/10.1097/00005537-200303000-00006 . [ PubMed ] [ Cross Ref ]
357. Minovi A, Mangold R, Kollert M, Hofmann E, Draf W, Bockmühl U. Funktionelle Ergebnisse, Lebensqualität, kognitive und affective Konsequenzen nach transtemporaler Extirpation von Akustikusneurinomen. Laryngorhinootologie. 2005; 84 :915–920. doi: 10.1055/s-2005-870573. Available from: http://dx.doi.org/10.1055/s-2005-870573 . [ PubMed ] [ Cross Ref ]
358. Schick B, Greess H, Gill S, Pauli E, Iro H. Magnetic resonance imaging and neuropsychological testing after middle fossa vestibular schwannoma surgery. Otol Neurotol. 2007; 29 :39–45. doi: 10.1097/mao.0b013e31815c2ad7. Available from: http://dx.doi.org/10.1097/mao.0b013e31815c2ad7 . [ PubMed ] [ Cross Ref ]
359. Thomsen J, Stougaard M, Becker B, Tos M, Jennum P. Middle fossa approach in vestibular schwannoma surgery. Postoperative hearing preservation and EEG changes. Acta Otolaryngol. 2000 Jun; 120 (4):517–522. doi: 10.1080/000164800750046027. Available from: http://dx.doi.org/10.1080/000164800750046027 . [ PubMed ] [ Cross Ref ]
360. Gjurić M, Wigand ME, Wolf SR. Enlarged middle fossa vestibular schwannoma surgery: experience with 735 cases. Otol Neurotol. 2001 Mar; 22 (2):223–230. doi: 10.1097/00129492-200103000-00019. Available from: http://dx.doi.org/10.1097/00129492-200103000-00019 . [ PubMed ] [ Cross Ref ]
361. Aggarwal R, Green KM, Ramsden RT. Epilepsy following middle-fossa extradural retraction: implications for driving. J Laryngol Otol. 2005 Nov; 119 (11):853–855. doi: 10.1258/002221505774783368. Available from: http://dx.doi.org/10.1258/002221505774783368 . [ PubMed ] [ Cross Ref ]
362. Jorgensen B, Pedersen CB. Medical and socio-economic status of patients operated on for acoustic neuroma. In: Tos M, Thomsen J, editors. Acoustic neuroma. Amsterdam/New York: Kugler Publications; 1992. pp. 881–886.
363. Parving A, Tos M, Thomsen J, Møller H, Buchwald C. Some aspects of life quality after surgery for acoustic neuroma. Arch Otolaryngol Head Neck Surg. 1992 Oct; 118 (10):1061–1064. doi: 10.1001/archotol.1992.01880100053013. Available from: http://dx.doi.org/10.1001/archotol.1992.01880100053013 . [ PubMed ] [ Cross Ref ]
364. Blomstedt GC, Katila H, Henriksson M, Ekholm A, Jääskeläinen JE, Pyykko I. Depression after surgery for acoustic neuroma. J Neurol Neurosurg Psychiatr. 1996 Oct; 61 (4):403–406. doi: 10.1136/jnnp.61.4.403. Available from: http://dx.doi.org/10.1136/jnnp.61.4.403 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
365. Keitner GI, Ryan CE, Miller IW, Kohn R, Epstein NB. 12-month outcome of patients with major depression and comorbid psychiatric or medical illness (compound depression) Am J Psychiatry. 1991 Mar; 148 (3):345–350. [ PubMed ]
366. Mc Kenna L, Hallam RS, Hinchcliffe R. The prevalence of psychological disturbance in neurotology outpatients. Clin Otolaryngol Allied Sci. 1991; 16 :452–456. doi: 10.1111/j.1365-2273.1991.tb01038.x. Available from: http://dx.doi.org/10.1111/j.1365-2273.1991.tb01038.x . [ PubMed ] [ Cross Ref ]
367. Ryzenman JM, Pensak ML, Tew JM., Jr Patient perception of comorbid conditions after acoustic neuroma management: survey results from the acoustic neuroma association. Laryngoscope. 2004 May; 114 (5):814–820. doi: 10.1097/00005537-200405000-00005. Available from: http://dx.doi.org/10.1097/00005537-200405000-00005 . [ PubMed ] [ Cross Ref ]
368. Mercke U, Magnusson M, Linderoth L, Harris S, Sundbarg G. Long-term effect of translabyrinthine acoustic neuroma surgery on work capacity. In: Tos M, Thomsen J, editors. Acoustic neuroma. Amsterdam/New York: Kugler Publications; 1992. pp. 877–880.
369. Wiegand DA, Fickel V. Acoustic neuroma - the patient's perspective: subjective assessment of symptoms, diagnosis, therapy, and outcome in 541 patients. Laryngoscope. 1989; 99 :179–187. [ PubMed ]
370. Hardy DG, Moffat DA. Acoustic neuroma surgery: how much morbidity is swept under the carpet. 3rd European Congress of Surgery; 1993; Londra.
371. Demetriades AK, Saunders N, Rose P, Fisher C, Rowe J, Tranter R, Hardwidge C. Malignant transformation of acoustic neuroma/vestibular schwannoma 10 years after gamma knife stereotactic radiosurgery. Skull Base. 2010 Sep; 20 (5):381–387. doi: 10.1055/s-0030-1253576. Available from: http://dx.doi.org/10.1055/s-0030-1253576 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
372. Kwon Y, Khang SK, Kim CJ, Lee DJ, Lee JK, Kwun BD. Radiologic and histopathologic changes after Gamma Knife radiosurgery for acoustic schwannoma. Stereotact Funct Neurosurg. 1999; 72 Suppl 1 :2–10. doi: 10.1159/000056433. Available from: http://dx.doi.org/10.1159/000056433 . [ PubMed ] [ Cross Ref ]
373. Balasubramaniam A, Shannon P, Hodaie M, Laperriere N, Michaels H, Guha A. Glioblastoma multiforme after stereotactic radiotherapy for acoustic neuroma: case report and review of the literature. Neuro-oncology. 2007 Oct; 9 (4):447–453. doi: 10.1215/15228517-2007-027. Available from: http://dx.doi.org/10.1215/15228517-2007-027 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
374. Sanna M, Fois P, Pasanisi E, Russo A, Bacciu A. Middle ear and mastoid glomus tumors (glomus tympanicum): an algorithm for the surgical management. Auris Nasus Larynx. 2010 Dec; 37 (6):661–668. doi: 10.1016/j.anl.2010.03.006. Available from: http://dx.doi.org/10.1016/j.anl.2010.03.006 . [ PubMed ] [ Cross Ref ]
375. Weber PC, Patel S. Jugulotympanic paragangliomas. Otolaryngol Clin North Am. 2001 Dec; 34 (6):1231–40, x. doi: 10.1016/S0030-6665(05)70376-5. Available from: http://dx.doi.org/10.1016/S0030-6665(05)70376-5 . [ PubMed ] [ Cross Ref ]
376. Fisch U, Mattox D. Microsurgery of the skull base. Stuttgart, New York: Thieme Verlag; 1988. pp. 148–281.
377. Schick B, Draf W, Kahle G. Jugulotympanale Paragangliome: Therapiekonzepte in der Entwicklung. Laryngo Rhino Otol. 1998; 77 :434–443. doi: 10.1055/s-2007-997004. Available from: http://dx.doi.org/10.1055/s-2007-997004 . [ PubMed ] [ Cross Ref ]
378. Bickerstaff ER, Howell JS. The neurological importance of tumours of the glomus jugulare. Brain. 1953; 76 (4):576–593. doi: 10.1093/brain/76.4.576. Available from: http://dx.doi.org/10.1093/brain/76.4.576 . [ PubMed ] [ Cross Ref ]
379. Steinberg N, Holz WG. Glomus jugularis tumors. Arch Otolaryngol. 1965 Oct; 82 (4):387–394. doi: 10.1001/archotol.1965.00760010389009. Available from: http://dx.doi.org/10.1001/archotol.1965.00760010389009 . [ PubMed ] [ Cross Ref ]
380. Cece JA, Lawson W, Biller HF, Eden AR, Parisier SC. Complications in the management of large glomus jugulare tumors. Laryngoscope. 1993; 97 :152–157. [ PubMed ]
381. Poe DS, Jackson G, Glasscock ME, Johnson GD. Long-term results after lateral cranial base surgery. Laryngoscope. 1991 Apr; 101 (4 Pt 1):372–378. [ PubMed ]
382. Milewski C. Morphologie und Klinik der Paragangliome im Kopf-Hals-Bereich. HNO. 1993; 41 :526–531. [ PubMed ]
383. Makek M, Franklin DJ, Zhao JC, Fisch U. Neural infiltration of glomus temporale tumors. Amer J Otol. 1990; 11 :1–5. [ PubMed ]
384. Cole JM, Beiler D. Long-term results of treatment for glomus jugulare and glomus vagale tumors with radiotherapy. Laryngoscope. 1994 Dec; 104 (12):1461–1465. doi: 10.1288/00005537-199412000-00006. Available from: http://dx.doi.org/10.1288/00005537-199412000-00006 . [ PubMed ] [ Cross Ref ]
385. Spector GJ, Compagno J, Perez CA, Maisel RH, Ogura JH. Glomus jugulare tumors: effects of radiotherapy. Cancer. 1975 May; 35 (5):1316–1321. doi: 10.1002/1097-0142(197505)35:5<1316::AID-CNCR2820350511>3.0.CO;2-#. Available from: http://dx.doi.org/10.1002/1097-0142(197505)35:5<1316::AID-CNCR2820350511>3.0.CO;2-# . [ PubMed ] [ Cross Ref]
386. Sanna M, Jain Y, De Donato G, Rohit, Lauda L, Taibah A. Management of jugular paragangliomas: the Gruppo Otologico experience. Otol Neurotol. 2004 Sep; 25 (5):797–804. doi: 10.1097/00129492-200409000-00025. Available from: http://dx.doi.org/10.1097/00129492-200409000-00025 . [ PubMed ] [ Cross Ref ]
387. Green JD, Jr, Brackmann DE, Nguyen CD, Arriaga MA, Telischi FF, De la Cruz A. Surgical management of previously untreated glomus jugulare tumors. Laryngoscope. 1994; 104 :917–921. doi: 10.1288/00005537-199408000-00001. Available from: http://dx.doi.org/10.1288/00005537-199408000-00001 . [ PubMed ] [ Cross Ref ]
388. Jackson CG, McGrew BM, Forest JA, Netterville JL, Hampf CF, Glasscock ME., 3rd Lateral skull base surgery for glomus tumors: long-term control. Otol Neurotol. 2001 May; 22 (3):377–382. doi: 10.1097/00129492-200105000-00018. Available from: http://dx.doi.org/10.1097/00129492-200105000-00018 . [ PubMed ] [ Cross Ref ]
389. Manolidis S, Jackson CG, Von Doersten PG, Pappas D, Glasscock ME. Lateral skull base surgery: the otology group experience. Skull Base Surg. 1997; 7 (3):129–137. doi: 10.1055/s-2008-1058604. Available from: http://dx.doi.org/10.1055/s-2008-1058604 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
390. Moe KS, Li D, Linder TE, Schmid S, Fisch U. An update on the surgical treatment of temporal bone paraganglioma. Skull Base Surg. 1999; 9 (3):185–194. doi: 10.1055/s-2008-1058145. Available from: http://dx.doi.org/10.1055/s-2008-1058145 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
391. CAPPS FC. Glomus jugulare tumours of the middle ear. J Laryngol Otol. 1952 Jul; 66 (7):302–314. doi: 10.1017/S002221510004771X. Available from: http://dx.doi.org/10.1017/S002221510004771X . [ PubMed ] [ Cross Ref ]
392. Fisch U. Infratemporal fossa approach to tumours of the temporal bone and base of the skull. J Laryngol Otol. 1978 Nov; 92 (11):949–967. doi: 10.1017/S0022215100086382. Available from: http://dx.doi.org/10.1017/S0022215100086382 . [ PubMed ] [ Cross Ref ]
393. Fisch U. Current surgical treatment of intratemporal facial palsy. Clin Plast Surg. 1979 Jul; 6 (3):377–388. [ PubMed ]
394. Brackman D, Kinney S, Fu K. Glomus tumor: diagnosis and management. Head Neck Surg. 1987 May-Jun; 9 (5):306–311. doi: 10.1002/hed.2890090511. Available from: http://dx.doi.org/10.1002/hed.2890090511 . [ PubMed ] [ Cross Ref ]
395. Jackson CG, Glasscock ME, 3rd, Nissen AJ, Schwaber MK. Glomus tumor surgery: the approach, results, and problems. Otolaryngol Clin North Am. 1982 Nov; 15 (4):897–916. [ PubMed ]
396. Glasscock ME, 3rd, Harris PF, Newsome G. Glomus tumors: diagnosis and treatment. Laryngoscope. 1974; 84 :2006–2032. [ PubMed ]
397. Al-Mefty O, Teixeira A. Complex tumors of the glomus jugulare: criteria, treatment, and outcome. J Neurosurg. 2002 Dec; 97 (6):1356–1366. doi: 10.3171/jns.2002.97.6.1356. Available from: http://dx.doi.org/10.3171/jns.2002.97.6.1356 . [ PubMed ] [ Cross Ref ]
398. Brackmann DE. The facial nerve in the infratemporal approach. Otolaryngol Head Neck Surg. 1987 Jul; 97 (1):15–17. [ PubMed ]
399. Leonetti JP, Brackmann DE, Prass RL. Improved preservation of facial nerve function in the infratemporal approach to the skull base. Otolaryngol Head Neck Surg. 1989 Jul; 101 (1):74–78. [ PubMed ]
400. House WF, Hitselberger WE. The transcochlear approach to the skull base. Arch Otolaryngol. 1976 Jun; 102 (6):334–342. doi: 10.1001/archotol.1976.00780110046004. Available from: http://dx.doi.org/10.1001/archotol.1976.00780110046004 . [ PubMed ] [ Cross Ref ]
401. Liu JK, Sameshima T, Gottfried ON, Couldwell WT, Fukushima T. The combined transmastoid retro- and infralabyrinthine transjugular transcondylar transtubercular high cervical approach for resection of glomus jugulare tumors. Neurosurgery. 2006 Jul; 59 (1 Suppl 1):ONS115–ONS125. doi: 10.1227/01.NEU.0000220025.81500.8D. Available from: http://dx.doi.org/10.1227/01.NEU.0000220025.81500.8D . [ PubMed ] [ Cross Ref ]
402. Fisch U. Infratemporal fossa approach for glomus tumors of the temporal bone. Ann Otol Rhinol Laryngol. 1982 Sep-Oct; 91 (5 Pt 1):474–479. [ PubMed ]
403. Russo A, Piccirillo E, De Donato G, Agarwal M, Sanna M. Anterior and Posterior Facial Nerve Rerouting: A Comparative Study. Skull Base. 2003 Aug; 13 (3):123–130. doi: 10.1055/s-2003-43322. Available from: http://dx.doi.org/10.1055/s-2003-43322 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
404. Borba LAB, Araújo JC, De Oliveira JG, Filho MG, Moro MS, Tirapelli LF, Colli BO. Surgical management of glomus jugulare tumors: a proposal for approach selection based on tumor relationships with the facial nerve. J Neurosurg. 2010; 112 :88–98. doi: 10.3171/2008.10.JNS08612. Available from: http://dx.doi.org/10.3171/2008.10.JNS08612 . [ PubMed ] [ Cross Ref ]
405. Draf W. Rehabilitation des gelähmten Gesichts. In: Naumann HH, Helsm J, Herberhold C, Jahrsdoerfer RA, Lastenbauer ER, Panje WR, Tardy ME Jr, editors. Kopf- und Hals-Chirurgie. Band 1: Gesicht, Nase und Gesichtsschädel, Teil II. 1995. pp. 831–886.
406. Jackson CG, Kaylie DM, Coppit G, Gardner EK. Glomus jugulare tumors with intracranial extension. Neurosurg Focus. 2004 Aug; 17 (2):E7. doi: 10.3171/foc.2004.17.2.7. Available from: http://dx.doi.org/10.3171/foc.2004.17.2.7 . [ PubMed ] [ Cross Ref ]
407. Murphy TP, Brackmann DE. Effects of preoperative embolization on glomus jugulare tumors. Laryngoscope. 1989 Dec; 99 (12):1244–1247. doi: 10.1288/00005537-198912000-00007. Available from: http://dx.doi.org/10.1288/00005537-198912000-00007 . [ PubMed ] [ Cross Ref ]
408. Valavanis A. Preoperative embolization of the head and neck: indications, patient selection, goals, and precautions. AJNR Am J Neuroradiol. 1986 Sep-Oct; 7 (5):943–952. [ PubMed ]
409. Gruber A, Bavinzski G, Killer M, Richling B. Preoperative embolization of hypervascular skull base tumors. Minim Invasive Neurosurg. 2000 Jun; 43 (2):62–71. doi: 10.1055/s-2000-8321. Available from: http://dx.doi.org/10.1055/s-2000-8321 . [ PubMed ] [ Cross Ref ]
410. Gartrell BC, Hansen MR, Gantz BJ, Gluth MB, Mowry SE, Aagaard-Kienitz BL, Baskaya MK, Gubbels SP. Facial and lower cranial neuropathies after preoperative embolization of jugular foramen lesions with ethylene vinyl alcohol. Otol Neurotol. 2012 Sep; 33 (7):1270–1275. doi: 10.1097/MAO.0b013e31825f2365. Available from: http://dx.doi.org/10.1097/MAO.0b013e31825f2365 . [ PMC free article ] [ PubMed ] [ Cross Ref ]
411. Herdman RC, Gillespie JE, Ramsden RT. Facial palsy after glomus tumour embolization. J Laryngol Otol. 1993 Oct; 107 (10):963–966. doi: 10.1017/S0022215100124934. Available from: http://dx.doi.org/10.1017/S0022215100124934 . [ PubMed ] [ Cross Ref ]
412. Marangos NM, Schumacher M. Facial palsy after glomus jugulare tumor embolization. J Laryngol Otol. 1999; 113 :268–270. doi: 10.1017/S0022215100143762. Available from: http://dx.doi.org/10.1017/S0022215100143762 . [ PubMed ] [ Cross Ref ]
413. Ozanne A, Pereira V, Krings T, Toulgoat F, Lasjaunias P. Arterial vascularization of the cranial nerves. Neuroimaging Clin N Am. 2008 May; 18 (2):431–9, xii. doi: 10.1016/j.nic.2007.12.010. Available from: http://dx.doi.org/10.1016/j.nic.2007.12.010 . [ PubMed ] [ Cross Ref ]
414. Erickson D, Kudva YC, Ebersold MJ, Thompson GB, Grant CS, van Heerden JA, Young WF Jr. Benign paragangliomas: clinical presentation and treatment outcomes in 236 patients. J Clin Endocrinol Metab. 2001 Nov; 86 (11):5210–5216. doi: 10.1210/jc.86.11.5210. Available from: http://dx.doi.org/10.1210/jc.86.11.5210 . [ PubMed ] [ Cross Ref ]
415. Graillon T, Fuentes S, Régis J, Metellus P, Brunel H, Roche PH, Dufour H. Multidisciplinary management of giant functional petrous bone paraganglioma. Acta Neurochir (Wien) 2011 Jan; 153 (1):85–89. doi: 10.1007/s00701-010-0818-z. Available from: http://dx.doi.org/10.1007/s00701-010-0818-z . [ PubMed ] [ Cross Ref ]
416. Gold SR, Kamerer DB Jr. Preservation of conductive hearing in approaches to tumors of the jugular foramen. Otol Neurotol. 2006 Dec; 27 (8):1126–1130. doi: 10.1097/01.mao.0000235965.07733.3f. Available from: http://dx.doi.org/10.1097/01.mao.0000235965.07733.3f . [ PubMed ] [ Cross Ref ]
417. Briner HH, Linder TE, Pauw B, Fisch U. Long-term results of surgery for temporal bone paragangliomas. Laryngoscope. 1999; 109 :577–583. doi: 10.1097/00005537-199904000-00011. Available from: http://dx.doi.org/10.1097/00005537-199904000-00011 . [ PubMed ] [ Cross Ref ]
418. Danesi G, Mazzoni A, Pareschi R, Zappone C, Sanna M. Results of surgery for C-class glomus tumors of the temporal bone: treatment options. In: Mazzoni A, Sanna M, editors. Skull base surgery – Update. Amsterdam, New York: Kugler publications; 1995. pp. 301–304.
419. Anand VK, Leonetti JP, al-Mefty O. Neurovascular considerations in surgery of glomus tumors with intracranial extensions. Laryngoscope. 1993 Jul; 103 (7):722–728. doi: 10.1288/00005537-199307000-00003. Available from: http://dx.doi.org/10.1288/00005537-199307000-00003 . [ PubMed ] [ Cross Ref ]
420. Woods CI, Strasnick B, Jackson CG. Surgery for glomus tumors: the Otology Group experience. Laryngoscope. 1993 Nov; 103 (11 Pt 2 Suppl 60):65–70. [ PubMed ]
421. O'Leary MJ, Shelton C, Giddings NA, Kwartler J, Brackmann DE. Glomus tympanicum tumors: a clinical perspective. Laryngoscope. 1991 Oct; 101 (10):1038–1043. [ PubMed ]
Articles from GMS Current Topics in Otorhinolaryngology, Head and Neck Surgery are provided here courtesy of German Medical Science
Verhoeven JW, Timmenga NM, Cune MS
[Vertigini e nausea dopo il posizionamento dell'impianto]. [Caso Report, inglese Astratto, Journal Article]
Ned Tijdschr Tandheelkd 2012 Novembre; 119 (11) :537-9.
riassunto
Un paziente ha sofferto di episodi di vertigini e nausea subito dopo il posizionamento di 4 impianti nella sua mascella edentula. Durante il trattamento sono stati utilizzati trapani impianti e osteotomi. Durante i 6 mesi successivi, le lamentele scomparvero gradualmente. La presentazione montato la diagnosi non molto noto traumatico concussione labirintica. Prima di trattare i pazienti con protesi orali nel mascellare superiore, è necessario informarli su questa complicazione potenziale invalidante. La complicazione può essere evitato utilizzando una spatola osso vite, che rende l'uso di un martello chirurgica inutile.
. J Surg Craniofac 2013 Jan; 24 (1): e89-90. doi: 10,1097 / SCS.0b013e318272d9e0.
Vertigine parossistica posizionale benigna seguente setto rinoplastica.
Koc EA 1, Koc B, Eryaman E, Ozluoglu LN.
· 1 Dipartimento di Otorinolaringoiatria, Baskent University, Istanbul Ospedale, Cevre Ospedale, Istanbul, Turchia. Questo indirizzo email è protetto dagli spambots. È necessario abilitare JavaScript per vederlo.
Astratto
Presentiamo 2 casi di vertigine parossistica posizionale benigna (VPPB) in seguito septorhinoplasty. Vertigine parossistica posizionale benigna seguito septorhinoplasty è un'entità inusuale. Due giovani donne che hanno avuto difficoltà a respirare e nasale deformità sottoposti septorhinoplasty. Sulla seconda e la terza giorni postoperatori, i pazienti hanno vertigine che è stato indotto dai cambiamenti di posizione. Entrambi i pazienti avevano né malattia dell'orecchio preesistente né vertigine prima della chirurgia. Tutti gli esami erano normali. Con Dix-Hallpike manovra, che è la prova criterio di standard, è stata osservata la nistagmo caratteristico. Destra canale posteriore VPPB è stata diagnosticata, ed erano entrambi trattati con Epley canalith riposizionamento manovra. Pubblicazioni relative alla vertigine post-chirurgica sono disponibili in letteratura, ma è ancora una malattia sottodiagnosticata. Vorremmo parlare di questa rara entità e informare i chirurghi che devono tenere a mente che un paziente che lamenta vertigini o capogiri dopo l'intervento deve essere osservato e indagato per VPPB.